удк123. УДК1 (Автосохраненный). Удк перспективы фармакогностического изучения листьев лавра благородного (laurus nobilisl.)
 Скачать 349.96 Kb. Скачать 349.96 Kb.
|
|
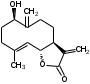
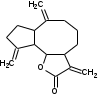
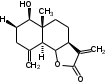
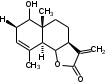
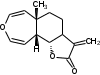
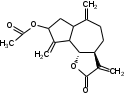
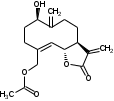
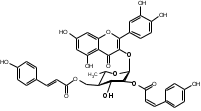
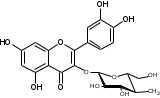
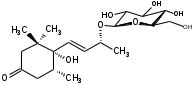
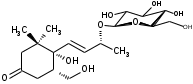
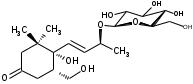
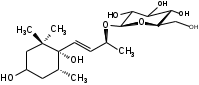
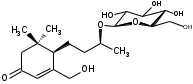
УДК ПЕРСПЕКТИВЫ ФАРМАКОГНОСТИЧЕСКОГО ИЗУЧЕНИЯ ЛИСТЬЕВ ЛАВРА БЛАГОРОДНОГО (LAURUS NOBILISL.) Орлов А.Н., Дайронас Ж.В. 1Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России, 357532, Россия, г. Пятигорск, пр. Калинина, д. 11, кафедра фармакогнозии и ботаники, E-mail: atnival@mail.ru Аннотация. Ключевые слова: Лавр благородный, Laurus nobilis L., семейство Lauraceae. Введение. Laurus nobilis L. (лавр благородный, сем. Lauraceae) - это вечнозеленое дерево или древовидный кустарник высотой 15 – 20 м. Лавр благородный широко распространён в странах Средиземноморья и Европы, а также разводится на Черноморском побережье Кавказа и Крыма[1], Северной Африки и Аравийского полуострова [15]. Основным источником растительного сырья являются листья, которые используется как приправа и пряность в процессе приготовления различных кулинарных блюд и консервирования продуктов. Помимо кулинарии листья применяются в народной медицине при грибковых, бактериальных, вирусных заболеваниях, проявляют противовоспалительные, седативные и противоэпилептические свойства. Извлечения листьев(отвары, настои, чаи) используются при желудочно-кишечных нарушениях, метеоризме, астме, дисменорее, ревматизме, сердечно - сосудистых отклонениях и стимулировании иммунной системы [15, 30, 31, 54]. В качестве основных действующих веществ в листьях лавра благородного описаны компоненты эфирного масла, сесквитерпеновые лактоны, жирные кислоты и фенольные соединения (флавоноиды, фенольные кислоты и гликозиды) [2]. Материалы и методы. Результаты и обсуждение. ЭФИРНОЕ МАСЛО Основными компонентами эфирного масла L. nobilis являются циклические и бициклические монотерпены: 1,8-цинеол, α-терпенилацетат, терпинен-4-ол, линалоол, сабинин, 2-карен, транс-оцимен, цис-оцимен, транс-кариофиллен; со значительным преобладанием 1,8-цинеола (25 – 75%) [3-12]. Выход масла как правило составляет от 0,6% до 2%. Для его получения основным методом служит паровая гидродистилляция, кроме того в настоящее время с этой целью используют сверхкритическую флюидную СО2 экстракцию (СКФ) и термическую микроволновую, или СВЧ - экстракцию, благодаря который выход эфирного масла несколько выше, если сравнивать с обычной гидродистяллицией [7, 10-12]. Эфирное масло обладает сильной антибактериальной и противогрибковой активностью, которое описано во многочисленных исследованиях [45,46, 47]. Так, например, в процессе изучения in vitro на трех бактериальных штаммов: St. intermedius и Klebsiella pneumonia, Staphylococcusaureus , минимальная ингибирующая концентрации составила от 0,01 до 1 мг/мл [41], . Как известно, цинеол, линалоол и сабинен тоже проявляют выраженные противомикробные свойства [42, 43, 44]. В тестах на лабораторных животных, болеутоляющие и противовоспалительные свойства эфирного масла по активность было сопоставимо с действием пироксикама и морфина [35]. По опытным данным, достоверно было показано, что после сеанса аромапсихорелаксации у испытуемых значительно повышается умственная работоспособность, а также незначительно оптимизируются функции сердечно – сосудистой системы после физической нагрузки [6]. СЕСКВИТЕРПЕНОВЫЕ ЛАКТОНЫ Сесквитерпеновые лактоны, выделенные из листьев Лавра благородного, показали высокую биологическую и фармакологическую активность, по данным многих исследований. Они обладают следующими видами активности: противомикробной, противогрибковой [30], антидиабетической, противоспалительной (подавляют выработку оксида азота), гепатопротекторной [34], подавляют поглощение спирта, увеличивают активности глутатион-S-трансферазы печени, индуцируют апоптоз [22]. Наиболее активно показали себя следующие сесквитерпеновые лактоны: Таблица 1 – Сесквитерпеновые лактоны листьев L. nobilis
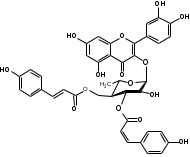
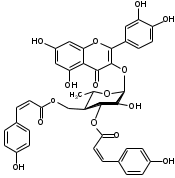
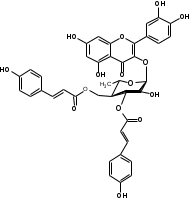
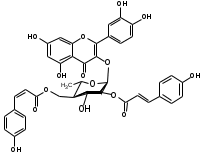
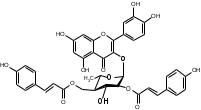
Костунолид обладает цитотоксическим и противоопухоливым действием на различные раковые клетки человека, ингибирует рост клеток MCF-7 и MDA-MB-231, снижая активность теломеразы [16]. Костунолид (1) усиливает активность S-трансферазы глутатиона печени [26], индуцирует регуляторный белок апоптоза - Bcl-2 [28]. Костунолид (1) и дегидрокостус лактон (2) обладают выраженной противотуберкулезной активностью по отношению к Mycobacterium tuberculosis H37Rv. Причём ингибирование в отношении клинических лекарственно-устойчивых изолятов M. tuberculosis их смеси была выше, чем для отдельных лактонов [15, 31]. Hibasami и др. [33] определили, что сесквитерпеновые лактоны костунолид (1) и залузин D (6) проявляют противоопухолевую активность в отношении лейкозных клеток (HL-60) человека и вызывают апоптоз, через конденсацию хроматина. Сесквитерпены, особенно 15-ацетоксикостунолид (7), сантамарин (4), рейнозин (3), залузин D (6) ингибируют активацию клеток микроглии, продуцирующих оксид азота (NO), реакционноспособные виды кислорода (ROS) и провоспалительные цитокины, что может использоваться для лечения таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона [17]. Согласно предыдущим исследованиям гексановые и этилацетатные экстракты листьев проявляют высокую биологическую активность в индукции апоптоза [22]. Рейнозин (3), сантамарин (4), спирафолид (5) и костунолид (1) обладают противомикробным [28] и антиоксидантными свойствами [28]. Рейнозин (3) и сантамарин (4) также проявляют цитотоксическую активность против клеточной линии GLC4 карциномы легких и клеточной линии колоректального рака COLO 320 (IC50 = 124 мМ) [23]. Кроме того они способны ингибировать абсорбцию спирта и образование оксида азота [24]. Как сообщается, спирафолид (5) обладает противовоспалительным эффектом [24] и также ингибирует поглощение спирта[25]. Сесквитерпеновые лактоны оказывают бактериостатическое и бактериоцидное действия в отношении как грамм-положительных (Lactobacillus delbrueckii, Bacillus cereus 11778, Listeria monocytogenes , Staphylococcus aureus и др.), так и грамм-отрицательных бактерий (Citrobacter freundii , Yersinia enterolitica , Proteus penneri, Proteus mettegeri , Escherichia coli и др.) [18]. Антибактериальная активность объясняется наличием соединений эфирного масла, которые могут ингибировать синтез пептидогликана [19], повреждать мембранную структуру микробов [20], изменять гидрофобность поверхности бактериальной мембраны [21]. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ В листьях лавра благородного обнаружены следующие соединения фенольной природы: аскорбиновая, ванилиновая, изоферуловая, кофейная, галловая, цикориевая кислоты, галлат эпигаллокатехина, эпикатехин, дикумарин, лютеолин-7-глюкозид, кверцетин-3-глюкозид, кемпферол-3-галактозид [39, 40]. В своих исследованиях Muchuweti [51] подтвердил присутствие в экстракте листьев кофеиновой, ферулиновой и ванильных кислот с помощью ВЭЖХ. Lu [43] выявил в этанольных экстрактах наличие некоторых флавоноидов, неизвестных фенольных кислот и рутинина. Был идентифицирован лютеолин [56]. Фенольные извлечения согласно проведенным исследованиям, проявляют активность в отношении грибов, бактерий и некоторых линий опухолевых клеток человека (HeLa, MCF7, NCI-H460 и HCT15) [55]. Качественное и количественное содержание разных групп фенольных веществ изменяется в зависимости от места произрастания растения, фазы заготовки, способа сушки и извлечения сырья [50, 52]. ГЛИКОЗИДЫ В листьях лавра благородного были обнаружены ацилированные кемпферольные гликозиды [35, 37, 39]. Таблица 2 – Гликозиды листьев L. nobilis
Согласно исследованиям, все данные соединения подгруппы кемпферольных гликозидов проявили себя, как мощные ингибиторы активности Na+/K+ - аденозинтрифосфатазы (АТФ-аза), что в свою очередь может использоваться для лечения некоторых сердечных заболеваний, в частности застойной сердечной недостаточности и сердечных аритмий. Соединения (4) и (6) также показали высокую противомикробную активность [40]. Флавоноид изокверцетин, выделенный из этанольного извлечения показал очень высокую антиоксидантную активность [56]. Кроме того были выявлены пять мегастигманных гликозида, под названием -лаурозиды А-Е, обладающие цитотоксическими свойствами и способностью подавлять выработку оксида азота (NO) [37]. Таблица 3 – Лаурозиды А-E листьев L. nobilis
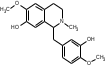
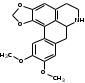
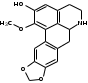
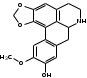
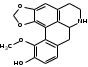
Также согласно данным, Лаурозид В, выделенный из листьев лавра благородного подавляет пролиферацию трёх клеточных линий меланомы человека (A375, WM115 и SK-Mel-28) [39]. В ходе исследований Luigia и др. [14] в плодах лавра благородного были идентифицированы четыре антоциана: 3-O-гликозид цианидина; 3-O-рутинозид цианидина; 3-O-глюкозид и 3-оротинозид-23.Со значительным преобладанием двух первых, соответственно. АЛКАЛОИДЫ
Заключение. Библиографический список. Никитина А.А., Панкова И.А. Анатомический атлас полезных и некоторых ядовитых растений.– М.: Наука, 1982. – С. 387 – 393. Насухова Н.М., Коновалов Д.А. Хроматографическое изучение фенольных соединений листьев лавра благородного//Фармакологическое и ботаническое изучение лекарственных растений. – 2015. - № 70. С. – 66 – 68. Cherrat, L., Espina, L., Bakkali, M., García-Gonzalo, D., Pagán, R., & Laglaoui, A. (2014). Chemical composition and antioxidant properties of Laurus nobilis L. and Myrtus communis L. essential oils from Morocco and evaluation of their antimicrobial activity acting alone or in combined processes for food preservation. Journal of the Science of Food and Agriculture, 94, 1197–1204. Boulila A, Hassen I, Haouari L, Mejri F, Ben Amor I, Casabianca C, Hosni K (2015) Enzyme-assisted extraction of bioactive compounds from bay leaves (Laurus nobilis L.). Ind Crop Prod 74:485–493 Laurus nobilis: Composition of Essential Oil and Its Biological Activities L Caputo, F Nazzaro, LF Souza, L Aliberti, L De Martino, F Fratianni, Raffaele Coppola, Vincenzo De Feo Molecules 22 (6), 930 Ярош А. М.,Тонковцева В.В., Марчук Н.Ю, Павлова Е.А., Косолапов А.Н., Борода Т.В., Серобаба Л.А., Середина О.С., Борисова Е.В., Максимова И.Н., Овчаренко Ю.П., Сущенко Л.Г., Державицкая Н.И., Страшко И.Ю., Грицкевич О.И., Кулик Н.И., Самотковская Т.А.Сравнительная характеристика влияния эфирных масел разных растений на психоэмоциональное состояние человека. Сборник научных трудов ГНБС. 2015. Том 141 Flamini G., Tebano M., Cioni P.L., at al. Comparision between the conventional method of extraction of essential oil of Laurus Nobilis L. and novel method which uses microwaves applied in situ, without resorting to an oven // J. Chromatography A. 2007. N1143. Pp. 36–40 Хромато-масс-спектрометрическое исследование компонентного химического состава эфирного масла LAURUS NOBILIS L. ИЗ АБХАЗИИ Carreda A., Marongiu D., Porcedda S., Soro C. Supercritical CO2 extraction and characterization of Laurus nobilis essential oil // J. Agric. Food Chem. 2002. N30. p. 1492–496. Marzouki H., Khaldi A., Marongiu B. et al. Isolation of the oils from Laurus Nobilis of Tunisia and Algeria by supercritical CO2 extraction // Electronic J. Environm. Agricult. Food Chem. 2004. N3. Pp. 113–118. Marzouki H., Piras A., et al. Extraction and separation of volatile and fixed oils from berries of Laurus Nobilis by supercriticalCO2 extraction // Molecules. 2008. N13. Pp. 1702–1711. Zekovi Z.P., Lepojevi Z.D., Muji I.O. Laurel extracts obtained by steam distillation, supercritical fluid and solvent extraction // J. Nat. Prod. 2009. Vol. 2. Pp. 104–109. Ivanovi J. et al. Supercritical CO2 extract and essential oil of bay (Laurus Nobilis L.) – chemical composition andantibacterial activity // J. Serbian Chem. Soc. 2010. Vol. 75(3). Pp. 395–404. Luigia L, Giuseppe V. Anthocyanins from Bay (Laurus nobilis L.) Berries, J. Agric. Food Chem.2005; 53(20): 8063–8067. Н.М. Насухова, О.М. Шевчук, Л.А. Логвиненко - Исследование фенольных соединений в извлечениях из листьев лавра благородного. Фармация и фармакология - 2017г. №2 (3). С. 23-33. Choi S.H., Im E, Kang HK, Lee JH, Kwak HS, Bae YT, Park HJ, Kim ND (2005) Inhibitory effects of costunolide on the telomerase activity in human breast carcinoma cells. Cancer Lett 227:153–162 Hongqiang Chen, Chunfeng Xie, Hao Wang, Da-Qing Jin, Shen Li, Meicheng Wang, Quanhui Ren, Jing Xu, Yasushi Ohizumi, and Yuanqiang Guo. Sesquiterpenes Inhibiting the Microglial Activation from Laurus nobilis. pp 4784–4788. May 6, 2014. J. El Malti and H. Amarouch, “Antibacterial effect, histological impact and oxidative stress studies from Laurus nobilis extract”, Journal of Food Quality, vol.32, №.2, 190–208, 2009 Ogunlana, E.O., Hoeglund, S., Onawunmi, G., Skoeld, O. Effects of lemongrass oil on the morphological characteristics and peptidoglycan synthesis of Escherichia coli cells. Microbios 50, 43–59. 1987. Cox, S.D., Mann, J.L., Markham, H.C., Bell, J.E., Gustafson, J.R., Warmington S.G. The mode of antimicrobial action of the essential oil of Melaleuca alternifolia (tea tree oil). J. Appl. Microbiol. 88, 170–175. 2000. Turi, M., Turi, S.K., Mikelsaar, B. Influence of aqueous extracts of medicinal plants on surface hydrophobicity of Escherichiacoli strains of different origin. APMIS 105, 956–962. 1997. Fang F., Sang S., Chen K.Y., GOSSL AU A., HO C.T., ROSEN R.T. Isolation and identification of cytotoxic compounds from Bay leaf (Laurus nobilis). Food Chem. 93, 497–501. 2005. Goren N., Woerdenbag H.J., Bozok-johansson C. Cytotoxic and antibacterial activities of sesquiterpene lactones isolated from Tanacetum praeteritum. Planta Med. 62, 419–422. 1996. Matsuda H., Kagerura T., Toguchia I., Ueda H., Morikawa T., Yoshikawa M. Inhibitory effects of sesquiterpenes from Bay leaf on nitric oxide production in lipopolysaccharide-activated macrophages: Structure requirement and role of heat shock protein induction. Life Sci. 66, 2151–2157. 2000a. Yoshikawa M. Recent research on herbal medicines – characterization of bioactive constituents. Fragrance J. 29, 13–23. 2001. Wada K., Ueda N., Sawada H., Amemiya N., HAGA M. Nat. Med. 51(3), 283–285. 1997 Babish J.G., Howell T.M., Pacioretty L.M. Combinations of sesquiterpene lactones and diterpene triepoxide lactones for synergistic inhibition of cyclooxygenase-2. Patent Corporation Treaty (PCT) International Applications. 67. 2002. Dadalioglu I., Evrendilek G.A. Chemical compositions and antibacterial effects of essential oils of Turkish oregano (Origanum minutiflorum), bay laurel (Laurus nobilis), Spanish lavender (Lavandula stoechas L.), and fennel (Foeniculum vulgare) on common foodborne pathogens. J. Agric. Food Chem. 52, 8255–8260.2004. Ferreira A., Proenc C., Serralheiro M.L.M. and Aràujo M. E. M. The in vitro screening for acetylcholinesterase inhibition and antioxidant activity of medicinal plants from Portugal. J. Ethnopharmacol. 108, 31–37. 2006. Fukuyama N., Ino Ch., Suzuki Y. et al. Antimicrobial sesquiterpenoids from Laurus nobilis L. // Natural Product Research. 2011. Vol. 25, N 14. P. 1295-130. Julianti E., Jang K. H., Lee S. et al. Sesquiterpenes from the leaves of Laurus nobilis L. // Phytochemistry. 2012. Vol. 80. P.70-76. Luna-Herrera J., Costa M.C., Gonzalez H.G. et al. Synergistic antimycobacterial activities of sesquiterpene lactones from Laurus spp. // Journal of Antimicrobial Chemotherapy. 2007. Vol. 59, Is. 3. P. 548-552. Hibasami H., Yamada Y., Moteki H. et al. Sesquiterpenes (costunolide and zaluzanin D) isolated from laurel (Laurus nobilis L.) induce cell death and morphological change indicative of apoptotic chromatin condensation in leukemia HL-60 cells // International Journal of Molecular Medicine. 2003. Vol. 12. P. 147-151. Lim S., Lee S.-J., Nam K.-W. et al. Hepatoprotective effects of reynosin against thioacetamideinduced apoptosis in primary hepatocytes and mouse liver // Arch. Pharm. Res. 2013. Vol.36, Is. 4. P. 485-494. Patrakar R., Mansuriya M., Patil P. Phytochemical and Pharmacological Review on Laurus Nobilis // International Journal of Pharmaceutical and Chemical Sciences. 2012. Vol. 1, Is. 2. P. 595-602. Christel F, Bruno D, Isabelle F, Joseph V. Acylated kaempferol glycosides from laurus nobilis Leaves. Phytochernisty. 1998; 47(5): 821-824. Marino SD, Borbone N , Zollo F,Ianaro A , Meglio PD, Iorizzi M . Megastigmane and Phenolic Components from Laurus nobilis L. Leaves and Their Inhibitory Effects on Nitric Oxide Production. J. Agric. Food Chem. 2004; 52 (25): 7525–7531. Emam AM, Mohamed MA, Diab YM, Megally NY. Isolation and structure elucidation of antioxidant compounds from leaves of Laurus nobilis and Emex spinosus. Drug Discoveries and Therapeutics. 2010; 4(3):202-207. Elisabetta Panza, Mariaroberta Tersigni, Maria Iorizzi, Franco Zollo, Simona De Marino, Carmen Festa, Maria Napolitano, Giuseppe Castello, Armando Ialenti, and Angela Ianaro. Lauroside B, a Megastigmane Glycoside from Laurus Nobilis(Bay Laurel) Leaves, Induces Apoptosis in Human MelanomaCell Lines by Inhibiting NF-κB Activation J. Nat. Prod. 2011, 74, 228–233. Lee S., Chung S.C., Lee S.H., Park W., Oh I., Mar W., Shin J., Oh K.B. Acylated kaempferol glycosides from Laurus nobilis leaves and their inhibitory effects on Na+/K+-adenosine triphosphatase. Biol Pharm Bull. 2012;35(3):428-32. Derwich E., Benziane Z., Boukir A. Сhemical composition and antibacterial activity ofleaves essential oil of laurus nobilis from morocco // Australian Journal of Basic and Applied Sciences. 2009. Vol. 3. Is. 4. P. 3818–3824. Mitic-Culafic D., Zegura B., Nikolic B., Vukovic-Gacic B., Knezevic-Vukcevic J., Filipic M. Protectiveeffect of linalool, myrcene and eucalyptol against t-butyl hydroperoxide induced genotoxicity in bacteria and cultured human cells // Food and Chemical Toxicology. 2009. Vol. 47. P. 260–266. Bagamboula C.E., Uyttendaele M., Debevere J. inhibitory effect of thyme and basil essential oils, carvacrol, thymol, estragol, linalool and p-cymene towards shigella sonnei and s. flexneri // Food Microbiology. 2004. Vol. 21. P. 33–42. Koba K., Poutouli P.W., Raynaud C., Chaumont J.-P., Sanda K. chemical composition and antimicrobial properties of different basil essential oils chemotypes from Togo // Bangladesh Journal of Pharmacology. 2009. Vol. 4. Is. 1. P. 1–8. De Corato U., Maccioni O., Trupo M., Di Sanzo G. use of essential oil of laurus nobilis obtained by means of a supercritical carbon dioxide technique against post harvest spoilage fungi // Crop Protection. 2010. Vol. 29. Is. 2. P. 142–147. Millezi A.F., Caixeta D.S., Rossoni D.F., Cardoso M.G., Piccoli R. In vitro antimicrobial properties of plant essential oils thymus vulgaris, cymbopogon citratus and laurus nobilis against five important foodborne pathogenS // Ciencia e Tecnologia de Alimentos. 2012. Vol. 32. P. 167–172. Guynot M.E., Ramos A.J., Seto L., Purroy P., Sanchis V., Marín S. Antifungal activity of volatile compounds generated by essential oils against fungi commonly causing deterioration of bakery products // Journal of Applied Microbiology. 2003. Vol. 94. Is. 5. P. 893-899. Patrakar R., Mansuriya M., Patil P. Phytochemical and pharmacological review on laurus nobilis // International journal of pharmaceutical and chemical sciences. 2012. Vol. 1 (2). P. 595–602. Н.М. Насухова, О.М. Шевчук, Л.А. Логвиненко. Исследование фенольных соединений в извлечениях из листьев лавра благородного. Фармация и фармакология Т. 5 № 2, 2017 Стр. 150 — 163. Muniz DB, Martinez GC, Wong JE, Belmares R, Rodriguez R, Aguilar CN. Ultrasound-assisted extraction of phenolic compounds from Laurus nobilis L. and their antioxidant activity. Ultrason Sonochem 2013;20:1149–54. M. Muchuweti, E. Kativu, C.H. Mupure, C. Chidewe, A.R. Ndhlala, M.A.N. Benhura, Phenolic composition and antioxidant properties of some spices, Am. J. Food Technol. 5 (2007) 414–420. M. Lu, B. Yuan, M. Zeng, J. Chen, Antioxidant capacity and major phenolic compounds of spices commonly consumed in China, Food Res. Int. 44 (2011) 530–536 Papageorgiou V., Mallouchos A., Komaitis M. investigation of the antioxidant behaviour of air- and freeze-driedaromatic plant materials in relation to their phenolic content and vegetative cycle. Journal of Agricultural and Food Chemistry. 2008. Vol. 56. P. 5743–5752. Насухова Н.М., Логвиненко Л.А., Харченко А.Л., Коновалов Д.А. Биологически активные вещества листьев лавра благородного. Фармация и фармакология. 2017;5(3):200-221. Dias M. I., Barreira J., Calhelha R.C., Queiroz Maria-João R. P., Oliveira, Marina Soković M. Beatriz P. P., Ferreira Isabel C. F. R. TWO-DIMENSIONAL PCA HIGHLIGHTS THE DIFFERENTIATED ANTITUMOR AND AN-TIMICROBIAL ACTIVITY OF METHANOLIC AND AQUEOUS EXTRACTS OF LAURUS NOBILIS L. FROM DIFFERENT ORIGINS // BioMed research international. 2014. Vol. 2014. Kang Yu K.W., Jun W.J., Chang I.S., Han S.B., Kim H.Y., Cho H.Y. ISOLATION AND CHARACTERIZATIONOF ALKYL PEROXY RADICAL SCAVENGING COMPOUND FROM LEAVES OF LAURUS NOBILIS // Biol. Pharm. Bull. 2002. Vol. 25. Is.1. P. 102–108 De Marino S., Borbone N., Zollo F., Ianaro A., Di Meglio P., Iorizzi M. MEGASTIGMANE AND PHENOLIC COMPONENTS FROM LAURUS NOBILIS L. LEAVES AND THEIR INHIBITORY EFFECTS ON NITRIC OXIDE PRODUCTION // J. Agric. Food Chem. 2004. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||