|
|
Методичка для лабораторных работ по химии. Уфимский государственный нефтяной технический университет
Опыт 4. Электролиз водного раствора иодида калия
В U-образную трубку налить раствор иодида калия. В оба колена добавить 4-5 капель фенолфталеина, опустить графитовые электроды, присоединить последние к блоку питания. Пропустить ток от источника постоянного тока.
Отметить внешние изменения в растворе около электродов;
объяснить, выделение газа и появление малиновой окраски около одного электрода и желто-бурой окраски – около другого электрода;
составить уравнение электрохимической диссоциации иодида калия в водном растворе
KI →…;
ответить, какая среда – кислая, нейтральная или щелочная – в растворе KI;
составить уравнение электролитической диссоциации воды;
ответить, какие ионы перемещаются к отрицательно заряженному электроду, и какие – к положительно заряженному электроду;
используя значения окислительно-восстановительных потенциалов, выбрать наиболее сильный окислитель и наиболее сильный восстановитель;
составить уравнение катодного процесса восстановления окислителя, характеризующегося наибольшим окислительно-восстановительным потенциалом:
K+; H+2O
 < < 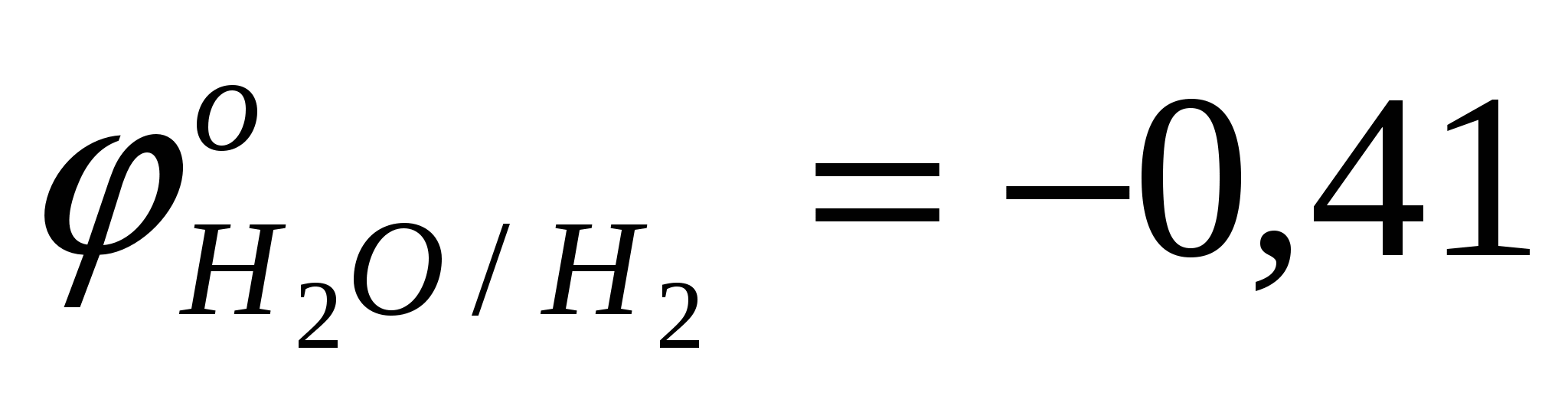 ; (pH=7) ; (pH=7)
катод: H2O+…→ H2+…
составить уравнение анодного процесса окисления восстановителя, характеризующегося наименьшим окислительно-восстановительным потенциалом
I-; H-2OH
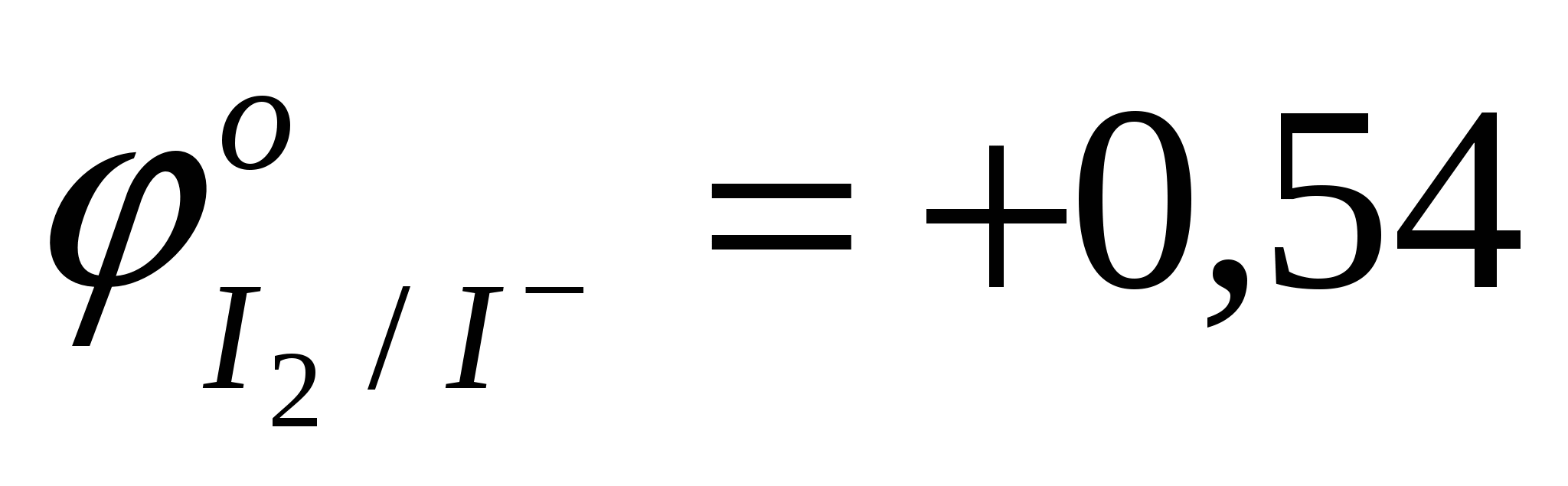 < <  ; (pH=7) ; (pH=7)
анод: I-→…;
составить суммарное уравнение электролиза водного раствора, объединив уравнения катодной и анодной реакции с учетом коэффициентов электронного баланса
H2O+I- H2+I2+…(ионное уравнение);
H2O+KI H2+I2+…(молекулярное уравнение);
рассчитать потенциал разложения необходимый для протекания электролиза иодида калия;
ответить, какие металлы не выделяются на катоде при электролизе водных растворов их солей.
Опыт 5. Электролиз водного раствора сульфата меди (II) с инертными электродами
В U-образную трубку налить раствор сульфата меди, опустить в него графитовые электроды и пропустить электрический ток от источника постоянного тока.
отметить, какие изменения происходят на электродах;
составить уравнения электролитической диссоциации CuSO4 и H2O;
CuSO4
H2O ↔
ответить, какая среда в растворе CuSO4;
ответить, какие ионы в растворе перемещаются к отрицательно заряженному и какие – к положительно заряженному электроду;
выбрать окислитель, характеризующийся наибольшим значением окислительно-восстановительного потенциала
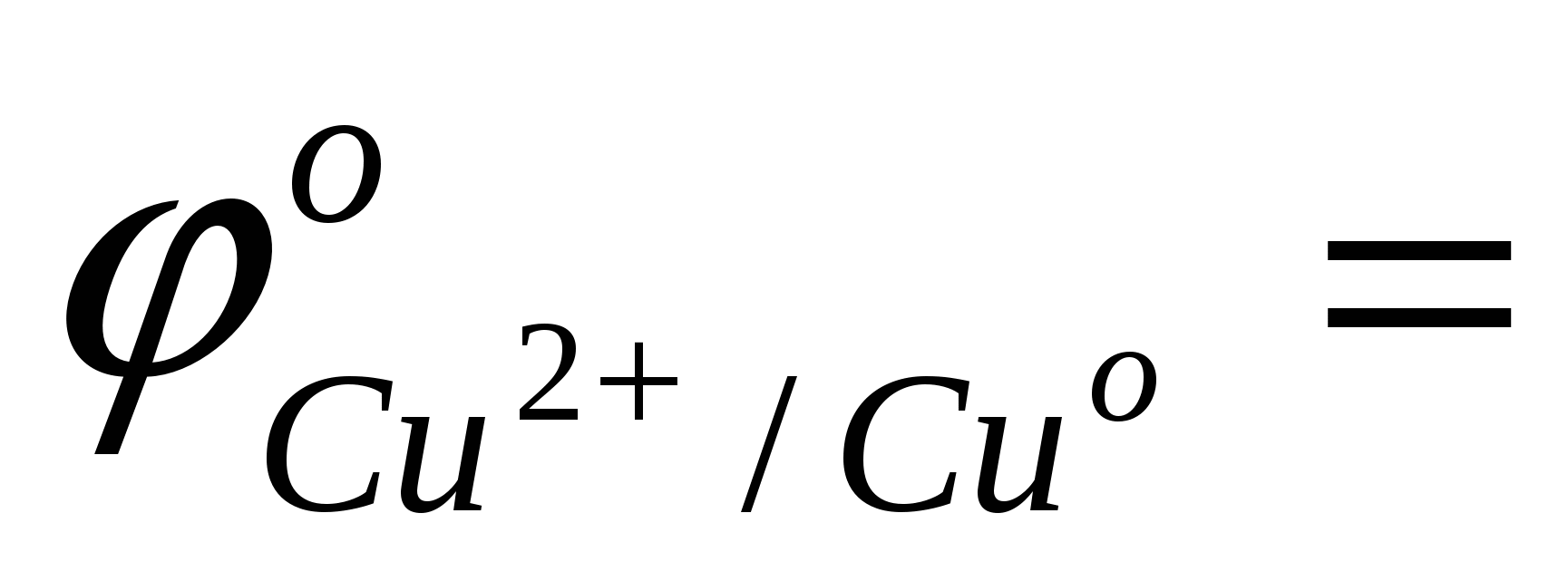 …; …; 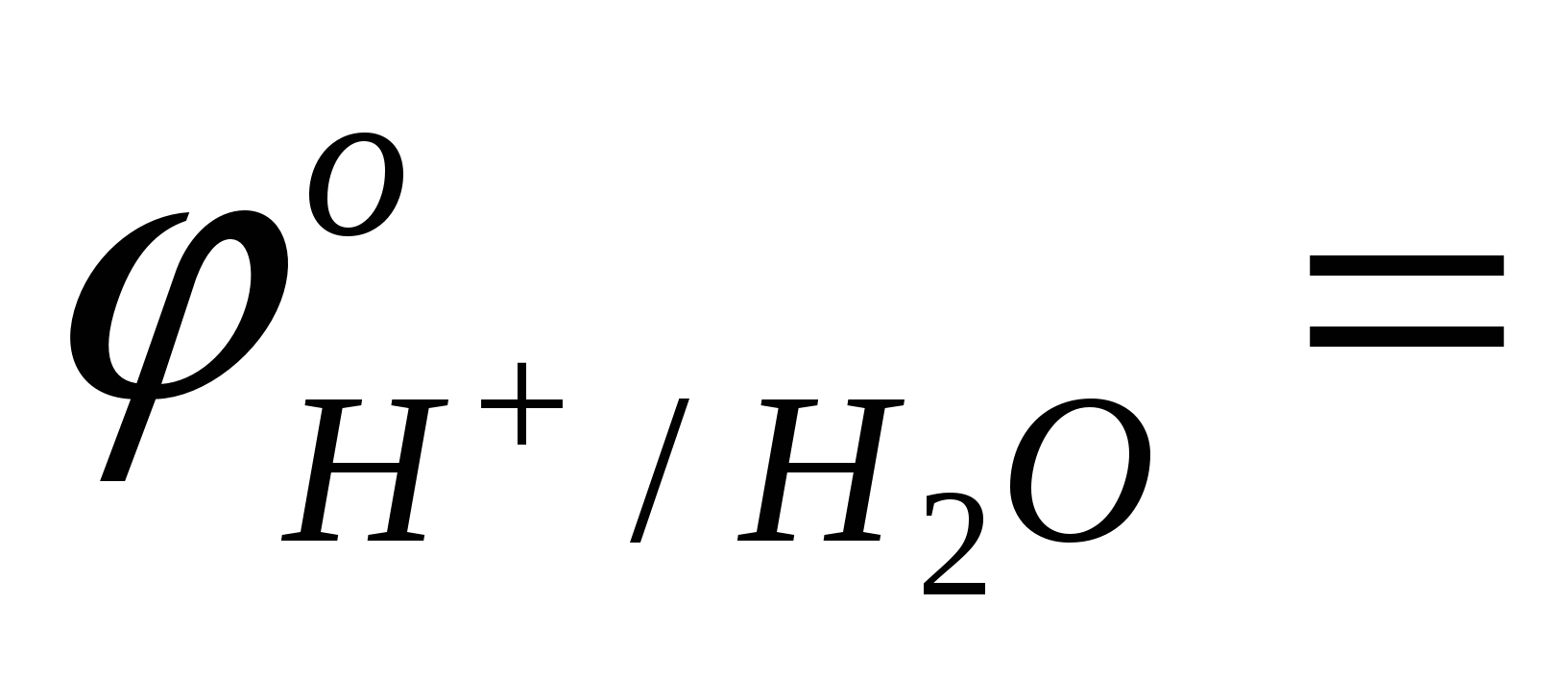 …; …;
составить уравнение катодной реакции
Cu2++…→ (процесс восстановления);
выбрать восстановитель, характеризующийся наименьшим значением окислительно-восстановительного потенциала
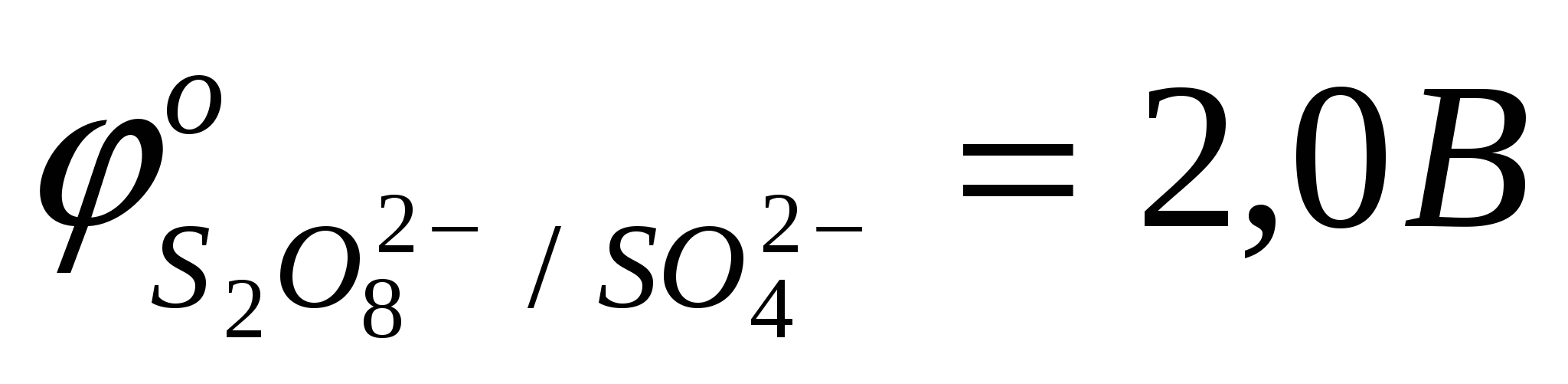 ; ;  ; ;
H2O-…→O2+… (процесс окисления);
составить суммарное уравнение электролиза раствора сульфата меди (), объединив уравнения катодной и анодной реакций, с учетом коэффициентов электронного баланса
Cu2++H2O→O2+…+…;
рассчитать минимальный потенциал разложения, необходимый для проведения электролизаводного раствора сульфата меди (II);
ответить, какие металлы можно восстановить на катоде, при электролизе водных растворов их солей;
каковы области практического использования электролиза расплавов и водных растворов солей с инертными электродами.
Опыт 6. Электролиз водного раствора сульфата меди (II) с медным анодом
Поменять местами электроды (оп. 5), вследствие чего анод окажется омеднённым. Снова пропустить электрический ток.
Отметить, какие изменения происходят на электродах;
составить уравнения электролитической диссоциации CuSO4 и H2O
CuSO4 …;
H2O ↔…;
ответить, какая среда в растворе CuSO4;
выбрать окислитель, характеризующийся наибольшим значением окислительно-восстановительного потенциала
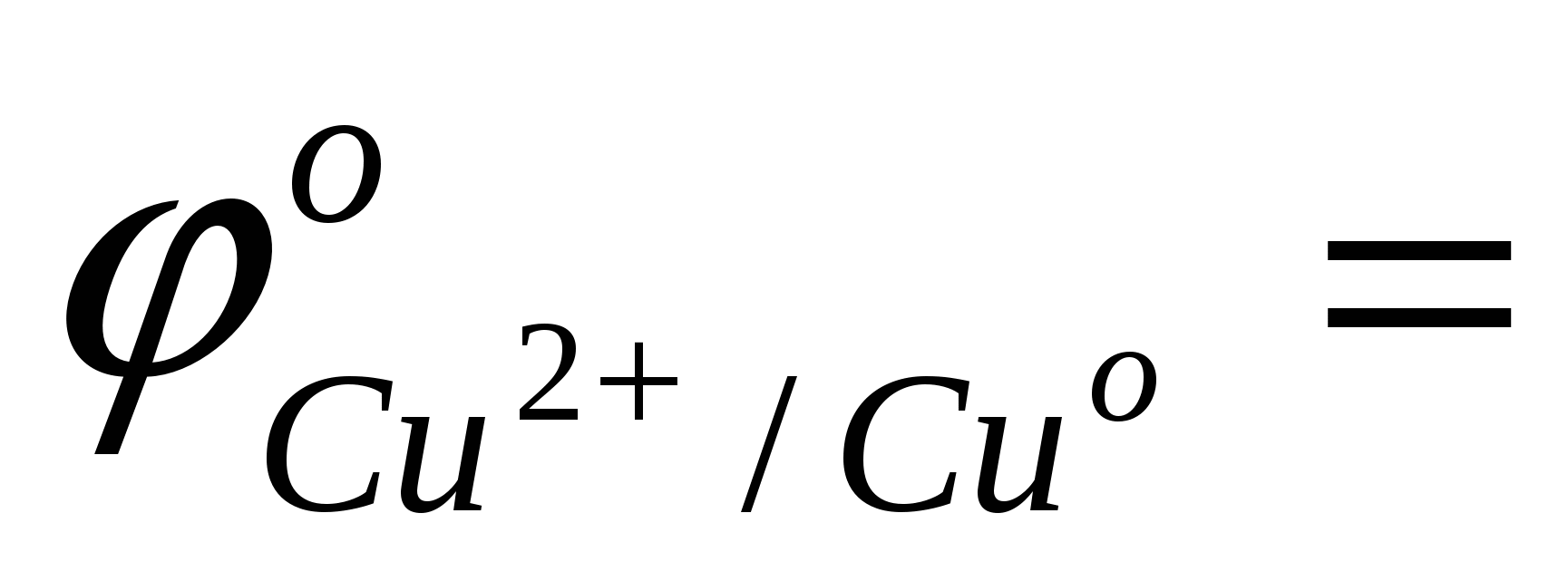 …; …; 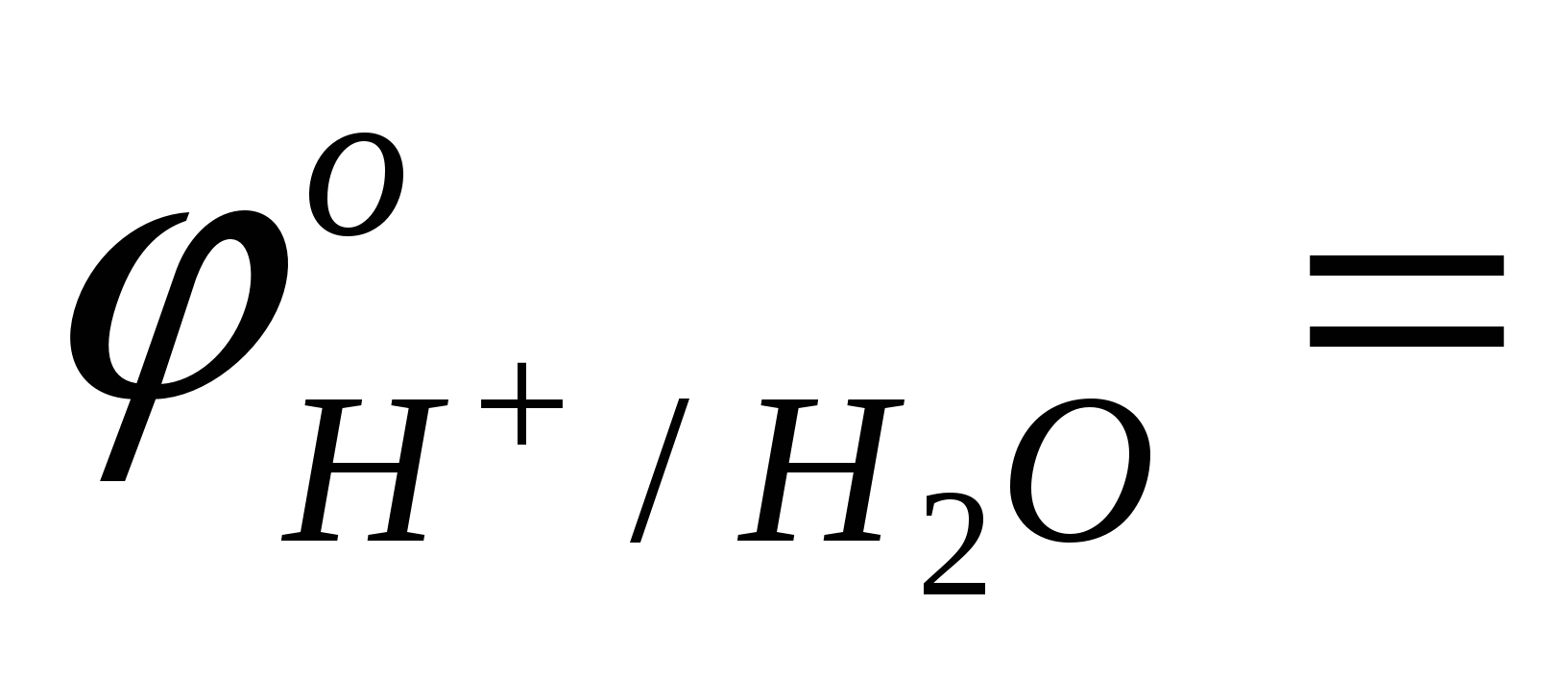 …; …;
составить уравнение катодной реакции
Cu2++…→ (процесс восстановления);
выбрать восстановитель, характеризующейся наименьшим значением окислительно-восстановительного потенциала
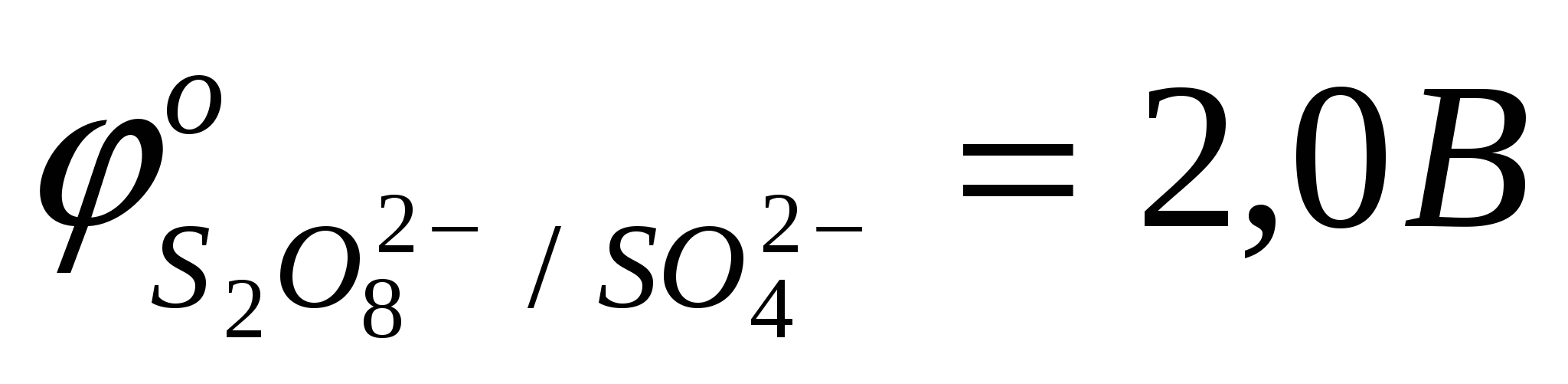 ; ;  ; ; 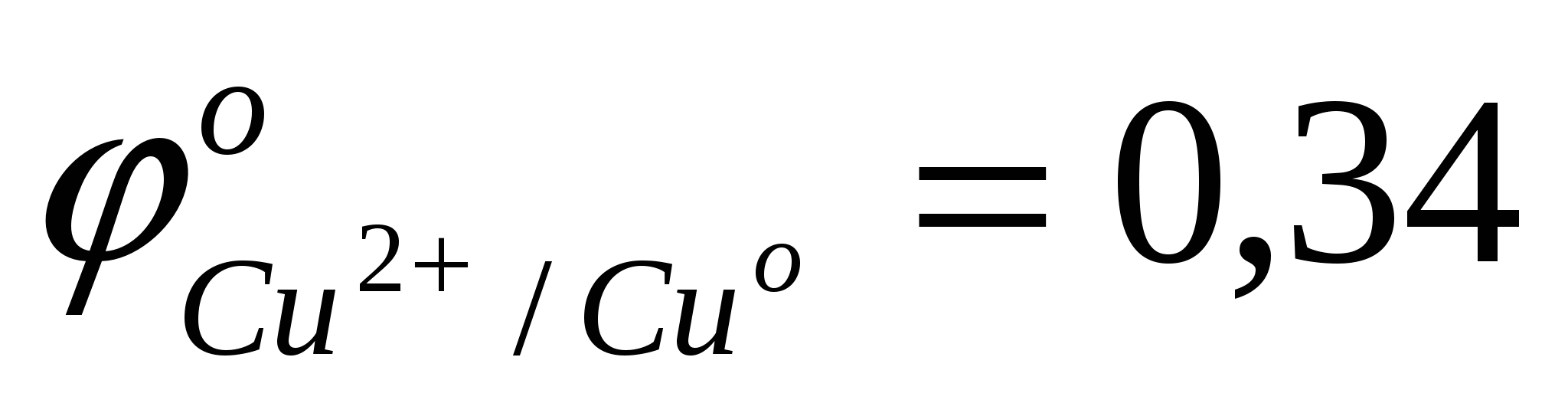 ; ;
составить уравнение анодной реакции
Cuo - … (процесс окисления);
Cu2+(кат.)+Cuo(ан.)→…;
ответить, каковы области практического использования электролиза водных растворов солей с активным анодом.
|
|
|
 Скачать 306 Kb.
Скачать 306 Kb.