|
|
Методичка для лабораторных работ по химии. Уфимский государственный нефтяной технический университет
В пять пробирок внести по грануле металлического цинка и прилить по 1 мл раствора соли: в первую пробирку – хлорида магния; во вторую – сульфата железа (II); в третью – хлорида олова (II); в четвертую – нитрата свинца (II); в пятую – сульфата меди (II). Наблюдать за изменениями в пробирках в течение 5-10 минут. Используя универсальный индикатор измерить рН в растворах солей.
- Отметить, как протекают реакции в каждой из пробирок, что выделяется;
- ответить, реакция металлов с водными растворами – гомогенная или гетерогенная;
- ответить, с раствором какой соли цинк не взаимодействует;
- составить уравнения основных реакций
Zn+FeSO4
Zn+SnCl2
Zn+Pb(NO3)2
Zn+CuSO4
- указать восстановитель и окислитель.
- используя значения стандартных окислительно-восстановительных потенциалов, рассчитать ЭДС проведенных реакций: ЭДС=φок. – φвос.
- расположить растворы солей в порядке увеличения ЭДС и активности их взаимодействия с цинком;
- используя ряд стандартных окислительно-восстановительных потенциалов, сформулировать, какие металлы могут быть «вытеснены» из растворов их солей цинком;
- по измеренной величине рН, ответить, какая среда в каждом из растворов солей;
- ответить, какой газ выделяется;
- составить уравнения побочных реакций
Me2++H2OMeOH++H+ (уравнение гидролиза)
Zn+H+
Опыт 3. Взаимодействие металлов - Ca и Mg - с водой
В две пробирки налить по 2-3 мл дистиллированной воды и 2 капли раствора фенолфталеина. В одну пробирку поместить немного металлического магния, в другую – кальция. Наблюдать за изменениями в пробирках в течение 3-5 минут. Пробирку с магнием нагреть на спиртовке до кипения.
- отметить, как протекает реакция с Mg ; с Mg при комнатной температуре; с Mg при нагревании;
- сравнить активность металлов Ca и Mg ;
- составить уравнения реакций
Ca+H2O
Mg+H2O
- указать восстановители и окислитель; какой газ выделяется;
- рассчитать потенциал «водородного электрода» 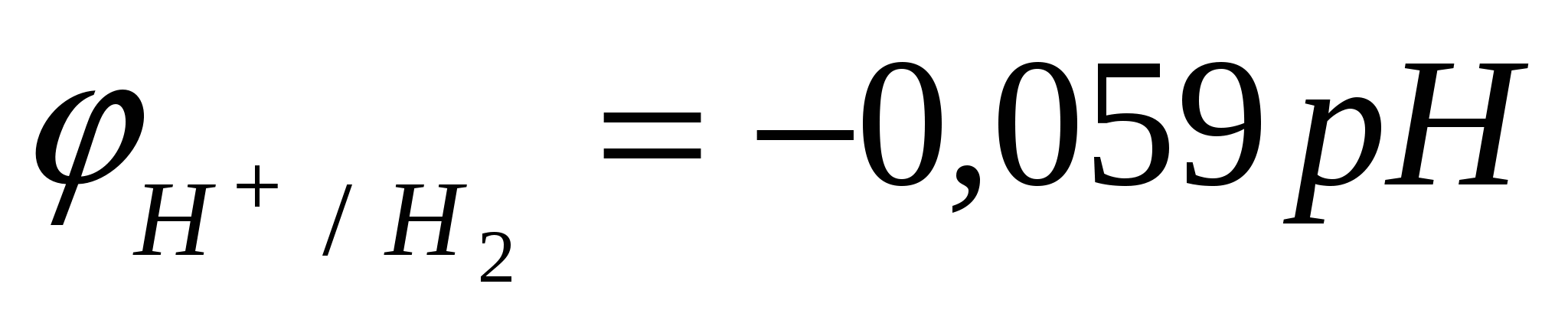 при рН=7; при рН=7;
- рассчитать ЭДС реакций
ЭДС=φок. – φвос.
- ответить, почему при комнатной температуре магний практически не взаимодействует с водой;
- что «пассивирует» Mg и почему при нагревании реакция осуществляется;
- отметить, в какой пробирке окраска фенолфталеина более интенсивная;
- используя таблицу по окраске фенолфталеина, указать какая среда в растворах полученных продуктов;
- ответить, какие металлы активно взаимодействуют с водой.
Опыт 4. Взаимодействие металлов – Al, Sn и Zn с водным раствором щелочи
Налить в три пробирки по 1-2 мл концентрированного раствора щелочи - гилроксида натрия - и поместить в каждую из пробирок один из металлов (в первую – алюминиевую стружку, во вторую – гранулу цинка, в третью – гранулу олова). Пробирки осторожно нагреть на спиртовке.
- Отметить, как протекает реакция металлических Al, Zn, и Sn с водным раствором щелочи;
- растворы, каких веществ называют щелочами, привести примеры;
- сравнить активность металлических Al, Zn и Sn по отношению к водному раствору щелочи;
- ответить, чем покрыт каждый из металлов;
- составить уравнения реакции растворения оксидных пленок металлов в растворе гидроксида натрия, учитывая, что образуются гидроксокомплексы
Al2O3+NaOH+H2O
ZnO+NaOH+H2O
SnO2+NaOH+H2O
- составить уравнения реакций металла с раствором гидроксида натрия, учитывая, что образуются соответствующие гидроксокомплексы, с координационным числом равным четырем
Al+NaOH+H2O
Zn+NaOH+H2O
Sn+NaOH+H2O
- указать восстановители и окислитель;
- ответить, какой газ выделяется;
- выписать (таблица) значения стандартных окислительно-восстановительных потенциалов электрохимических систем: Me+4OH--ne[Me(OH)4]n-4
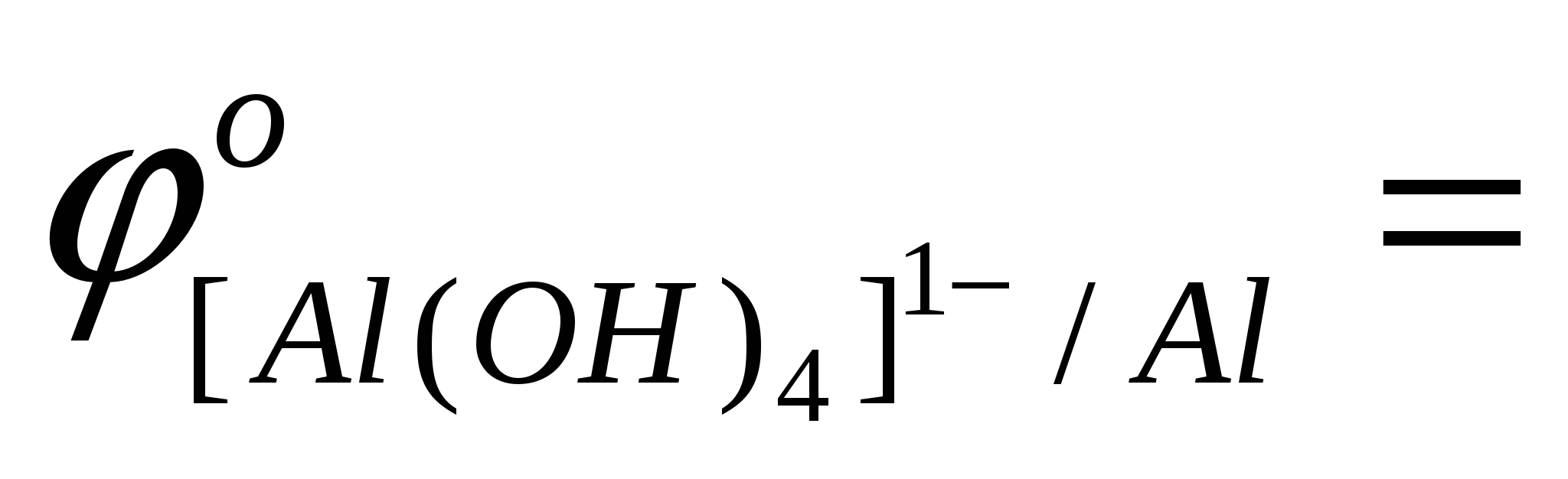 …; …; 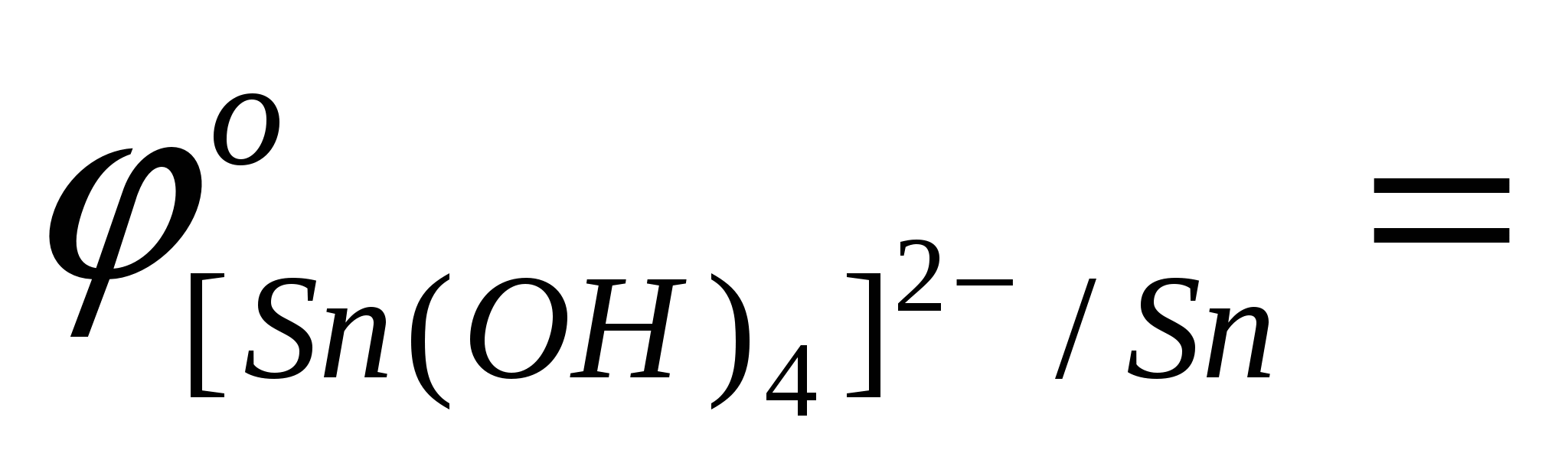 …; …;
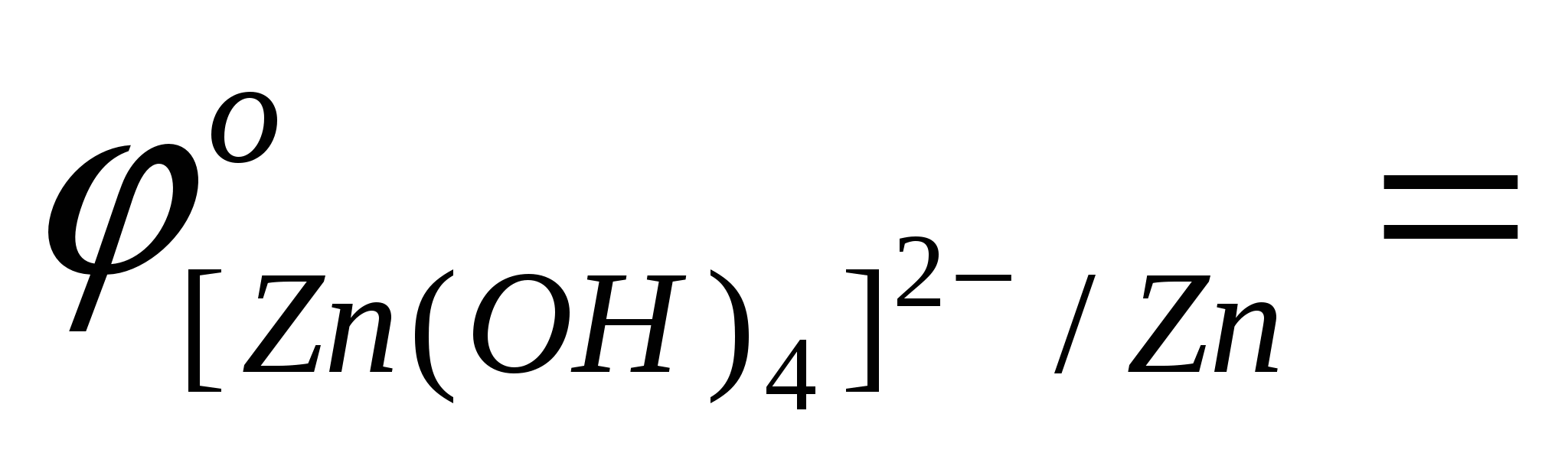 … . … .
- сравнить их значения с соответствующими потенциалами для процессов окисления в кислой среде
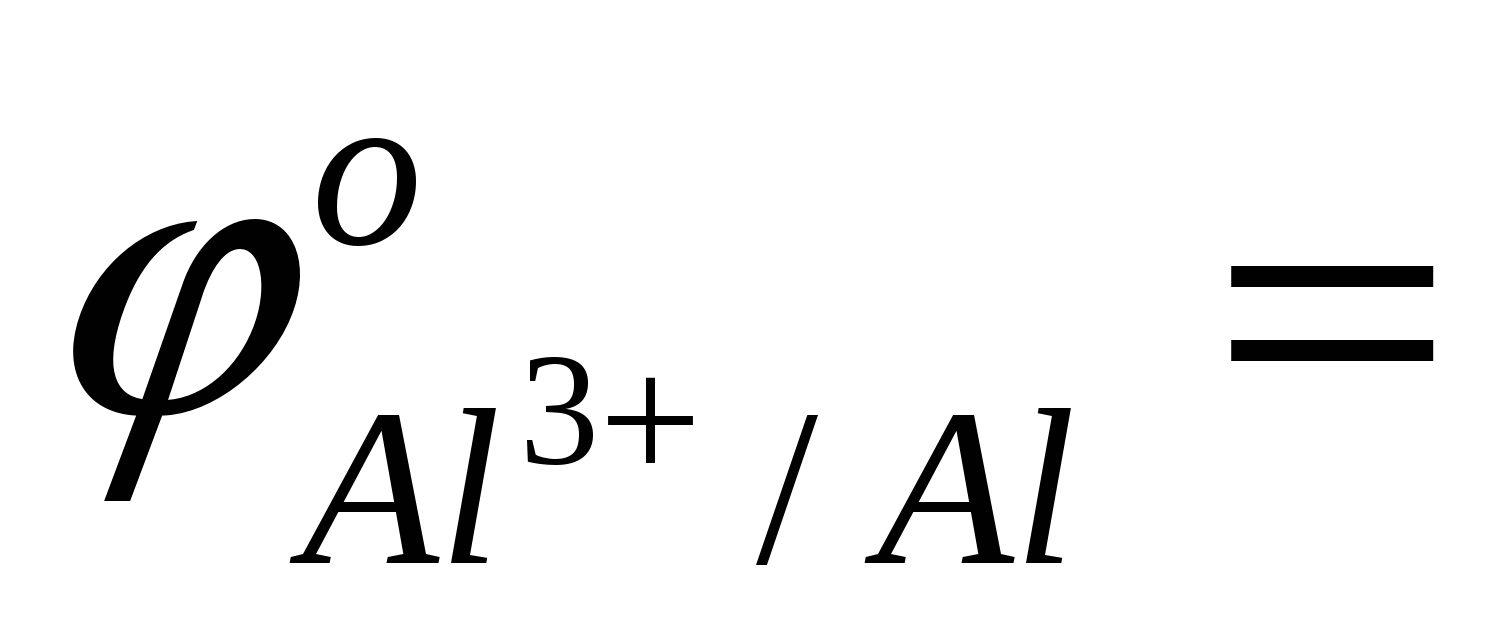 …; …; 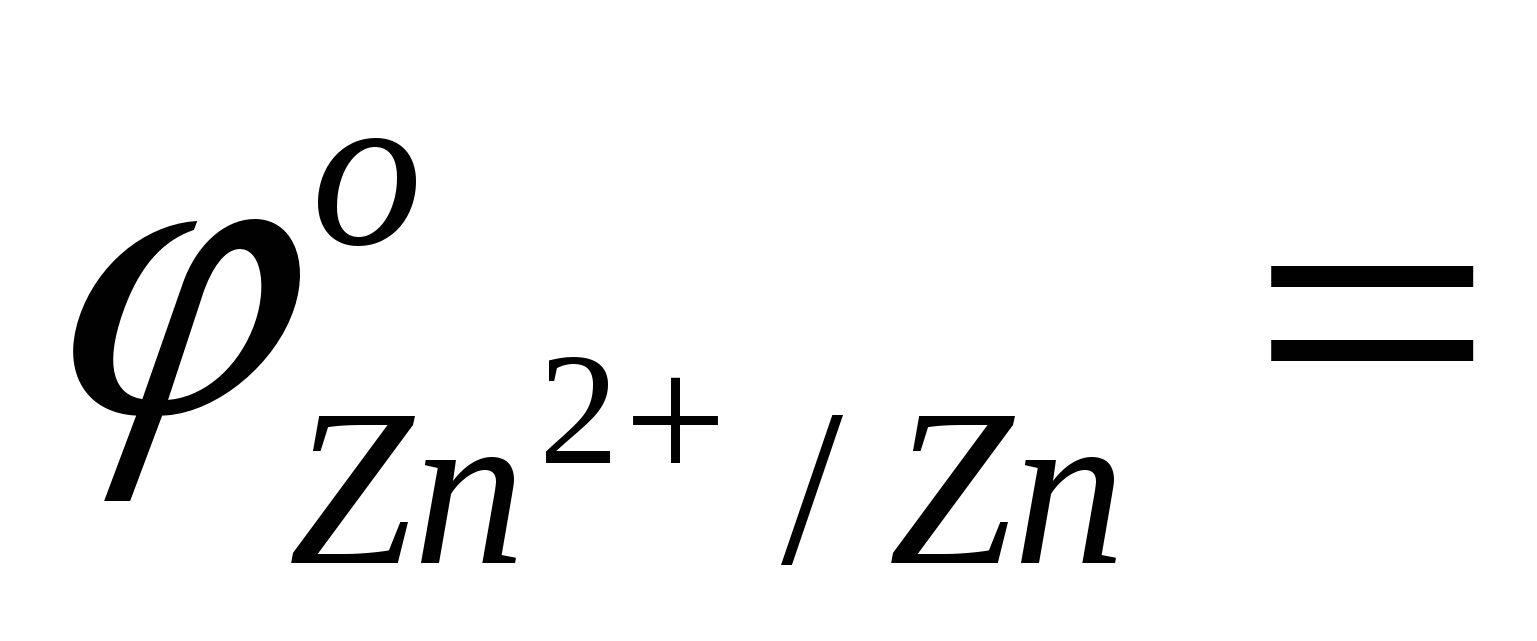 …; …; 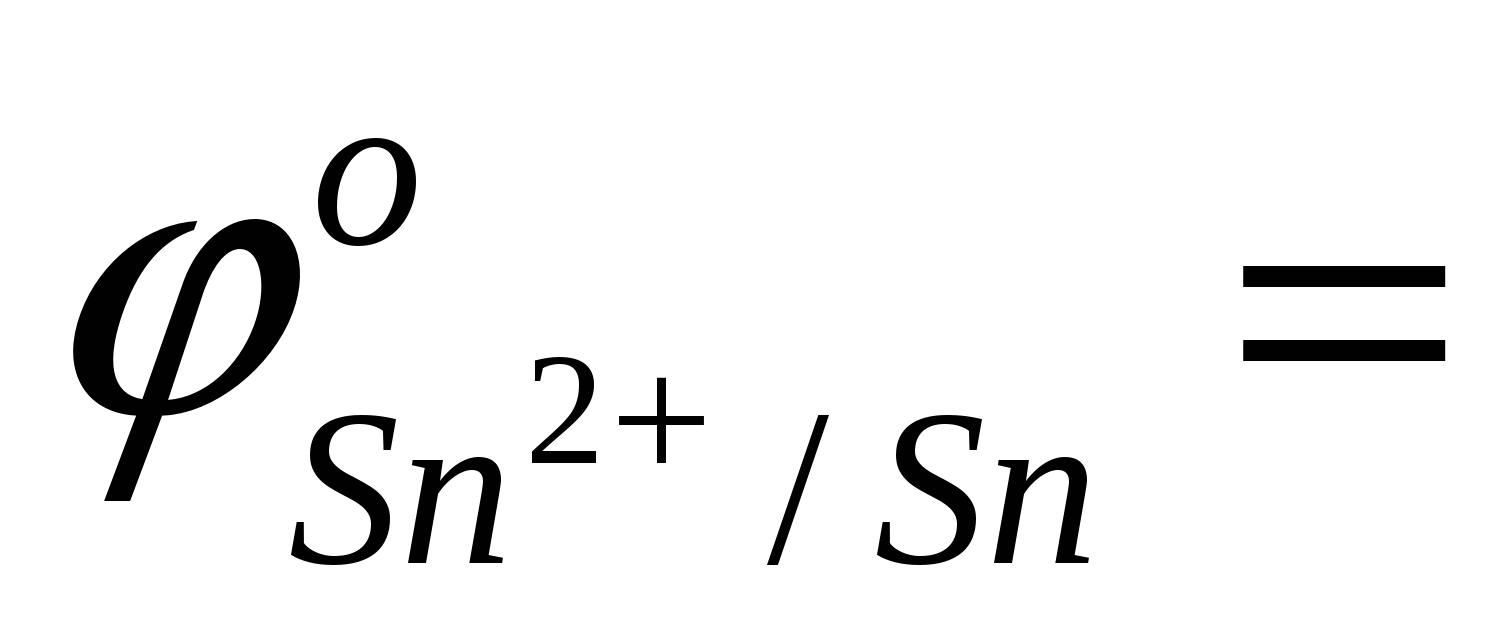 … . … .
- ответить в какой среде восстановительные свойства металлических Al, Zn и Sn более выражены;
- рассчитать потенциал «водородного электрода» 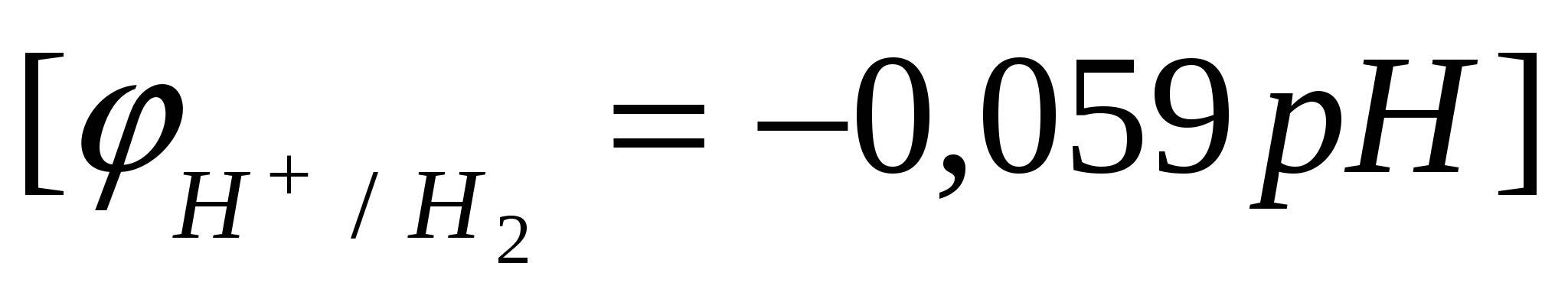 при рН=14. при рН=14.
- рассчитать ЭДС реакции ЭДС=φок. – φвос.
Опыт 5. Взаимодействие металлов - Mg и Fe - с концентрированной серной кислотой
а). В пробирку поместить 1-2 стружки магния и прилить 1 мл конц. серной кислоты. Подержать над отверстием пробирки фильтровальную бумагу, смоченную раствором соли свинца (II). Наблюдать за изменениями в пробирке в течение 2-3 минут, пробирку осторожно нагреть на спиртовке;
- отметить, какие изменения происходят в пробирке; на фильтровальной бумаге;
- ответить, какой элемент является окислителем в концентрированной серной кислоте;
- до каких продуктов может восстанавливаться концентрированная серная кислота
- ответить, что образуется при окислении металлического магния;
- составить уравнение первой реакции, учитывая, что первоначально выделяющийся газ – SO2
Mg+H2SO4(конц.)SO2+…+…
- составить уравнение второй реакции, учитывая, что образующийся белый осадок - S
Mg+H2SO4(конц.)S+…+…
- составить уравнение третьей реакции, учитывая, что выделяющийся газ с характерным запахом – H2S
Mg+H2SO4(конц.)H2S+…+…
- составить уравнение реакции, протекающей на фильтровальной бумаге и доказывающей образование сероводорода
H2S+Pb(NO3)2
- ответить, реакция магния с концентрированной серной кислотой является селективной или нет.
б). В пробирку поместить 1-2 стружки железа и прилить 1 мл концентрированной серной кислоты. Наблюдать за изменениями в пробирке в течение 2-3 минут; пробирку нагреть на спиртовке. После охлаждения 2-3 капли полученного раствора прикапать в пробирку с 1 мл дистиллированной воды и добавить 2 капли тиоцианата калия (KSCN):
ответить, какие изменения происходят в пробирке при комнатной температуре; при нагревании;
ответить, в каких условиях железо «пассивируется» концентрированной серной кислотой;
отметить, какие изменения происходят в пробирке с тиоцианатом калия (KSCN);
составить уравнение реакции, объясняющей появление кроваво-красного окрашивания в результате образования гексатиоцианатоферрата (III) калия
Fe2(SO4)3+KSCN
составить уравнение реакции железа с концентрированной серной кислотой при нагревании, учитывая, что образуется сульфат железа (III), вода и оксид серы (IV)
to
Fe+H2SO4(конц.)
Опыт 6. Взаимодействие металлов – Mg, Fe, Cu – с разбавленной азотной кислотой (показательный)
В три пробирки налить по 2-3 мл разбавленной азотной кислоты. Осторожно опустить в первую пробирку пластинку меди, во вторую – железа, в третью – магния. Если реакция идет слабо, слегка нагреть пробирки, после охлаждения в пробирку с Fe добавить 1 каплю тиоцианата калия (KSCN):
отметить, какие изменения происходят в каждой из пробирок, с каким металлом реакция идет наиболее энергично;
составить уравнения возможных реакций Mg с разбавленной азотной кислотой, учитывая, что образуется нитрат магния, вода и продукт восстановления азота (V):
Mg+HNO3(разб.)→NO+…+…
Mg+HNO3(разб.)→NH4NO3+…+…;
составить уравнения реакции Fe с разбавленной азотной кислотой, учитывая, что образуются нитрат железа (III), вода и оксид азота (II)
Fe+HNO3(разб.)→…;
ответить, действием какого реактива можно доказать образование соли железа (III);
составить уравнение реакции меди с разбавленной азотной кислотой, учитывая, что образуются нитрат меди (II), вода и оксид азота (II).
Cu+HNO3(разб.)→NO+…+…
Опыт 7. Взаимодействие металлов – Al, Fe, Cu – с концентрированной азотной кислотой
В три пробирки налить по
1 мл концентрированной азотной кислоты. Осторожно опустить в первую пробирку пластинку меди, во вторую – железа, в третью – алюминия. Наблюдать за изменениями в пробирках в течение
2 минут. Пробирки с железом и алюминием нагреть.
Отметить, какие изменения происходят в каждой из пробирок при комнатной температуре; при нагревании;
ответить, с каким металлом при комнатной температуре реакция идет наиболее энергично, какие металлы "пассивируются" кислотой;
составить уравнение реакции меди с концентрированной азотной кислотой, протекающей при комнатной температуре с образованием нитрата меди (II), оксида азота (IV) и воды
Cu+HNO3→NO2↑+…+…
(конц.) бурый
составить уравнение реакции железа с концентрированной азотной кислотой, протекающей при нагревании с образованием соли – нитрата железа (III), оксида азота (IV) и воды
Fe+HNO3(конц.)→NO2↑+…+…
составить уравнение реакции алюминия с концентрированной азотной кислотой, протекающей при нагревании с образованием соли – нитрата алюминия, оксида азота (IV) и воды
Al+HNO3(конц.)→NO2↑+…+…
3.2 Лабораторная работа № 6. Электрохимические процессы
Опыт 1. Гальванический элемент Даниэля-Якоби
Собрать гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов - цинкового и медного и вольтметра, встроенного во внешнюю цепь. Опустить цинковую пластинку в 1 М раствор соли – сульфата цинка, медную пластинку в 1 М раствор соли – сульфата меди (II). Отметить показания вольтметра. Соединить растворы электролитов – сульфата цинка и сульфата меди (II) - "солевым мостиком" ("электролитическим ключом"). Записать показания вольтметра.
Выписать из таблицы значения стандартных окислительно-восстановительных потенциалов (ОВП) цинкового и медного электрода
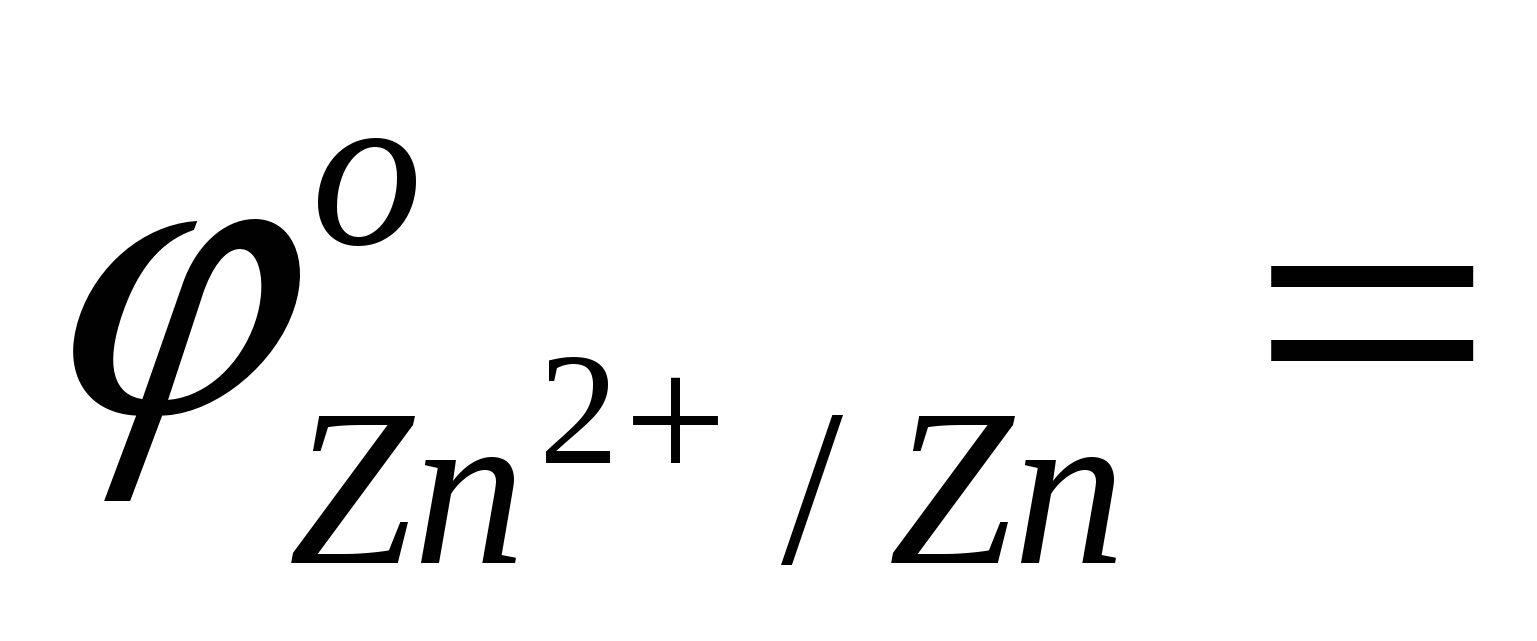 …; …; 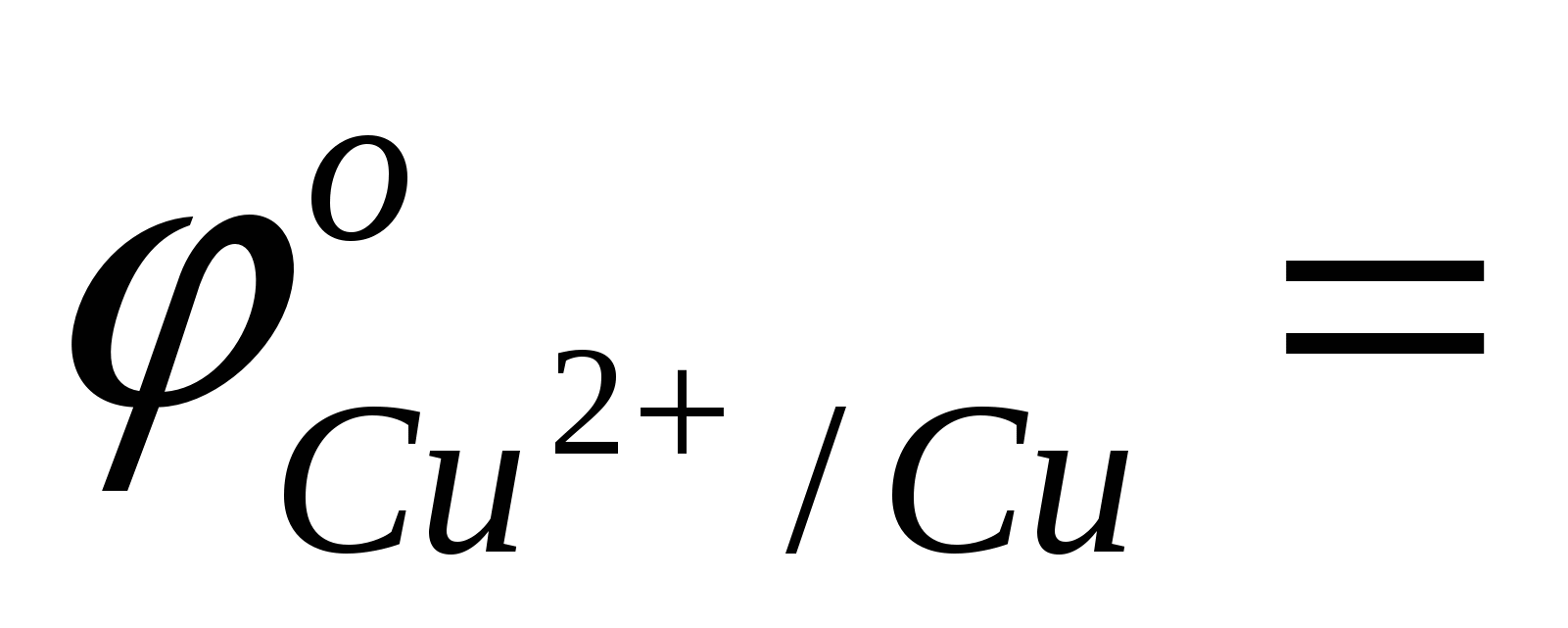 …; …;
определить какой электрод – цинковый или медный – характеризуется отрицательным значением ОВП, какой электрод – положительным значением ОВП;
ответить, какой электрод при замыкании цепи является "источником" электронов; как перемещаются электроны во внешней цепи;
составить уравнение электродной реакции, протекающей на более отрицательнозаряженном цинковом электроде;
Zn-2e…;
ответить, какой процесс – окисления или восстановления – протекает на Zn – электроде;
ответить, электрод, на котором протекает процесс окисления, называют анодом или катодом;
составить уравнение электродной реакции, протекающей на более положительнозаряженном медном электроде
Cu2++2e…;
ответить, какой процесс – восстановления или окисления – протекает на Cu – электроде;
ответить, электрод, на котором протекает процесс восстановления называют катодом или анодом;
объяснить возникновение разности потенциалов между растворами электролитов (солей);
объяснить, концентрация каких ионов – катионов или анионов – становится больше в растворе сульфата цинка; в растворе сульфата меди (II);
ответить, в каком направлении перемещаются катионы и анионы по внутренней цепи;
составить суммарное уравнение реакции, протекающей в гальваническом элементе в ионной и молекулярной форме
Zn+Cu2+…;
Zn+CuSO4…;
составить краткую схему записи гальванического элемента Даниэля-Якоби;
рассчитать ЭДС гальванического элемента Даниэля-Якоби в стандартных условиях
ЭДС=φкат. – φан.;
сравнить рассчитанное значение ЭДС с показанием вольтметра;
назвать причины по которым возможно уменьшение разности потенциалов между электродами по сравнению с рассчитанным значением ЭДС;
объяснить, как изменяется ЭДС по мере работы гальванического элемента.
Опыт 2. Электрохимическая коррозия цинка в контактной паре с медью.
В пробирку внести одну гранулу цинка, прилить
3 мл дистиллированной воды и 5 капель 2н серной кислоты, наблюдать в течение 2-3 минут. Коснуться медной проволокой гранулы цинка в пробирке.
отметить, как изменится интенсивность выделения газа после касания гранулы цинка медной проволокой;
на каком из металлов выделяется газ;
сравнить значения стандартных окислительно-восстановительных потенциалов
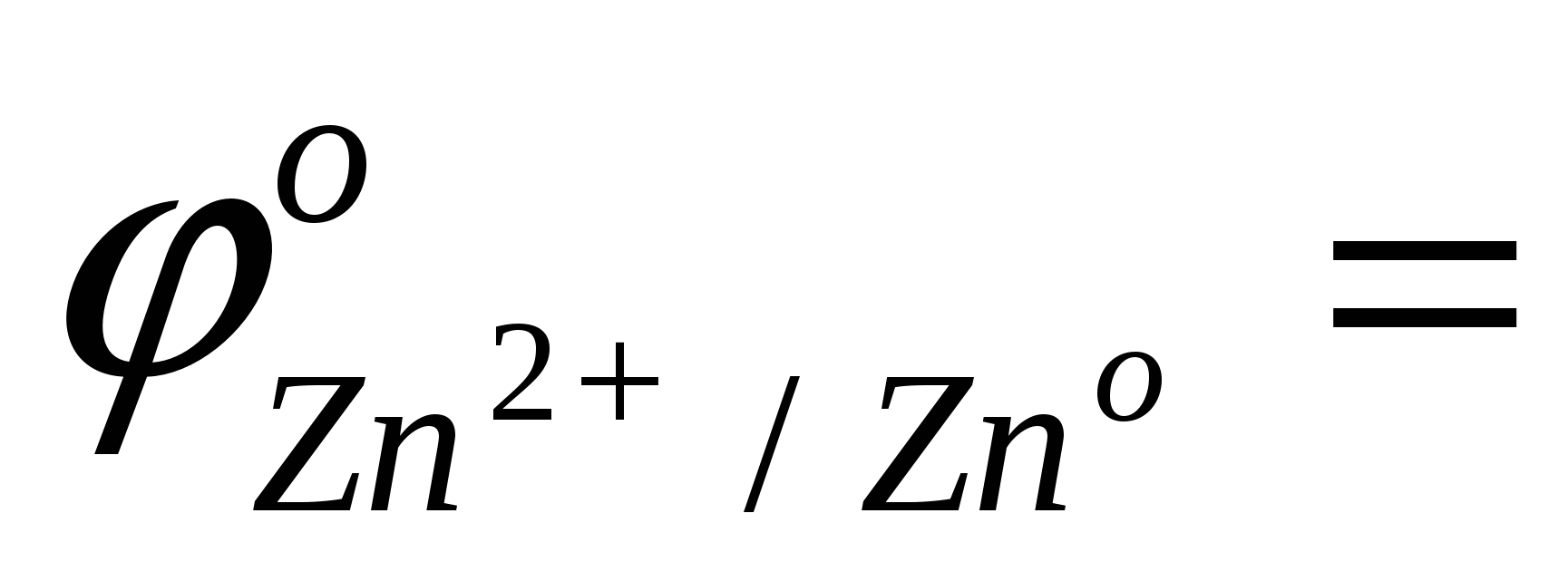 ; ; 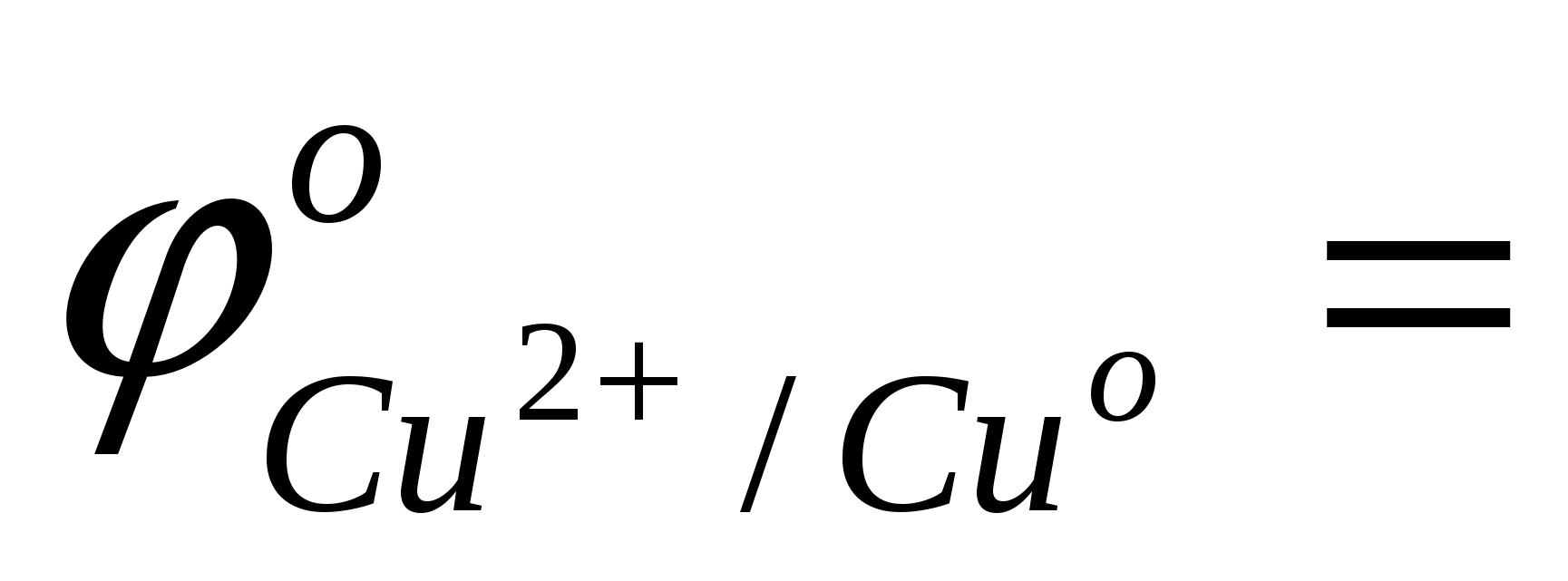 ; ;
1. Zno – 2e→
ответить, образующиеся ионы цинка остаются на металле или переходят в среду электролита;
ответить, может ли «принимать электроны» металлическая медь;
ответить, что является основными окислителями в окружающей среде;
на каком металле (участке) протекает процесс восстановления;
составить суммарное уравнение коррозии цинка водой, объединив уравнения анодной (1) и катодной (2) реакций с учетом коэффициентов электронного баланса
Zn+2H+→…
рассчитать ЭДС реакции коррозии цинка водой в кислой среде, возможна ли она;
составить уравнение катодной реакции с водородной деполяризацией
2. H+ +…→H2 +… (pH≤7)
составить уравнение катодной реакции с кислородной деполяризацией
3. O2+…→… (pH≤7)
составить суммарное уравнение коррозии цинка кислородом в водной среде, объединив уравнения анодной (1) и катодной (2) реакций с учетом коэффициентов электронного баланса
Zn+O2+H+→…
рассчитать ЭДС реакции коррозии цинка кислородом в кислой водной среде, возможна ли она;
ответить, в каком направлении перемещаются в среде электролита положительно- и отрицательно заряженные ионы;
составить краткую схему записи образующегося коррозионного гальванического элемента.
Опыт 3. Коррозия оцинкованного и омедненного железа.
В две пробирки налить до половины дистиллированной воды и добавить 3 капли 2н раствора серной кислоты и красной кровяной соли K3[Fe(CN)6] (иодинатр – чувствительный реактив на ион Fe2+, который в его присутствии даёт интенсивное синее окрашивание).
Приготовленные растворы перемешать. В одной из железных скрепок закрепить кусочек цинка, в другой – кусочек меди. Опустить каждую из скрепок в приготовленную пробирку из контактных пар в отдельную приготовленную пробирку;
отметить, в какой пробирке появляется и усиливается синяя окраска, свидетельствующая о накоплении ионов железа (II);
сравнить, в какой пробирке происходит более интенсивное выделение газа, на каком металле;
ответить, в какой пробирке происходит помутнение раствора.
а. Электрохимическая коррозия цинка в контактной паре с железом
сравнить значения стандартных окислительно-восстановительных потенциалов
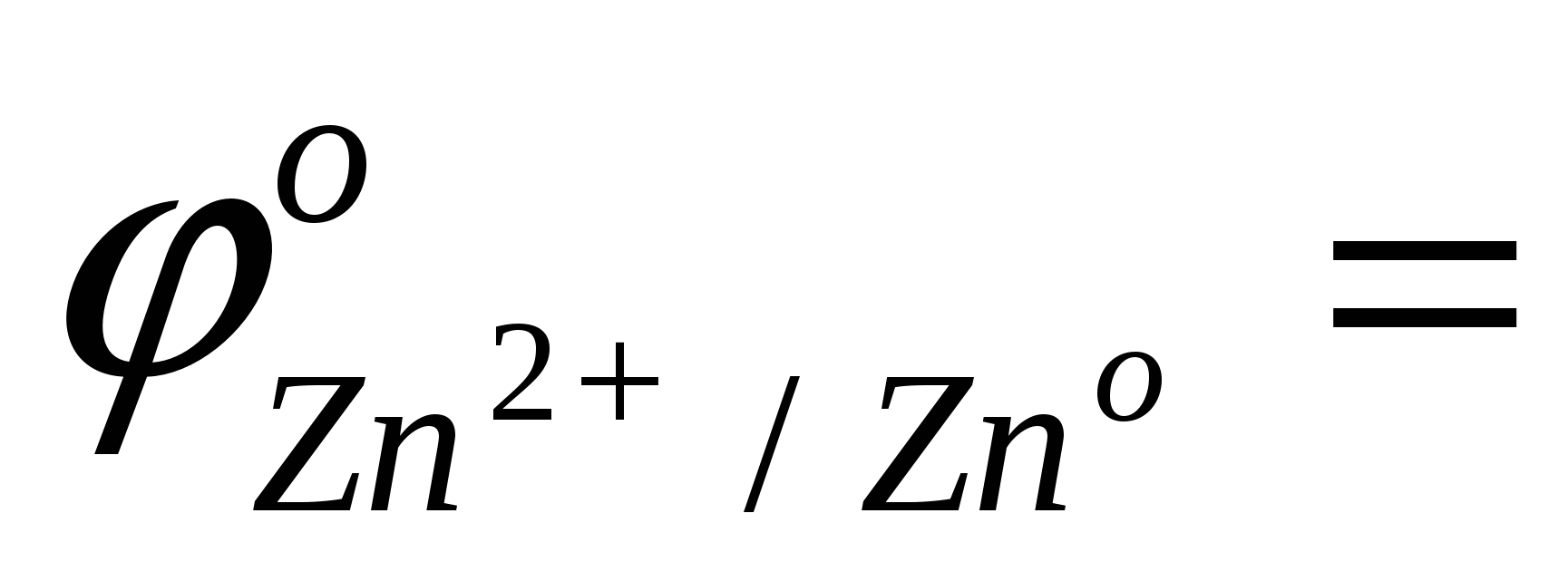 …; …; 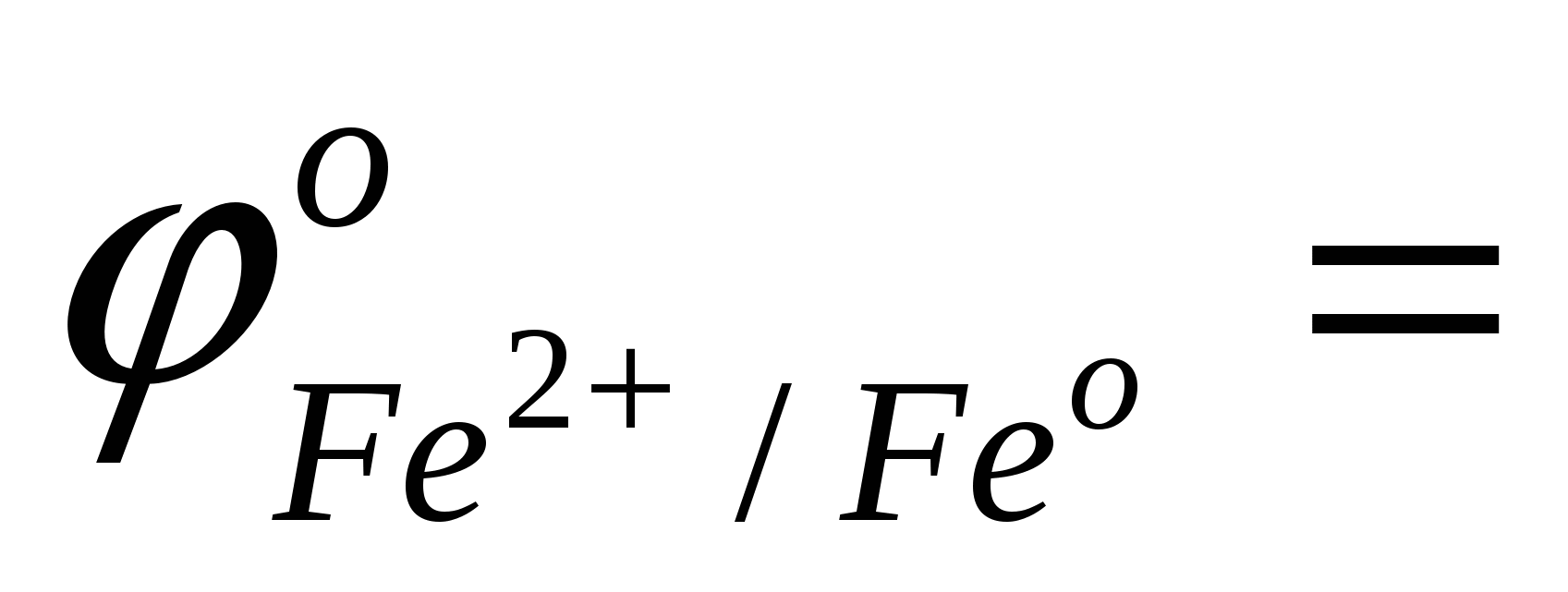 …; …;
ответить, какой из металлов - Zn или Fe - является более активным восстановителем;
какой из металлов является анодным и какой – катодным участком;
составить уравнения анодной реакции
1. Zno-2e→… (процесс…)
составить уравнение катодной реакции с водородной деполяризацией
2. H2O+…→H2+…(pH≥7 процесс…)
составить суммарное уравнение коррозии цинка водой, объединив уравнения анодной (1) и катодной (2) реакций с учетом коэффициентов электронного баланса
Zn+H2O→…
составить уравнение катодной реакции с кислородной деполяризацией
3. O2+H2O→… (pH≥7 процесс…)
составить суммарное уравнение коррозии цинка кислородом в водной среде, объединив уравнение анодной (1) и катодной (3) реакцией с учетом коэффициентов электронного баланса
Zn+O2+H2O→…
б. Электрохимическая коррозия железа в контактной паре с медью
сравнить значения стандартных окислительно-восстановительных потенциалов;
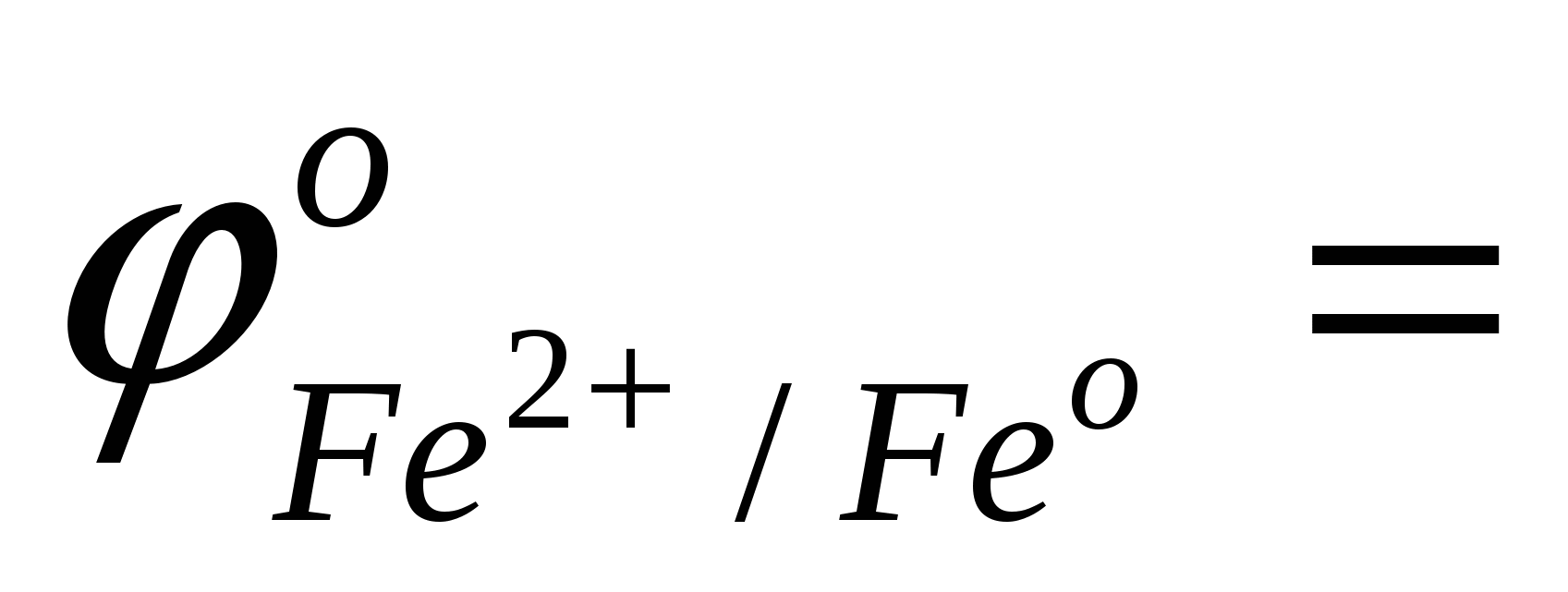 …; …; 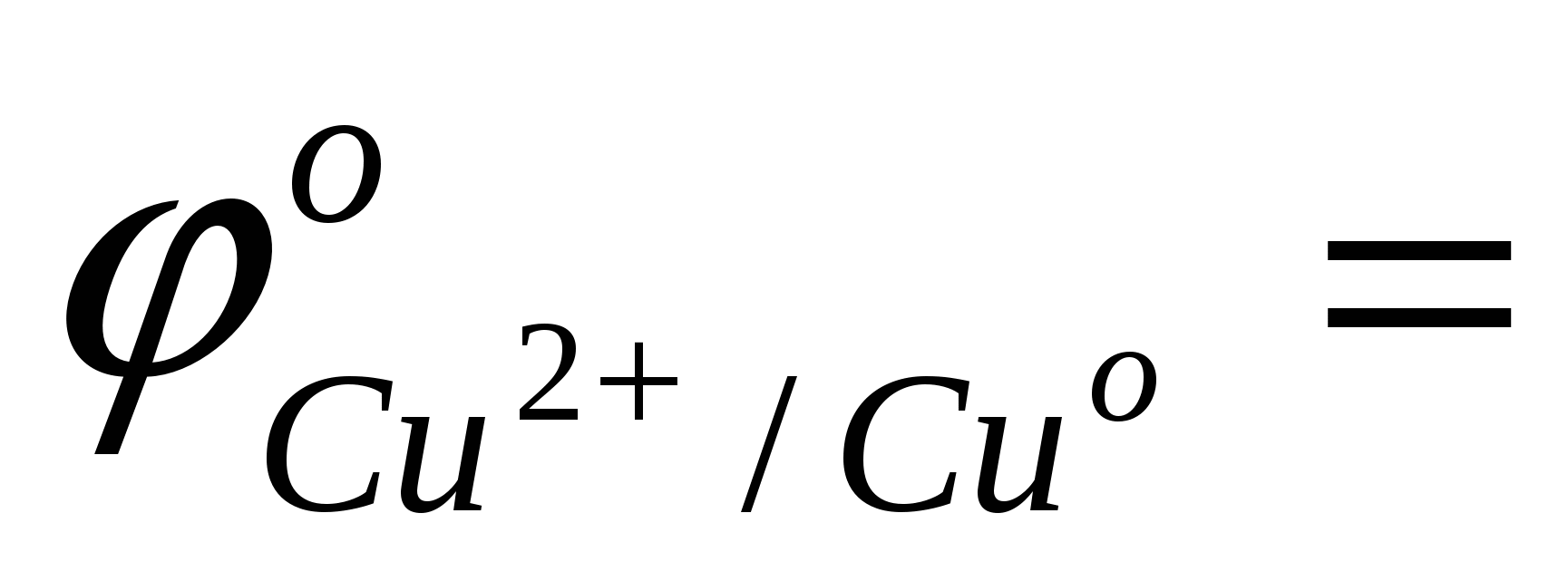 …; …;
ответить, какой из металлов - Fe или Cu - является более активным восстановителем;
какой из металлов является анодным и какой – катодным участком;
составить уравнение анодной реакции
1. Feo -2e→…(процесс…);
составить уравнение катодной реакции с водородной деполяризацией
2. H2O+…→H2+…(pH≥7, процесс…);
составить суммарное уравнение коррозии железа водой, объединив уравнения анодной (1) и катодной (2) реакции с учетом коэффициентов электронного баланса
Fe+H2O→…;
рассчитать ЭДС реакции коррозии железа водой в нейтральной среде
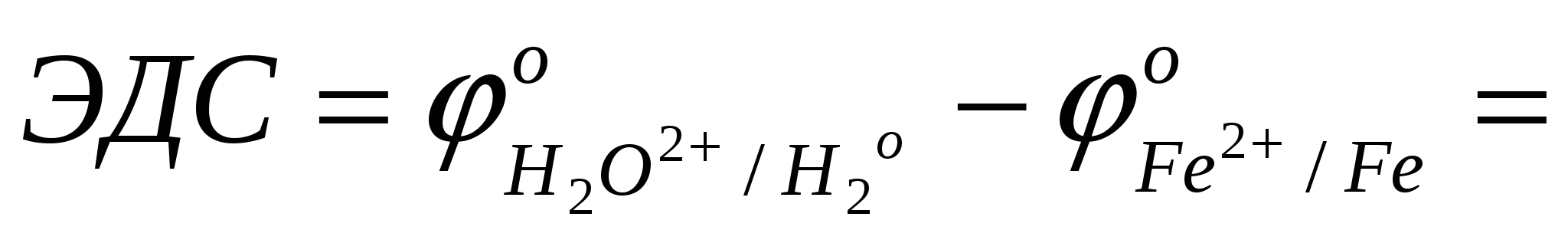 … …
составить уравнение катодной реакции с кислородной деполяризацией
3. O2+H2O+…→… (pH≥7, процесс…)
составить суммарное уравнение коррозии железа кислородом в водной среде, объединив уравнения анодной (1) и катодной (3) реакций с учетом коэффициентов электронного баланса
Fe+O2+H2O→….
объяснить механизм электрохимической коррозии железа в контактной паре с медью
составить краткую схему образующегося коррозионного гальванического элемента;
ответить, какие вторичные процессы коррозии могут протекать в данной системе;
составить уравнение окисления гидроксида железа (II)
Fe(OH)2+O2+H2O→…
ответить, какие соединения могут входить в состав ржавчины;
ответить, какое из покрытий - Cu или Zn - называют анодным; какое – катодным;
какое из покрытий – анодное или катодное – защищает железо от коррозии даже после разрушения покрытия.
|
|
|
 Скачать 306 Kb.
Скачать 306 Kb.