Методичка для лабораторных работ по химии. Уфимский государственный нефтяной технический университет
 Скачать 306 Kb. Скачать 306 Kb.
|
Опыт 1. Получение и свойства кислой соли – гидрокарбоната кальцияНалить в пробирку раствор гидроксида кальция. Пропустить диоксид углерода из аппарата Киппа, полностью погрузив конец отводной трубки в пробирку с раствором гидроксида кальция. Наблюдать в начале образование осадка средней соли, а затем его растворение вследствие образования кислой соли. К полученному раствору гидрокарбоната кальция прилить раствор гидроксида кальция. - Объяснить принцип работы аппарата Киппа; - составить уравненипе реакции, протекающей в аппарате Киппа CaCO3↓+HCl→…; - какие свойства проявляет выделяющийся диоксид углерода при взаимодействии с гидроксидом кальция, к какому типу относится эта реакция; - составить уравнение реакции Ca(OH)2+CO2→………..+…; осадок - составить уравнение реакции, протекающей между осадком карбоната кальция и избытком диоксида углерода: CaCO3↓+H2O+CO2→…; - указать, какая из полученных солей относится к классу «средних» и какая к классу «кислых солей»; - сравнить растворимость «средних» и «кислых» солей; - составить уравнение реакции взаимодействия гидрокарбоната кальция с гидроксидом кальция Ca(HCO3)2+Ca(OH)2→…; - указать, какие свойства в этом взаимодействии проявляет кислая соль - гидрокарбонат кальция. Опыт 2. Получение и свойства основной соли – хлорида гидроксокобальта (II) В две пробирки прикапать по 2 капли раствора хлорида кобальта (II) и 2 н раствора гидроксида натрия до образования синего осадка. В первую пробирку к образовавшемуся хлориду гидроксокобальта (II) добавить раствор гидроксида натрия до изменения цвета осадка, к другой – раствор соляной кислоты до его растворения. - Отметить цвет полученного осадка и образовавшегося раствора. - Составить уравнение I стадии взаимодействия хлорида кобальта (II) с гидроксидом натрия в молекулярной и ионной форме: CoCl2+NaOH→…+…; - составить уравнение реакции основной соли – хлорида гидроксокобальта (II) с избытком гидроксида натрия в молекулярной и ионной форме: (CoOH)Cl↓+NaOH→……………..+…; гидроксид кобальта (II) - составить уравнение реакции основной соли – хлорида гидроксокобальта (II) с избытком соляной кислоты в молекулярной и ионной форме (CaOH)Cl+HCl→…+….; - указать, «основную» и «среднюю» соль кобальта (II); - указать, какие кислотно-основные свойства проявляет основная соль. Опыт 3. Взаимодействие соли слабой кислоты с сильной кислотойПоместить в пробирку один микрошпатель кристаллического ацетата натрия и прилить 8 капель 2 н серной кислоты. Слегка подогреть пробирку в ладони и по запаху определить продукт реакции. - Составить уравнение реакции взаимодействия ацетата натрия и серной кислоты в молекулярной и ионной форме: CH3COONa+H2SO4→…+…; - к какому типу относится эта реакция; - указать, какая кислота образуется – сильная или слабая; - сформулировать условие протекания ионно-обменной реакции. Опыт 4. Образование плохорастворимой соли – сульфата барияНалить в три пробирки по 2 капли раствора хлорида бария и добавить в одну из них 3 капли раствора Na2SO4, в другую – раствора H2SO4, в третью - раствора Al2(SO4)3. Наблюдать появление одинакового осадка. - Составить уравнения реакций в молекулярной и ионной форме 1) BaCl2+Na2SO4→…; 2) BaCl2+H2SO4→…; 3) BaCl2+Al2(SO4)3→…; - сравнить ионные уравнения реакций 1) – 3); - к какому взаимодействию сводится суть всех трех реакций; - к какому типу относятся реакции; - сформулировать в каком направлении протекают ионно-обменные реакции. Опыт 5. Произведение растворимости и образование осадков галогенидов свинца (II) В две пробирки налить по 3 капли 0,005 М раствора нитрата свинца (II). В одну из них прибавить такой же объём 0,05 М раствора хлорида калия, а в другую – такой же объем 0,05 М раствора иодида калия. - Отметить, какой осадок образуется и какой – нет;
Pb(NO3)2 …; 0,005 моль/л [Pb2+]o=?
KCl …; KI …; 0,05 моль/л 0,05 моль/л [Cl-]o=? [I-]o=? - рассчитать концентрации ионов Pb2+ и хлорид (иодид)-ионов после смешивания равных объемов исходных растворов: [Pb2+]см.=? [Cl-]см.=? [I-]см.=?; - ответить, какие растворы называют насыщенными, из каких растворов образуются осадки; - рассчитать произведение концентраций - ответить, раствор после смешивания нитрата свинца (II) и хлорида калия является ненасыщенным или перенасыщенным; - рассчитать произведение концентраций - ответить, раствор после смешивания нитрата свинца (II) и иодида калия является ненасыщенным или перенасыщенным; - сформулировать условие образования осадка. 2.4 Лабораторная работа № 4 Опыт 1. Определение рН в растворах солей Испытуемые растворы: MgCl2, CuSO4, Na2CO3, NaCl. Определить рН растворов солей. На чистое сухое предметное стекло положить четыре полоски универсального индикатора, нанести на каждую из них по 1 капле испытуемых растворов и сравнить окраску бумаги с эталонной шкалой рН универсального индикатора. - Записать значения рН, указать, какая среда в испытуемых растворах; - ответить, что такое «гидролиз солей»; - ответить, в растворах каких солей гидролиз не протекает; - в растворах каких солей протекает гидролиз по катиону; - составить уравнение гидролиза MgCl2 в молекулярной и ионной форме 1 ст. MgCl2+H2O↔…; 2 ст. MgOHCl+H2O↔…; - составить уравнения гидролиза CuSO4 в молекулярной и ионной форме 1 ст. CuSO4+H2O↔…; 2 ст. (CuOH)2SO4+H2O↔…; - ответить, какая стадия (1-ая или 2-ая) протекает в большей степени; - ответить, используя значения рН в растворах, какая соль MgCl2 или CuSO4 гидролизуется в большей степени; - ответить, как связаны сила основания и склонность его солей к гидролизу по катиону; - по результатам гидролиза солей MgCl2 и CuSO4 сравнить основные свойства соответствующих гидроксидов: Mg(OH)2 и Cu(OH)2; - ответить, в растворах каких солей протекает гидролиз по аниону; - составить уравнение гидролиза Na2CO3 в молекулярной и ионной форме 1 ст.: Na2CO3+H2O↔…; 2 ст.: NaHCO3+H2O↔…; - составить выражения для констант гидролиза Na2CO3 по 1-ой и по 2-ой стадии: - рассчитать константы гидролиза Na2CO3 по 1-ой и по 20ой стадии, используя значения ктнстант диссоциации для угольной кислоты (таблица) 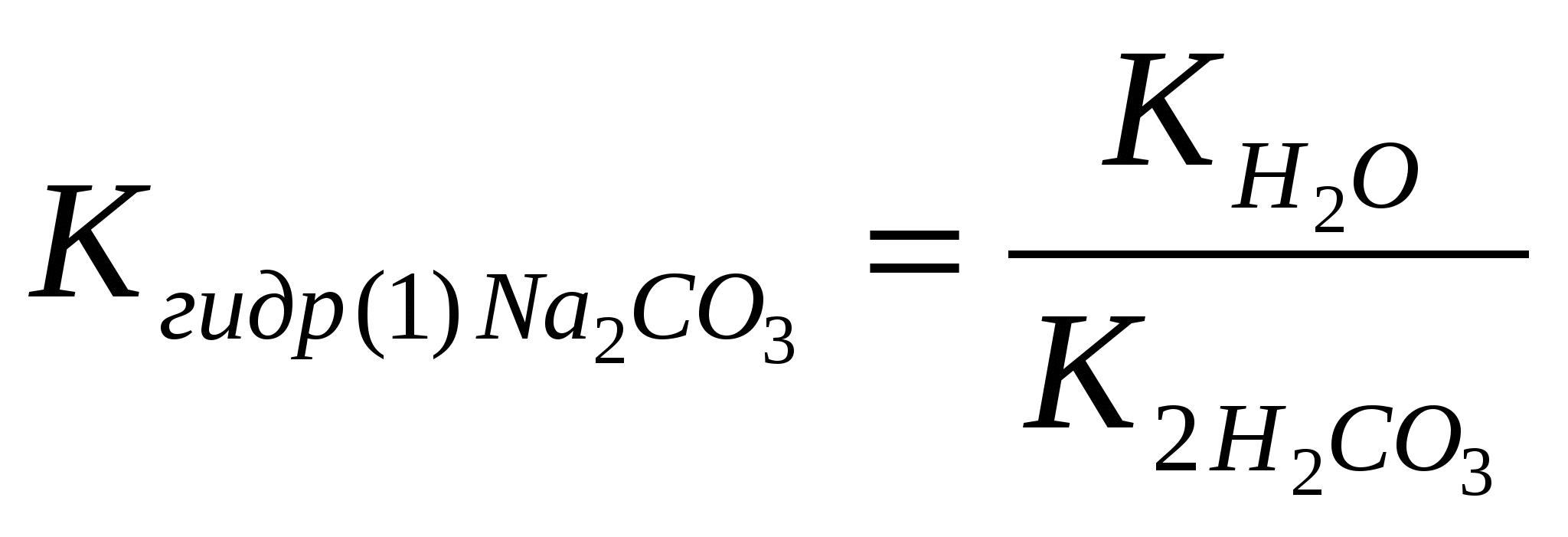 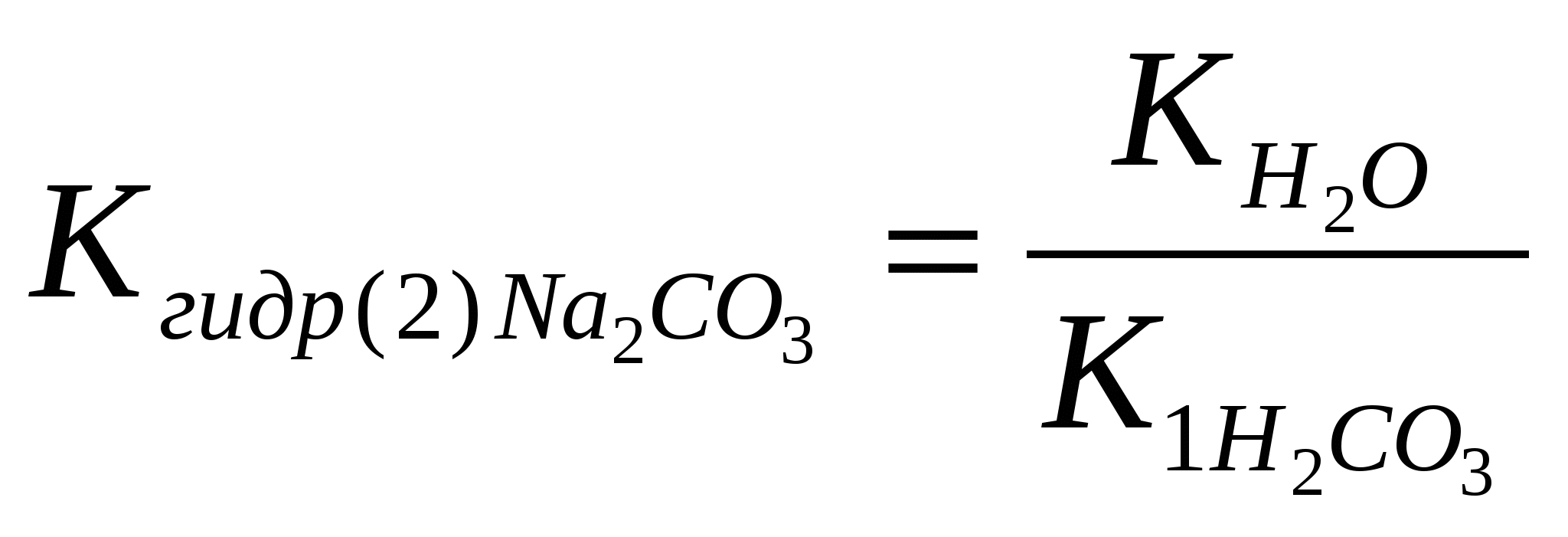 - ответить, какая стадия гидролиза Na2CO3 протекает в большей степени; - ответить, в каком направлении смещено равновесие гидролиза соли Na2CO3 ; - ответить, в испытуемых растворах протекает частичный или полный гидролиз. Опыт 2. Влияние температуры на гидролиз соли. Обратимость гидролиза Налить в пробирку 1 мл 0,5 М раствора ацетата натрия и 1 каплю фенолфталеина. Нагреть раствор до кипения, после чего вновь охладить. - Отметить изменение окраски раствора при нагревании и при охлаждении; - используя таблицу по окраске фенолфталеина, указать, какая среда в растворе ацетата натрия и как она изменяется при нагревании и при охлаждении раствора соли; - составить уравнение гидролиза ацетата натрия в молекулярной и ионной форме CH3COONa+H2O↔… (молекулярное уравнение) CH3COO-+H2O↔… (ионное уравнение) - ответить, в каком направлении смещается равновесие гидролиза при нагревании и при охлаждении раствора; - используя принцип Ле Шателье и результаты опыта, ответить, гидролиз соли протекает с выделением или поглощением тепла; гидролиз – экзо- или эндотермический процесс; - по результатам опыта ответить, гидролиз - обратимый или необратимый процесс. Опыт 3. Полный гидролиз соли В две пробирки прикапать по 1-2 капли хлорида алюминия. В первую пробирку прикапать раствор карбоната натрия, во вторую пробирку – раствор сульфида натрия до выпадения осадка. - Отметить внешние проявления реакций: образование осадка, выделение газа, запахи; - ответить, образуется ли карбонат алюминия в водном растворе; - составить уравнение реакции между водными растворами карбоната натрия и хлорида алюминия: в молекулярной и ионной форме: AlCl3+Na2CO3+H2O→…; Al3++CO32-+H2O→…; - ответить, образуется ли сульфид алюминия в водном растворе; - составить уравнения реакции между водными растворами сульфида натрия и хлорида алюминия в молекулярной и ионной форме: AlCl3+Na2S+H2O→…; Al3++S2-+H2O→…; - отличаются или нет по составу образующиеся осадки в первой и во второй пробирках; - совместный гидролиз по катиону и по аниону взаимно усиливаются или нет; - ответить, какие соли подвергаются полному гидролизу, как это отражается в таблице растворимости.
3.1 Лабораторная работа № 5. Химические свойства металлов Опыт 1. Взаимодействие металлов с соляной кислотой. Ряд стандартных окислительно-восстановительных потенциалов металлов В пять пробирок налить по 1 мл 2 М раствора соляной кислоты и поместить в каждую пробирку по одному кусочку металла: Mg, Zn, Fe, Pb, Cu. Наблюдать за изменениями в пробирках в течение 5-10 минут. Пробирку со свинцом нагреть, после охлаждения добавить 2 капли сульфида натрия. - Отметить, как протекают реакции в каждой из пробирок, что выделяется; - расположить металлы в порядке уменьшения их активности по отношению к соляной кислоте; - какой металл не взаимодействует с соляной кислотой; - составить уравнения реакций Mg+HCl→…; Zn+HCl→…; Fe+HCl→…; - определить окислитель и восстановители; - выписать из таблицы значения стандартных окислительно-восстановительных потенциалов электрохимических систем - рассчитать ЭДС проведенных реакций ЭДС=φок. – φвос. - указать, какие из проведенных реакций термодинамически возможны; - сформулировать условие самопроизвольного протекания окислительно-восстановительной реакции; - отметить, какие изменения происходят в пробирке со свинцом после нагревания; - составить уравнение реакции to Pb+HCl→…; - составить уравнение реакции, подтверждающей наличие ионов Pb2+ в растворе PbCl2+Na2S→… - ответить, почему свинец не взаимодействует с соляной кислотой при комнатной температуре; - объяснить, что такое «пассивирование металла»; - сформулировать, какие металлы могут вытеснять молекулярный водород из кислот. |
