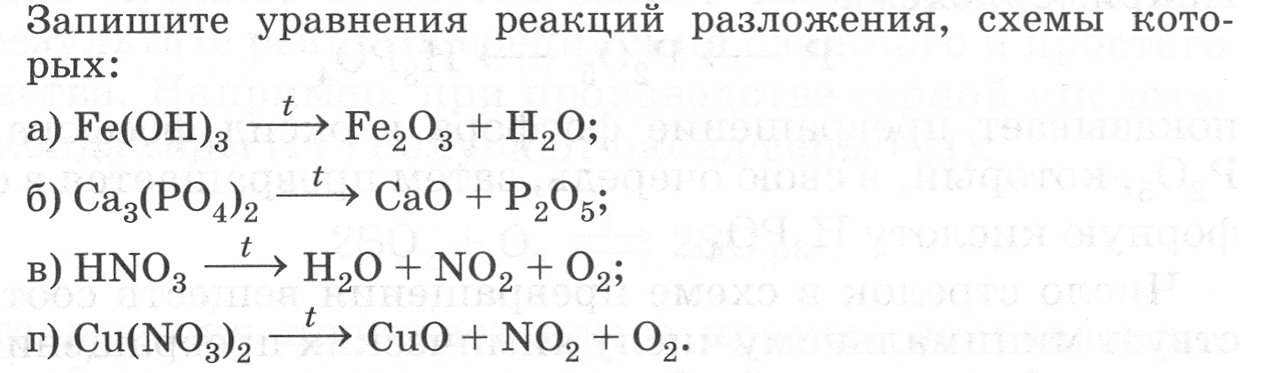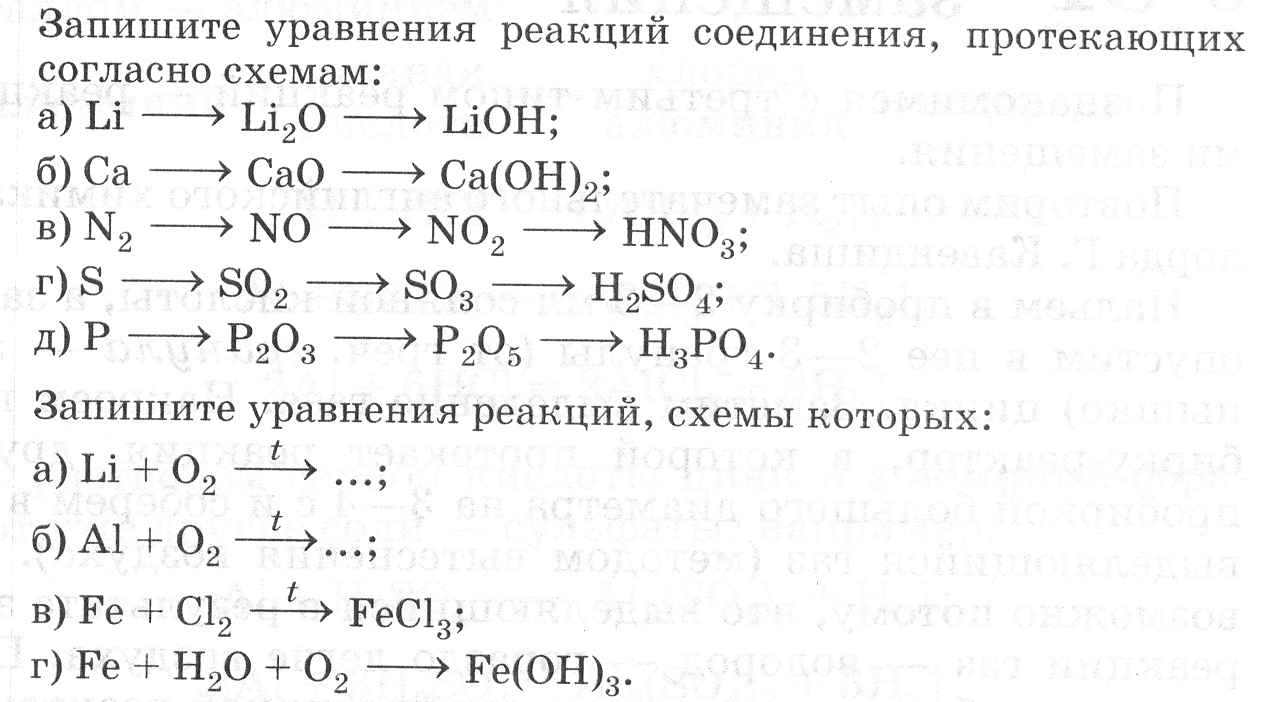8 класс по учебнику ПАМЯТКИ И ЗАДАНИЯ. Урок Техника безопасности. Видеоурок httpsclck ruLeewp
 Скачать 3.86 Mb. Скачать 3.86 Mb.
|
|
Тема: Чистые вещества и смеси. Цель: Очистка поваренной соли Оборудование и реактивы: запишите самостоятельно. Ход работы.
Вывод: Мы получили соль, она стала (написать какой)……… Ответить на вопросы: Сколько смесей было, перечислите их. Определите тип каждой смеси Укажите способ разделения каждой смеси. 35 Урок. Массовая доля вещества в смеси. Видеоурок: https://clck.ru/Leqr4 
№ 91. Решите задачи. В 45 г воды растворили 5 г соли. Вычислите массовую доли соли (в%) в полученном растворе. Вычислите массы воды и сахара, содержащиеся в 300 г раствора с массовой долей сахара 15%. К 300 г раствору соли, с массовой долей соли 25% добавили 5 г соли. Вычислите массовую долю соли в новом растворе. Смешали 200 г раствора с массовой долей соли кислоты 5% и 300 г раствора с массовой долей кислоты 10%. Вычислите массовую долю кислоты в новом растворе. Домашнее задание. № 92. Решите задачи. В 8 л воды растворили 100 г соли. Вычислите массовую долю соли в этом растворе? Сколько граммов йода и спирта нужно взять для приготовления 30 г 5% раствора йодной настойки? Из 250 г 20% раствора хлорида кальция выпарили 100 г воды. Какой стала массовая доля соли в растворе? В 180 г 15% раствора гидроксида натрия растворили ещё 20 г щелочи. Рассчитайте массовую долю щелочи в полученном растворе. Слили два раствора серной кислоты: 240 г 30% и 180 г 5%. Рассчитайте массовую долю щелочи в полученном растворе. 36 Урок. Химические уравнения. Закон сохранения массы вещества. Видеоурок: https://clck.ru/Leqsj  № 93. Уравняйте химические уравнения.
№ 94. Запишите уравнения химических реакций по следующим схемам: Гидроксид калия + оксид фосфора→ фосфат калия + вода Оксид бария + азотная кислота → нитрат бария + вода Хлорид железа (III) + гидроксид калия → гидроксид железа (III) + хлорид калия Список использованных источников. Домашнее задание. Интерактивное упражнение 1. https://clck.ru/Lery4  Интерактивное упражнение 2. https://clck.ru/Leryk  Интерактивное упражнение 3. https://clck.ru/LerzD  № 95. Решите задачи.
37 Урок. Типы химических реакций. Замещение и обмен. Видеоурок: https://clck.ru/LequP и https://clck.ru/Leqv8   № 96. Закончите уравнения химических реакций. Укажите тип реакции.
Домашнее задание. № 97. Решите задачи. 1  . .2. 38 Урок. Типы химических реакций. Соединение и разложение. Видеоурок: https://clck.ru/LeqxU и https://clck.ru/Leqxp   № 98. Закончите уравнения химических реакций. Укажите тип реакции.
Домашнее задание. № 99. Решите задачи.
39 Урок. Решение задач. Уравнения химических реакций и типы химических реакций. Видеоурок https://clck.ru/Leqyq  № 100. Решите задачи. На 3. Ураваняйте химическое уравнение, укажите тип реакции, напишите названия веществ. А)AlCl3+ NaOH→Al(OH)3+NaCl Б) P2O5+H2O→H3PO4 На 4. Закончите уравнения химической реакции, укажите тип реакции, напишите названия веществ. А) Fe(OH)2→ Б) Cl2+H2→ На 5. Закончите уравнения химической реакции, укажите тип реакции, напишите названия веществ. А) Карбонат кальция→ Б) оксид серы(VI)+ вода→ В) Гидроксид натрия+ соляная кислота → 40 Урок. Расчеты по химическим уравнениям. Видеоурок: https://clck.ru/Ler3W  Алгоритм решения задачи. Прочитать задачу Записать кратко условие Записать уравнение химической реакции Над уравнение химической реакции записать кратко условие Под уравнением химической реакции записать предварительные расчеты, согласно уравнении: M (г/моль)- молярная масса, вычисляется по периодической таблице химических элементов; n (моль)-количество вещества, это коэффициент перед формулой вещества в уравнении химической реакции; m (г)- масса, вычисляется по формуле M*n; Vm (л/моль) – молярный объем , при н.у. равен 22,4 л/моль для любого газообразного вещества; n (моль)-количество вещества, это коэффициент перед формулой вещества в уравнении химической реакции; V (л)- объем, вычисляется по формуле Vm*n; Вычисляем массу чистого вещества в смеси (если по условию задачи дана смесь и указана массовая доля вещества в этой смеси): в жидких смесях – m(вещества) = m(pаствора) *w(%):100% в твердых смесях - m(вещества) = m(смеси) *w(%):100% в газообразных смесях - V(вещества) = V(смеси) *φ(%):100% Cоставляем пропорцию и решаем её (числа записанные над реакцией делить на числа, которые записаны под реакцией. в соответствующих единицах измерения) № 101. Решите задачи. Какой объём (н.у.) водорода выделится при взаимодействии соляной кислоты с 35 г цинка, содержащего 10% примесей. Какой объем (н.у.) водорода выделится при взаимодействии серной кислоты с 135 г алюминия, содержащего 15% примесей. Домашнее задание. № 102. Решите задачи.  41 Урок. Расчеты по химическим уравнениям. № 103. Решите задачи. Какой объём (н.у.) водорода выделится при взаимодействии 720 г 25% раствора соляной кислоты с алюминием. Какой объём (н.у.) водорода выделится при взаимодействии 155 г 15% раствора серной кислоты с железом (II). Домашнее задание. № 104. Решите задачи Вычислите объём газа водорода (н.у), который образуется при взаимодействии соляной кислоты с 35 г алюминия, содержащего 8% примесей. Вычислите объём газа водорода (н.у), который образуется при взаимодействии 150 г 45% раствора соляной кислоты с алюминием. 42 Урок. Обобщение по теме: Сложные вещества. Решение задач № 105. Решите задачи. Вычислите объём газа водорода (н.у), который образуется при взаимодействии соляной кислоты с 45 г алюминия, содержащего 7% примесей Вычислите объём газа водорода (н.у), который образуется при взаимодействии 100 г 45% раствора соляной кислоты с магнием. Домашнее задание. № 106. Решите задачи: Вычислите объём газа водорода (н.у), который образуется при взаимодействии серной кислоты с 65 г алюминия, содержащего 10% примесей Вычислите объём газа водорода (н.у), который образуется при взаимодействии серной кислоты с 70 г цинка, содержащего 20% примесей 43 Урок. Обобщение по теме: Химические реакции. Задание № 107
№ 108. Решите задачи. Выполните задания из таблицы (см. выше) из графы «Задания для работы дома». 44 Урок. Контрольная работа по теме: Химические реакции. № 109. Выполните задания контрольной работы по теме: «Химические реакции». 45 Урок. Растворимость. Теория электрической диссоциации. Видеоурок: https://clck.ru/Ler4V  № 110. Работа с графиком растворимости. Определит, у какого вещества растворимость при 500С наибольшая, наименьшая; Как изменяется растворимость хлорида натрия в зависимости от температуры; 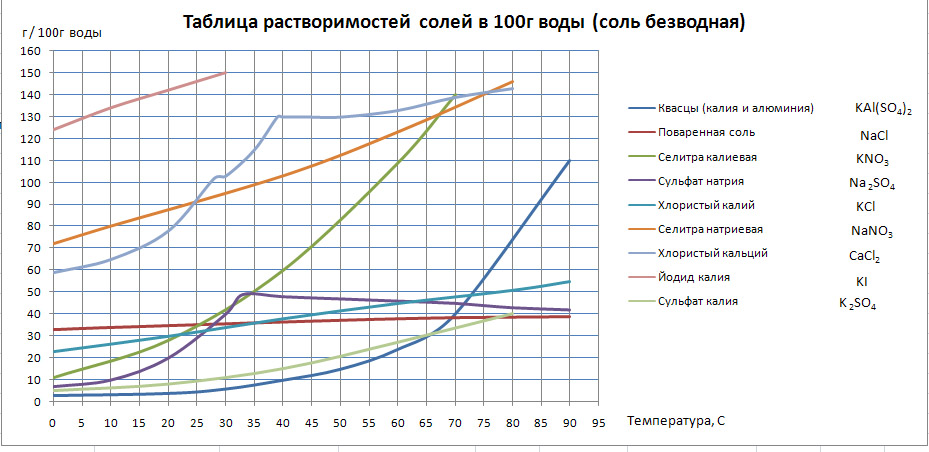 Домашнее задание. № 111. Заполните таблицу:
46 Урок. Электрическая диссоциация классов неорганических веществ. Видеоурок : https://clck.ru/Ler56 и https://clck.ru/Ler5e   № 112. Запишите уравнения электролитической диссоциации: На 3: Запишите уравнение электролитической диссоциации для: Ca(NO3)2, H3PO4, KOH На 4: Запишите уравнение электролитической диссоциации для: H2SO4, AlCl3, Ca(OH)2, CuO На 5: Запишите уравнение электролитической диссоциации для: оксида меди (II), нитрата алюминия, гидроксида натрия, угольная кислота Домашнее задание. ТЕСТ https://clck.ru/Les2W  № 113. Решите задачи.
47 Урок. Реакции ионного обмена. Видеоурок: https://clck.ru/Ler6T  № 114. Запишите уравнения химических реакций в ионном виде: AgNO3 + HCl → AgCl + HNO3 KOH + CuCl2→ карбонат натрия + соляная кислота→ Домашнее задание. № 115. Решите задачи.  48 Урок. Решение задач. Реакции ионного обмена. № 116. Закончите уравнения химических реакций и запишите их в ионном виде: хлорид меди+ гидроксид калия→ сульфит натрия + серная кислота→ гидроксид алюминия + соляная кислота → Домашнее задание. № 117 . Закончите уравнения химических реакций и запишите их в ионном виде: нитрат серебра + соляная кислота → сульфат натрия + хлорид бария → карбонат калия + хлорид кальция→ № 118. Подготовиться к практической работе по теме: «Реакции ионного обмена». 49 Урок. Практическая работа «Реакции ионного обмена». № 119. Выполните практическую работу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||