Технологическая карта урока «Алюминий, его физические и химическ. Урока Алюминий, его физические и химические свойства, применение
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
|
Технологическая карта урока «Алюминий, его физические и химические свойства, применение» Бурбело Ирина Александровна Преподаватель химии ГБПОУ «Колледж связи № 54» им. П.М. Вострухина города Москвы Представленный урок - урок изучения и первичного закрепления новых знаний и способов деятельности с использованием системно-деятельностного подхода изучения химии и технологии проблемного обучения, что позволяет использовать активность ученика в решении проблемных ситуаций, поисковой деятельности, эвристической беседы, работе в группе. На уроке используются: исследовательская деятельность учащихся, ЭОР. В ходе урока планируются не только предметные результаты обучения, но и метапредметные и личностные. Преподавание химии в 9 классе ведется по учебнику О.С. Габриеляна. По учебному плану на изучения химии - отводится 2 часа в неделю, 64 часа в год. Данный урок является текущий в Тема урока: «Алюминий, его физические и химические свойства, применение». Цель урока: развитие предметных, информационных и коммуникативных компетенций у учащихся при формировании понятия алюминия как химического элемента и простого вещества. Задачи урока: учебные задачи, направленные на достижение личностных результатов обучения: Формирование нравственных и эстетических представлений об окружающем мире и умения следовать общепринятым нормам поведения. Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории. учебные задачи, направленные на достижение метапредметных результатов обучения: Продолжить развивать умение определять цель, выдвигать гипотезу через выполнение исследовательской работы, генерировать идеи, выявлять причинно-следственные связи, искать аналогии. Организовать учебное сотрудничество и совместную деятельность с учителем и сверстниками для работы в группе и индивидуально Продолжить формировать и развивать компетентности в области ИКТ. Учебные задачи, направленные на достижение предметных результатов обучения: Изучить простое вещество алюминий и научиться творчески, применять полученные знания на практике. Продолжить знакомство с особенностяминаучного исследования на основе установления причинно-следственной связи между строением, свойствами и применением на примере алюминия. Оборудование урока: доска, проектор, компьютер, компьютерная презентация к уроку, ПСХЭ Д.И. Менделеева, коллекция «Алюминий и его соединения», задания на карточках, раздаточные материалы, карточки, лабораторное оборудование – алюминиевая фольга, алюминиевая проволока, алюминиевые ложка и кружка, штативы с пробирками, спиртовка, спички, держатель для пробирок, стакан с водой; бенгальский огонь, растворы соляной кислоты и гидроксида натрия, гранулы алюминия, сульфата алюминия.
Приложение 1 В тринадцатой квартире Живёт известный в мире Как проводник прекрасный, Пластичен, серебрист. Ещё по части сплавов Завоевал он славу. И в этом деле - специалист. Вот мчится словно ветер В космической ракете По внешности он видный, Хоть плёнкою оксидной покрыт, Она ему прочная броня. Он мягкий, лёгкий, ковкий, Сверкает в упаковке. Обёрнуты конфеты блестящею фольгой. Для плиток шоколада Его немало надо. А раньше был он очень дорогой. Приложение 2 Является сестра своих сестер, невеста своих женихов. — Здравствуй, сестра, — говорит она царице, — здесь и ты, сестра? — говорит она Вере Павловне. — Ты хочешь видеть, как будут жить люди, когда царица, моя воспитанница, будет царствовать над всеми? Смотри. Здание, громадное, громадное здание, каких теперь лишь по нескольку в самых больших столицах, — или нет, теперь ни одного такого! Оно стоит среди нив и лугов, садов и рощ… …………………. Но это здание, — что ж это, какой оно архитектуры? теперь нет такой; нет, уж есть один намек на нее, — дворец, который стоит на Сайденгамском холме: чугун и стекло, чугун и стекло — только. Нет, не только: это лишь оболочка здания, это его наружные стены; а там, внутри, уж настоящий дом, громаднейший дом: он покрыт этим чугунно-хрустальным зданием, как футляром; оно образует вокруг него широкие галереи по всем этажам. Какая легкая архитектура этого внутреннего дома, какие маленькие простенки между окнами, а окна огромные, широкие, во всю вышину этажей! его каменные стены — будто ряд пилястров, составляющих раму для окон, которые выходят на галерею. Но какие это полы и потолки? Из чего эти двери и рамы окон? Что это такое? серебро? платина? да и мебель почти вся такая же, — мебель из дерева тут лишь каприз, она только для разнообразия, но из чего ж вся остальная мебель, потолки и полы? «Попробуй подвинуть это кресло», — говорит старшая царица. Эта металлическая мебель легче нашей ореховой. Но что ж это за металл? Ах, знаю теперь, Саша показывал мне такую дощечку, она была легка, как стекло, и теперь уж есть такие серьги, брошки; да, Саша говорил, что, рано или поздно, ----------- заменит собою дерево, может быть, и камень. Но как же все это богато! Везде ____________ и ____________, и все промежутки окон одеты огромными зеркалами. И какие ковры на полу! Вот в этом зале половина пола открыта, тут и видно, что он из_____________. «Ты видишь, тут он матовый, чтобы не был слишком скользок, _____________тут играют дети, а вместе с ними и большие; вот и в том зале пол тоже без ковров, __________ для танцев». И повсюду южные деревья и цветы; весь дом ____________ громадный зимний сад. Приложение 3 Карточка с фактами Это третий по распространённости на земле элемент. На его долю приходится более 8% земной коры. В 1978 г. в породах Сибирской платформы обнаружен самородок этого. металла в виде нитевидных кристаллов длиной 0,5 мм. Найден в лунном грунте. Был открыт в 1825 г. и стоил в 1500 раз дороже золота. Погремушку, изготовленную из этого металла, торжественно преподнесли сыну Наполеона III. Первым изделием из этого металла были пуговицы на камзоле одного из последних королей Франции. Только очень богатые люди могли позволить себе употреблять пищу из таких тарелок, изготовленных из этого металла. Мастера, принёсшего в дар римскому императору Тиберию чашу из этого металла, казнили. 1855 год, Парижская выставка – он демонстрировался как самый редкий и дорогой металл, который был почти в 10 раз дороже золота. Приложение 4 «Что объединяет изображения?»             Приложение 5 Группа 1 Задание 1. Рассмотрите положение алюминия в периодической системе химических элементов и строение его атома по предложенному плану. Объясните, почему алюминий проявляет переходные свойства? (Слайд 5) Вставьте пропущенные слова Алюминий - элемент III периода, III группы, главной подгруппы. Заряд ядра атома алюминия равен +13. В ядре атома алюминия 13 протонов, 14 нейтронов. В атоме алюминия 13 электронов. Электронное строение алюминия 1s2 2s2 2p6 3s2 3p1 На внешнем уровне в атоме 3 электронов. Степень окисления атома алюминия равна +3 . Простое вещество алюминия является металлом. Формула оксида алюминия Al2O3 , его характер амфотерный. Формула гидроксида алюминия Al(OH)3, его характер амфотерный. Как и положено элементу 3-го периода, атомы алюминия имеют три энергетических уровня. На последнем уровне атомы алюминия содержат три электрона. Следовательно, распределение электронов по уровням в атомах алюминия таково: 13Al 2e-, 8e-, 3e-. ? Какие свойства (окислительные или восстановительные) проявляют атомы алюминия? ! Подобно всем металлам, атомы алюминия проявляют восстановительные свойства. ? Какую степень окисления при этом будет проявлять алюминий? (+3) ? К какому типу и классу относится элемент алюминий. р-элемент, переходный элемент, соединения которого обладают амфотерными свойствами. Металл. Алюминий занимает промежуточное положение между металлами и неметаллами. Металлические свойства у него должны быть выражены слабее, чем у натрия и магния. Наличие у него 3 электронов на внешнем уровне и несколько меньший радиус атома обуславливает уменьшение химической активности алюминия по сравнению с соответствующими элементами I и II групп. Приложение 5.1 Учащийся группы 1. (Делает записи на доске) Алюминий находится в III периоде III А группе. В состав атома входит 13 протонов, 13 электронов и 14 нейтронов. На внешнем энергетическом уровне – три свободных электрона, за счёт перехода одного s – электрона на p – энергетический подуровень. Так как у алюминия радиус атома больше, чем у бора, он отдаёт внешние электроны, проявляя при этом восстановительные свойства. Почти во всех соединениях алюминий проявляет степень окисления + 3. Приложение 6 Группа 2. Задание 2. Рассмотрите алюминий как простое вещество и докажите его физические свойства на примере выданного вам образца. Объясните, почему алюминий имеет такое широкое применение в нашей жизни? Почему из алюминия изготовляют посуду? Оборудование: алюминиевая фольга, алюминиевая проволока, спиртовка, держатель. (§ 16 стр. 57 + приложение) Основные фактыC чем ассоциируется у нас слово «алюминий»? С походной кружкой, банкой для газированных напитков, песней про «алюминиевые огурцы». А может быть, с серебристым самолетом, взмывающим в небесную синь? О чем бы мы ни подумали, трудно охватить воображением ту огромную роль, которую алюминий играет в современном мире. Чтобы осознать ее, попробуем представить себе мир без алюминия. В этом мире путь из Европы в Америку занимает многие дни, потому что приходится плыть на тяжелом неповоротливом корабле. Да и железнодорожные перевозки нельзя сделать максимально быстрыми: нет материала для производства легких вагонов. Зеркала довольно быстро мутнеют и портятся. Нет альтернативы увесистым стеклянным и плохо утилизируемым пластиковым бутылкам. Высоковольтные линии электропередач делают из тяжелой и дорогой меди… И это лишь малая доля неудобств, которыми изобиловал бы такой мир. Нет сомнений: материал, занимающий настолько важное место в нашей жизни, стоит более близкого знакомства.
Применение алюминия и его физические свойства, на которых оно основаноАлюминий называют «крылатым металлом». Такое название этот металл получил за свою легкость и широкое применение, в первую очередь, в самолетостроении. Алюминий прочно вошел в нашу жизнь: каждому с детства знакомы алюминиевая фольга, посуда, проволока. А ведь когда-то изделия из алюминия считались роскошью. Например, в 1852 году стоимость 1 кг алюминия была 1200 долларов, т.е. дороже золота. Почему же со временем цена на алюминий так упала? Дело в том, что алюминий широко распространен в земной коре (8%), самый распространенный металл. Но для восстановления алюминия из руд необходимо затратить большое количество энергии. К концу 19 века разработали новый способ получения алюминия с помощью электролиза, ежегодное получение металла возросло в тысячи раз, и цена на него упала. Алюминий очень устойчив по отношению к кислороду и воде. Эта устойчивость обусловлена образованием на его поверхности тонкой, но плотной и прочной оксидной пленки – Al2O3. Благодаря этому свойству алюминий и его сплавы нашли широкое применение в быту и промышленности. Вам хорошо известно о применении алюминия для изготовления кухонной посуды. Алюминий применяется для изготовления кухонной посуды Высокая электропроводность алюминия (по этому качеству он уступает лишь серебру и меди) позволяет широко его применять в электротехнике. Кроме того, алюминий дешевле и легче, чем медь и серебро. Но мы перечислили пока не все достоинства этого удивительно практичного металла. При 100-150°С алюминий настолько пластичен, что из него можно получить тонкую фольгу, толщиной менее 0,01 мм. Алюминиевая фольга применяется для изготовления электрических конденсаторов и изделий, защищающих от тепловой радиации. Алюминий также используют для алитирования, т.е. насыщения поверхностей стальных и чугунных изделий алюминием с целью защиты их от коррозии. Порошок алюминия используют для изготовления серебряной краски, устойчивой к атмосферным воздействиям. Сплавы алюминияАлюминий применяют для производства различных сплавов. Наибольшее распространение имеют дуралюмины, содержащие медь и магний, и силумины – сплавы алюминия с кремнием. Основные преимущества этих сплавов – легкость, высокая прочность и коррозионная стойкость. Сплавы алюминия широко используют в качестве конструкционного материала в авиастроении, а также в авто -, судо- и приборостроении, в ракетной технике и строительстве. Дюралюмины широко применяются в авиастроении. «Применение алюминия» В чистом виде алюминий используется в электротехнике. Изготовление проводов (лёгкость, электропроводность). Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, но он приблизительно в 3 раза легче, поэтому провода из алюминия с электросопротивлением, как у медных, имеют массу в 2 раза меньшую, при этом алюминий приблизительно в 2 раза дешевле. Правда, у алюминия как электротехнического материала есть неприятное свойство — из-за прочной оксидной плёнки его тяжело паять; Производство кухонной посуды, столов, стульев, алюминиевой фольги (нетоксичен, высокая теплопроводность); если вы готовите пищу в такой посуде, то должны знать, что она делится на легкую с толщиной дна 1,5мм, среднюю -2мм, тяжелую – 2,5мм и изготавливается из чистого алюминия или дюралюминия. В такой посуде нельзя хранить кислую капусту, кислое молоко блюда из картофеля. Длительное воздействие кислот и щелочей разрушает оксидную пленку на алюминии, и металл проникает в пищу. Не стоит увлекаться блюдами, запеченными в фольге, не рекомендуется хранить в ней продукты. Гораздо чаще используются сплавы алюминия, в которых сохраняются его легкость и пластичность, но значительно повышаются прочность и жаростойкость. Сплавы алюминия легко поддаются обработке, сварке, поэтому являются основными конструкционными материалами в авто -, судо -, и авиастроении, при сооружении промышленных и жилых зданий. При изготовлении различной аппаратуры и посуды. Конструкционный материал (лёгкость, податливость штамповке, коррозионная стойкость); Цистерны для перевозки азотной кислоты. Изготовления зеркал (высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления); Ювелирные изделия (когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии; Алюминий зарегистрирован в качестве пищевой добавки Е173 (группа красителей), используется для подкрашивания тортов и различных видов драже, придают кондитерским изделиям серебристый цвет. Он не безопасен, разрешен в странах ЕС. Вещество хорошо сохраняет продукты от порчи и плесени; Высокоэффективное ракетное горючее; В составе бенгальских огней (современный искристый бенгальский огонь содержит азотнокислый барий в качестве окислителя, порошок алюминия или магния как горючее, декстрин или крахмал в качестве клея, а также оксидированные железные или стальные опилки для образования искр). Краска «серебрянка» (блеск в порошке); Восстанавливает металлы (хром, никель, кобальт, ванадий, титан, марганец) из их оксидов (алюминотермия); Оксид алюминия (корунд) используется как абразивный материал для шлифовки и полировки металлов, искусственно выращенные монокристаллы рубина используются в лазерах, часовой и ювелирной промышленности. Из крупнокристаллического Аl2О3 делают опоры и подшипники в точных приборах; Хлорид алюминия AlCl3 применяют в качестве катализатора (?) в производстве очень многих органических веществ. Сульфат алюминия Al2(SO4)3 применяется для очистки воды, производства бумаги, а его кристаллогидрат Al2(SO4)3• 18 Н2О используется при протравном крашении хлопчатобумажным тканей. Алюмокалиевые квасцы КAl(SO4)2• 12 Н2О применяются Приложение 6.1 Учащийся группы 2. (Делает записи на доске) Алюминий серебристо-белый, лёгкий, пластичный металл. Имеет металлический блеск. Является легкоплавким металлом. Хотя плавится он при 6600. С, но можно долго кипятить воду в алюминиевой кастрюле, так как алюминий покрыт тугоплавкой оксидной плёнкой. Также алюминий обладает очень высокой электрической проводимостью и теплопроводностью. Приложение 7 Группа 3. Изучите химические свойства алюминия и составьте схему, отражающую общие химические свойства алюминия как металла. Объясните, почему алюминий в электрохимическом ряду напряжения металлов стоит сразу же после активных щелочных и щелочноземельных металлов? Оборудование: инструкция к выполнению лабораторного опыта (приложение 4) гранулы алюминия, растворы соляной кислоты и хлорида меди (II), штатив с пробирками. (§16 стр.58-59). Инструкция по выполнению лабораторного опыта «Химические свойства алюминия» ВНИМАНИЕ! Вспомните, как безопасно обращаться с растворами кислот. Какие меры надо предпринять при попадании капель кислоты на кожу и одежду? ОПЫТ 1: ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ С СОЛЯНОЙ КИСЛОТОЙ. Гранулу алюминия опустить в пробирку с разбавленной соляной кислотой(=5 мл). Что происходит? Написать уравнение происходящей реакции по схеме: Al + HCl → Собрать выделяющийся газ, доказать, что это водород. Сделать вывод. ВЫВОД: Алюминий реагирует с HCl, проявляя при этом … … … химические свойства. Приложение 7.1 Учащийся группы 3. Делает записи на доске, схема Аl + О2 → Аl + Н2О → Аl + растворы кислот → Аl + растворы солей → Аl + оксиды менее активных металлов Для того чтобы алюминий начал реагировать, с его поверхности нужно удалить оксидную плёнку. И тогда алюминий становится химически активным элементом. И, как металл, он довольно-таки легко реагирует с кислородом, неметаллами, водой, растворами кислот и солей. Но в концентрированных азотной и серной кислотах пассивирует, поэтому эти кислоты перевозят в алюминиевых ёмкостях. Также его широко используют в металлургии для получения металлов – хрома, марганца, ванадия, титана, циркония из их оксидов. Этот способ носит название алюминотермия. Приложение 8 Группа 4. Почему в алюминиевой посуде нельзя хранить не только кислые, но и щелочные растворы? Докажите опытным путём, что алюминий является переходным элементом. Оборудование: инструкция к выполнению лабораторного опыта алюминиевая проволока, раствор гидроксида натрия, штатив с пробиркам, спиртовка, держатель. Инструкция по выполнению лабораторного опыта «Химические свойства алюминия» ВНИМАНИЕ! Вспомните, как безопасно обращаться с растворами кислот. Какие меры надо предпринять при попадании капель кислоты на кожу и одежду? ОПЫТ 2: ВЗАИМОДЕЙСТВИЕ АЛЮМИНИЯ СО ЩЁЛОЧЬЮ. Алюминиевую проволоку опустить в раствор щёлочи объёмом = 5 мл. Для ускорения реакции раствор необходимо, … … … Что происходит? Написать уравнение происходящей реакции по схеме, расставить коэффициенты методом электронного баланса: Аl0 + KOH+1 + H2+1 O → K[Al+3(OH)4] + H20 Доказать наличие водорода. Сделать вывод из 1-2 опытов: ВЫВОД: Алюминий реагирует с HCl, проявляя при этом … … … химические свойства. Но алюминий реагирует и с KOH, проявляя … … …химические свойства. Следовательно, алюминий проявляет … … …химические свойства. Приложение 8.1 Учащийся группы 4. (Делает записи на доске). Специфическим свойством для алюминия является реакция с растворами щелочей, в которой он проявляет переходные свойства. При этом образуются соли. 1) Взаимодействие со щелочами без нагревания 2AI + 2NaOH + 6Н2О = 2NaAI(OH)4 + 3Н2 2) Взаимодействие со щелочами при сплавлении 2AI +2NaOH + 2Н2О =2NaAIО2 + 3Н2 (Демонстрация опыта обучающимся). Приложение 9 Изучите способ получения алюминия в промышленности и объясните, почему алюминий, занимающий третье место по распространённости на земле, в XIX веке стоил так дорого? (§16 + Приложение 9) «Получение алюминия» Немецкий химик Ф. Велер в 1827г. получил алюминий при нагревании хлорида алюминия со щелочными металлами калием или натрием без доступа воздуха: AlCl3 + 3K →3 KCl + Al Для промышленного получения алюминия эти методы экономически невыгодны, поэтому был разработан электрохимический метод получения алюминия из бокситов. 2 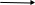 Al2O3 Na3AlF6, ток 4Al + 3O2 Al2O3 Na3AlF6, ток 4Al + 3O2Приложение 9.1 Учащийся группы 5. Алюминий можно получить разложением расплава его оксида на составные части. Так как температура плавления оксида алюминия составляет 20500С, поэтому разложить можно только с помощью электрического тока. Этот процесс называется электролизом. 1) Электролиз Эл. ток 2Al2O3 = 4Al + 3O2 Но для проведения этой реакции необходимы большие затраты энергии. Технически доступным металлом алюминий стал после того, как в 1886 году американский и французский учёные Ч. Холл и П. Эру установили, оксид алюминия хорошо растворяется в расплавленном криолите Na3AIF6 с добавками фторидов кальция и алюминия. Этот расплав и применяют в специальных установках на алюминиевых заводах. Приложение 10 Дидактические задания Уровень 1 Графический диктант(+ -) Тест с взаимопроверкой «Какие утверждения верны?» 1.Алюминий встречается в природе только в виде соединений (+) 2.Алюминий взаимодействует с концентрированной азотной кислотой (-) 3. Атомы алюминия проявляют восстановительные свойства (+) 4. Алюминий плохо проводит электричество (-) 5. Алюминий может реагировать как с кислотами, так и со щелочами (+) 6. В случае избытка алюминий может представлять серьёзную опасность для здоровья (+) 7. Ион алюминия содержит 10 электронов (+) 8. Степень окисления алюминия +3 (+) 9.Алюминотермией можно получить такие металлы как железо, хром. (+) 10. При взаимодействии алюминия с гидроксидом натрия, как и при реакции с кислотой, выделяется водород. (+) 11. Алюминий получают электролизом бокситов(+) 12. Алюминиевую кастрюлю можно чистить средством содержащим щелочь (-) Уровень 1 Графический диктант(+ -) Вопрос « Алюминий - ответ 1 Встречается в свободном виде 2 Лёгкий металл 3 Реагирует с кислотами, и со щелочами 4 Подвергается коррозии 5 Восстанавливает металлы из оксидов самопроверка Вопрос « Алюминий - ответ 1 Встречается в свободном виде + 2 Лёгкий металл + 3 Реагирует с кислотами, и со щелочами + 4 Подвергается коррозии - 5 Восстанавливает металлы из оксидов + Уровень 2 Тест 1. Степень окисления алюминия в соединениях: а) + 2 б) +3 в) - 3 г) -2 2. Укажите название вещества, из которого состоит защитная пленка на поверхности алюминия а) оксид алюминия б) гидроксид алюминия в) хлорид алюминия г) сульфид алюминия 3.Укажите число протонов в ядре атома алюминия: а) 13 б) 14 в) 27 г) 3 4. Алюминий не реагирует а) с кислородом б) с азотом в) с оксидом магния г) с раствором серной кислоты 5. Алюминий в природе по распространённости в земной коре занимает среди металлов: а) первое место б) второе мест в) пятое место г) третье место Самопроверка: 1б, 2а, 3а, 4в, 5а Уровень 3 Уровень 3 – экспериментальная задача В трёх пробирках находятся различные металлы: Al, Zn, Ag. Каким образом с помощью концентрированных растворов азотной кислоты, гидроксида калия и хлороводородной кислоты распознать, в какой пробирке находится порошок того или иного металла? Запишите уравнения соответствующих реакций. Приложение 11 1. Оцени свои знания, полученные на уроке. а) на уроке я закрепил (а) знания _____________________________________________ __________________________________________________________________________ б) Сегодня на уроке я научил (ась) ся ________________________________________ в) После сегодняшнего урока я уже не сделаю ошибку __________________________ ___________________________________________________________________________ 2. Задай один вопрос, который остался неясным в ходе изучения материала урока___________________________ Учитель: Оказывает ли алюминий влияние на здоровье человека? Приложение12 Сообщения учащихся «Биологическая и экологическая роль алюминия» «Биологическая роль алюминия» Содержание алюминия в организме человека массой 70 кг составляет 61 мг. Он находится во всех органах и тканях. Но больше всего его в печени, легких, костях и головном мозге. Алюминий принимает участие в построении эпителиальной и соединительной тканей и участвует в процессе регенерации костной ткани. Он активизирует действие пищеварительных ферментов и участвует в обмене фосфора. Алюминий поступает в организм за счет продуктов питания, в нашем рационе в сутки может содержаться до 100 мг алюминия. Из всего алюминия, поступающего в организм, с продуктами питания в ЖКТ всасывается от 2-4%, но он может поступать и через легкие. С возрастом в легких и головном мозге его становится больше, а выводится он несколькими путями с потом, выдыхаемым воздухом, мочой, калом. Алюминий практически содержится во всех продуктах питания. Но в основном источниками содержания алюминия являются продукты растительного происхождения, в них алюминия в 50-100 раз больше чем в продуктах животного происхождения. Больше всего алюминия содержится в овсянке, горохе, пшенице, рисе, картофеле, авокадо. А в хлебе его много, потому что при выпечке используется алюминиевая посуда Алюминий влияет на здоровье человека. При приготовлении пищи в такой посуде содержание алюминия в пищевых продуктах увеличивается вдвое, т.к. частички алюминия «соскребаются» со стенок кастрюли и постепенно в организм поступает немалое количество алюминия. Внимание! Опасность! Избыток алюминия приводит к нарушению минерального обмена. В больших концентрациях алюминий отрицательно действует на нервную систему и может вызвать судороги, снижение или потерю памяти, способствует развитию старческого атеросклероза, у детей замедляется развитие, поражается желудок, кишечник. В этом случае помогут крапива, хвощ полевой, препараты, содержащие янтарную кислоту. При производстве алюминия негативное влияние на окружающую среду оказывают выделяющиеся вредные газы и отходы, так как алюминий относится к токсичным элементам. Безопасность природной среды может быть обеспечена, если будут разработаны новые технологии производства алюминия, очищаться сточные воды, строго контролироваться выбросы соединений алюминия. ПЕРЕЧЕНЬ ИСПОЛЬЗУЕМЫХ НА ДАННОМ УРОКЕ ЭОР
Список используемой литературы: Чернявская А.П. Педагогическая техника в работе учителя. М.: Центр «Педагогический поиск», 2001. Дидактические игры при обучении химии / Г.И. Штремплер, Г.А.Пичугина. 2-е изд., стереотип. М.: Дрофа, 2005. Леенсон И.А. 100 вопросов и ответов по химии. Учебное пособие. М., ООО «Издательство АСТ», 2002. Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или О чём не узнаешь на уроке химии. Ярославль: Академия развития, 2000. П. Бенеш и др. 111 вопросов по химии… для всех. Кн. для учащихся. М.: Просвещение, 1994 Енякова Т.Н. Внеклассная работа по химии. М., Дрофа, 2004. Пичугина Г.В. Химия и повседневная жизнь человека. М., Дрофа, 2004. Курганский С.М. Интеллектуальные игры по химии. М.: 5 за знания, 2006. Учебник по химии 8, 9 класс О.С. Габриеляна | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
