|
|
55 урок. Урока Решение задач Вывод молекулярной формулы газообразного вещества по относительной плотности и массовым долям элементов. Сор Введение в органическую химию
Раздел:
|
9.4А Введение в органическую химию
|
ФИО педагога
|
Аксенюк В.В
|
Дата:
|
7.04
|
Класс: 9
|
Количество присутствующих:
|
Количество отсутствующих:
|
Тема урока
|
Решение задач «Вывод молекулярной формулы газообразного вещества по относительной плотности и массовым долям элементов». СОР «Введение в органическую химию»
|
Цели обучения в соответствии
с учебной программой
|
9.2.3.4 -определять молекулярную формулу газообразного вещества по относительной плотности и массовым долям элементов
|
Цели урока
|
Все учащиеся должны:
знать и определять молекулярную формулу газообразного вещества по относительной плотности и массовым долям элементов
Большинство учащихся:
смогут на основе анализа предложить способ, доказывающий другой ход определения молекулярной формулы органического соединения
Некоторые учащиеся:
смогут провести оценку результатов различных способов решения задач на вывод химической формулы органического соединения
|
Ход урока
Этап урока/ Время
|
Действия педагога
|
Действия ученика
|
Оценивание
|
Ресурсы
|
Мотивационный этап
Цель: Создание мотивации у учащихся, включение в активный познавательный процесс всех учеников 5 мин
|
Вызов. Ознакомим с алгоритмом решения задач по определению молекулярной формулы органического соединения
Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии
Задача 1. Экспериментально установлено, что элементный состав газообразного вещества следующий: массовая доля углерода 0,8571 (или 85,71%), массовая доля водорода 0,1429 (или 14,29%). Масса 1 л этого газа при нормальных условиях составляет 1,25 г. Найдите химическую формулу данного вещества.
Решение:
1) Находим отношение числа атомов элементов:
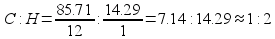
Следовательно, простейшая формула этого газа . 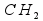
2) Находим молярную массу по простейшей формуле:
. 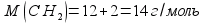
Однако отношению чисел атомов 1:2 соответствуют много формул, например и т. д.
3) Чтобы выяснить, какая из этих формул соответствует данному газу, находим молярную массу по плотности:
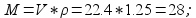
Так как близкая по численному значению молярная масса, равная 28 г, соответствует лишь формуле , то она является истинной формулой этого вещества. 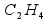
Ответ: Химическая формула исследуемого вещества (этилен).
Объявление темы урока и целей обучения.
|
Учащиеся отвечают на вопросы выходят к названию темы урока и целям урока.
|
2 балла
|
карточки
|
Операционный этап (новый материал) Цель: Создание учебной ситуации успеха и коллективного сотрудничества для достижения знания 25 мин
|
Глоссарий: (дописать термины на других языках)
На русском языке
|
На казахском языке
|
На английском языке
|
|
Органикалық заттар
|
|
углеводороды
|
|
|
|
|
carboxylic acid
|
|
Альдегид
|
|
|
|
amino acid
|
|
көмірсулар
|
|
Гомолог
|
|
|
Решение у доски:
Задача 1. При сгорании 2,3 г вещества образуется 4,4 г оксида углерода (IV) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определите молекулярную формулу данного вещества.
Задача 2. Углеводород, W, содержит 92,3% углерода по массе. Относительная молекулярная масса W составляет 78,0.
а) Вычислите эмпирическую формулу W.
b) Вычислите молекулярную формулу W
Задача 3. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 4. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6 г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Дескриптор:
− определяет молекулярную формулу газообразного вещества по относительной плотности и массовым долям элементов;
− вычисляет эмпирическую формулу;
− вычисляет молекулярную формулу.
|
Учащиеся вначале знакомятся с глоссарием, затем выполняют задания у доски
|
8 баллов
|
Карточки
|
Рефлексивный этап
Цель: Закрепление знаний, их анализ, синтез, оценка на более высоком уровне мышления 15 мин
|
Выполнение СОР «Введение в органическую химию»
|
Выполняют задания СОР
|
|
Лист СОР
|
Рефлексия
5 мин
|

|
Обобщение знаний
|
|
Гора, стикеры
| |
|
|
 Скачать 122.15 Kb.
Скачать 122.15 Kb.