Пцр и его виды. ПЦР. В начале 1970х годов норвежский учёный
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
|
Метод ПЦР. Разновидности ПЦР (метод ПЦР с обратной транскрипцией, мультиплексная ПЦР, количественная ПЦР) Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты (НК) в биологическом материале (пробе). В начале 1970-х годов норвежский учёный Хьелль Клеппе предложил способ амплификации ДНК с помощью пары коротких одноцепочечных молекул ДНК — синтетических праймеров. Однако в то время эта идея осталась нереализованной. Полимеразная цепная реакция (ПЦР) была изобретена в 1983 году американским биохимиком Кэри Муллисом[2][3]. Его целью было создание метода, который бы позволил амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента ДНК-полимеразы. Первая публикация по методу ПЦР появилась в ноябре 1985 года в журнале Science[4]. Метод революционизировал молекулярную биологию и медицину. В 1993 году Кэри Муллис получил за это Нобелевскую премию по химии[5]. В начале использования метода после каждого цикла нагревания-охлаждения приходилось добавлять в реакционную смесь ДНК-полимеразу, так как она инактивировалась при высокой температуре, необходимой для разделения цепей спирали ДНК. Процедура проведения реакции была сравнительно неэффективной, требовала много времени и фермента. В 1986 году метод полимеразной цепной реакции был существенно улучшен. Было предложено использовать ДНК-полимеразы из термофильных бактерий[6]. Эти ферменты оказались термостабильными и были способны выдерживать множество циклов реакции. Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-полимеразой. Недостаток этой полимеразы заключается в довольно высокой вероятности внесения ошибочного нуклеотида, так как у этого фермента отсутствуют механизмы исправления ошибок (3'→5'-экзонуклеазная активность). Полимеразы Pfu[en] и Pwo, выделенные из архей, таким механизмом обладают; их использование значительно уменьшает число мутаций в ДНК, но скорость их работы (процессивность) ниже, чем у Taq. Сейчас применяют смеси Taq и Pfu, чтобы добиться одновременно высокой скорости полимеризации и высокой точности копирования. Долгое время на метод был патент.Американский патент на метод ПЦР истёк в марте 2005 года.  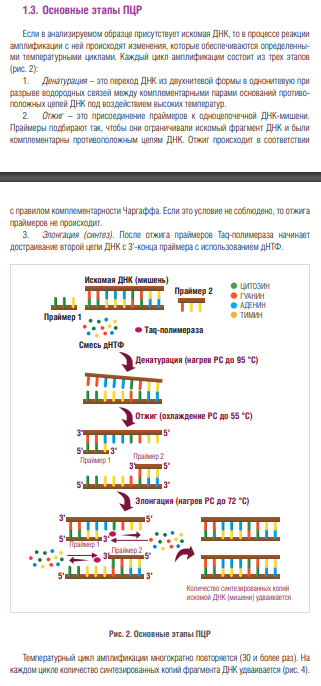    ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR) используется для идентификации известной последовательности РНК. Суть реакции – синтез двухце- 19 почечной ДНК на матрице одноцепочечной РНК. Для этого одноцепочечную молекулу РНК превращают в реакции обратной транскрипции (ОТ, англ. RT, reverse transcription) в комплементарную ДНК (кДНК) и далее амплифицируют уже ДНК-матрицу, используя традиционную ПЦР. Использование ревертазы связано с некоторыми трудностями. Прежде всего, данный фермент термолабилен и поэтому может быть использован при температуре не выше 42 °С. Так как при такой температуре молекулы РНК легко образуют вторичные структуры, то эффективность реакции заметно снижается и по разным оценкам приблизительно равна 5 %. Этот недостаток может быть устранен при использовании в качестве обратной транскриптазы термостабильной полимеразы, проявляющей активность в присутствии ионов Мn2+. Это единственный известный фермент, способный проявлять как полимеразную, так и транскриптазную активность. Стандартная ПЦР Смесь дНТФ ЦИТОЗИН ГУАНИН АДЕНИН ТИМИН УРАЦИЛ (замещает в РНК тимин) 3' 3' 3' 3' Нагревание РС > 70 °С Остановка синтеза кДНК Искомая РНК (мишень) кДНК 5' 5' 5' 5' Синтез первой цепи кДНК (нагрев РС до 40 °С) Т Т Т Т Т Т А А А А А А Ревертаза А А А А А А Случайный декануклеотидный праймер Т Т Т Т Т Т 20 ОТ-ПЦР широко используется для выявления вирусов, геном которых представлен РНК (ВИЧ, гепатит С, вирусы гриппа и другие), для диагностики генетических заболеваний и полуколичественного определения специфических молекул РНК в клетке или ткани как индикатор экспрессии соответствующих генов. ► Мультиплексная (мультипраймерная) ПЦР – одновременная амплификация двух и более искомых последовательностей ДНК в одной пробирке. Каждая пара праймеров для мультиплексной ПЦР должна обладать строгой специфичностью по отношению к соответствующей искомой мишени, а условия циклирования должны обеспечивать равноэффективный отжиг всех участвующих в реакции пар праймеров, чтобы выход амплифицируемых продуктов был по возможности одинаковым. Преимуществом данного метода является возможность проведения скрининговых исследований с минимальными затратами на расходные материалы. Кроме того, из одного образца можно получить максимум информации в рамках одной постановки ПЦР. Тем не менее мультиплексная ПЦР существенно ограничивает возможности при идентификации низкокопийных образцов: если набор реагентов позволяет выявить четыре искомые мишени + внутренний контроль и все четыре мишени присутствуют в исследуемом образце, то в случае преобладающего количества ДНК одной или двух мишеней основной объем компонентов РС будет расходоваться именно на них (конкуренция за компоненты РС). В случае сомнительных результатов мультиплексной ПЦР рекомендуется провести анализ образца с использованием наборов реагентов, предназначенных для выявления одной конкретной мишени. Важно, чтобы мультиплексный и моноплексные наборы реагентов, используемые для проверки сомнительных результатов, были одного производителя. ПЦР в реальном времени (или количественная ПЦР, англ. Real-time PCR, qPCR, qRT-PCR) — метод, основанный на методе полимеразной цепной реакции, используется для одновременной амплификации и измерения количества данной молекулы ДНК. Метод ПЦР в реальном времени включает в себя одновременно детекцию и количественное определение (измерение непосредственно количества копий, либо измерение копий относительно внесенной ДНК или дополнительных калибровочных генов) специфической последовательности ДНК в образце. Метод использует общие принципы ПЦР. Основное отличие состоит в том, что измеряется количество амплифицированной ДНК в реальном времени после каждого цикла амплификации. Для количественного определения используют два метода — флюоресцентные красители, интеркалирующие в двуцепочечные молекулы ДНК, и модифицированные олигонуклеотиды (ДНК-зонды), которые флюоресцируют после гибридизации с комплементарными участками ДНК. Часто ПЦР в реальном времени комбинируют с ОТ-ПЦР (обратная транскрипция) для измерения малых количеств мРНК, что позволяет исследователю получать количественную информацию о содержании данной мРНК в клетке и, соответственно, позволяет судить об уровне экспрессии данного гена в отдельной клетке или ткани. Количественная ПЦР (quantitativePCR, Q-PCR), или ПЦР в реальном времени (real-timepolymerasechainreaction), — используется для непосредственного наблюдения за измерением количества конкретного ПЦР продукта в каждом цикле реакции. В этом методе используют флуоресцентно меченые ДНК-зонды для анализа накопления продукта реакции или интеркалирующий краситель SYBR Green (или его аналоги). Sybr Green I[en] обеспечивает простой и экономичный вариант для детекции и количественного определения ПЦР-продуктов в ходе ПЦР в режиме реального времени без необходимости использования специфичных флуоресцентных зондов или праймеров. В ходе амплификации краситель SYBR Green I встраивается в малую бороздку ДНК продуктов ПЦР и испускает более сильный по сравнению с несвязанным красителем флуоресцентный сигнал при облучении синим лазером. SYBR Green I совместим со всеми известными на сегодняшний день приборами для проведения ПЦР в режиме реального времени. Максимум поглощения для SYBR Green I находится при длине волны 494 нм. Кроме главного, в спектре красителя имеются два небольших дополнительных максимума поглощения — при 290 нм и 380 нм. Максимум испускания для SYBR Green I находится при длине волны 521 нм (зелёный)[21]. ПЦР используется во многих областях для проведения анализов и в научных экспериментах. Криминалистика[править | править код] ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью электрофореза ДНК. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (geneticfingerprint). Установление отцовства[править | править код] Хотя «генетические отпечатки пальцев» уникальны, родственные связи всё же можно установить, сделав несколько таких отпечатков.[≡] Тот же метод можно применить, слегка модифицировав его, для установления эволюционного родства среди организмов. Медицинская диагностика[править | править код] ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы (в зависимости от величины инкубационного периода) до того, как проявятся симптомы заболевания. Персонализированная медицина[править | править код] Иногда лекарства оказываются токсичными или аллергенными для некоторых пациентов. Причины этого — отчасти в индивидуальных различиях в восприимчивости и метаболизме лекарств и их производных. Эти различия детерминируются на генетическом уровне. Например, у одного пациента определённый цитохром (белок печени, отвечающий за метаболизм чужеродных веществ) может быть более активен, у другого — менее активен. Для того, чтобы определить, какой разновидностью цитохрома обладает данный пациент, предложено проводить ПЦР-анализ перед применением лекарства.[источник не указан 4517 дней] Такой анализ называют предварительным генотипированием (prospectivegenotyping). Клонирование генов[править | править код] Основная статья: Клонирование ДНК Клонирование генов (не путать с клонированием организмов) — это процесс выделения генов и, в результате генноинженерных манипуляций, получения большого количества продукта данного гена. ПЦР используется для того, чтобы амплифицировать ген, который затем вставляется в вектор — фрагмент ДНК, переносящий чужеродный ген в тот же самый или другой, удобный для выращивания, организм. В качестве векторов используют, например, плазмиды или вирусную ДНК. Вставку генов в чужеродный организм обычно используют для получения продукта этого гена — РНК или, чаще всего, белка. Таким образом в промышленных количествах получают многие белки для использования в сельском хозяйстве, медицине и др. 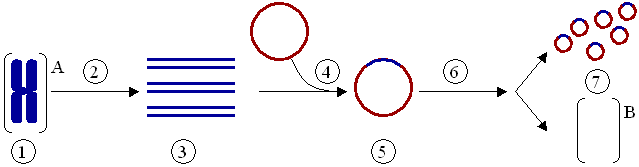 Клонирование гена с использованием плазмиды. (1) Хромосомная ДНК организма A. (2) ПЦР. (3) Множество копий гена организма А. (4) Вставка гена в плазмиду. (5) Плазмида с геном организма А. (6) Введение плазмиды в организм В. (7) Умножение количества копий гена организма А в организме В Секвенирование ДНК[править | править код] Основная статья: Секвенирование В методе секвенирования с использованием меченных флуоресцентной меткой или радиоактивным изотопом дидезоксинуклеотидов ПЦР является неотъемлемой частью, так как именно в ходе полимеризации в цепь ДНК встраиваются производные нуклеотидов, меченные флуоресцентной или радиоактивной меткой. Присоединение дидезоксинуклеотида к синтезируемой цепи приводит к обрыву синтеза, позволяя определить положение специфических нуклеотидов после разделения в геле. Мутагенез[править | править код] Основная статья: Мутагенез В настоящее время ПЦР стала основным методом проведения мутагенеза (внесения изменений в нуклеотидную последовательность ДНК). Использование ПЦР позволило упростить и ускорить процедуру проведения мутагенеза, а также сделать её более надёжной и воспроизводимой. Молекулярное сексирование[править | править код] Ещё одной областью практического применения ПЦР является молекулярное сексирование[en] — определение пола на основе половых различий на уровне ДНК между представителями мужского и женского полов[22]. |
