Коллоквиум по липидам. коллок по липидам (1). Важнейшие липиды тканей человека. Классификация липидов. Характеристика отдельных групп
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
Внемитохондриальная система биосинтеза de novo жирных кислот (ли-погенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3– (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и β-окисления жирных кислот значительно различаются. Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы. ₽Жироудалители Unicumunicumworld.ru Полезные товары на iHerb!Выбирайте качественные органические товары. Низкие цены. Прямая доставка из США!Акции и скидкиНовинкиБестселлерыПробные товарыru.iherb.com Кухни −50% от фабрики «Вместе Уютно»vmeste-uytno.ru В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбокси-латтранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл: 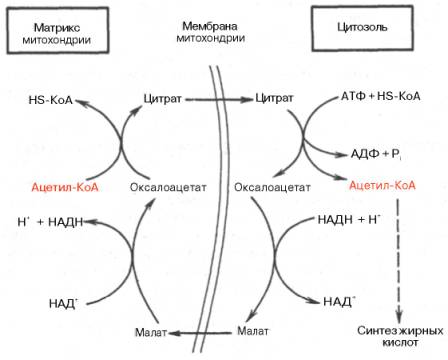 Существует еще один путь переноса внутримитохондриального аце-тил-КоА в цитозоль клетки – с участием карнитина. Как отмечалось, кар-нитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным. Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-карбоксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом. Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный ал-лостерический центр, т.е. представляет собой полиферментный комплекс. Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА: 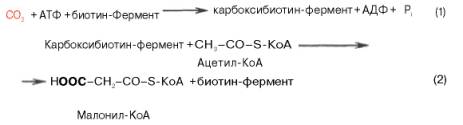 Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты. Энзиматические системы, осуществляющие синтез жирных кислот, называются жирно-кислотными синтетазами. Они широко встречаются в природе и могут быть изолированы из различных одноклеточных организмов, растений и животных тканей. Жирно-кислотные синтетазы делятся на 2 группы. К первой группе относятся полиэнзимные, не поддающиеся фракционированию комплексы с мол. м. порядка 500000, в которых все индивидуальные энзимы собраны в компактную структуру. В частности, в эту группу входят жирно-кислотные синтетазы животных тканей и дрожжей. Вторая группа включает жирно-кислотные синтетазы, из которых отдельные энзимы могут быть выделены методами белкового фракционирования. Такие синтетазы встречаются у ряда микроорганизмов (в частности, у E.coli) и растений. Иными словами, в этих случаях все индивидуальные ферменты синтетазной системы находятся в виде автономных полипептидов. Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот: 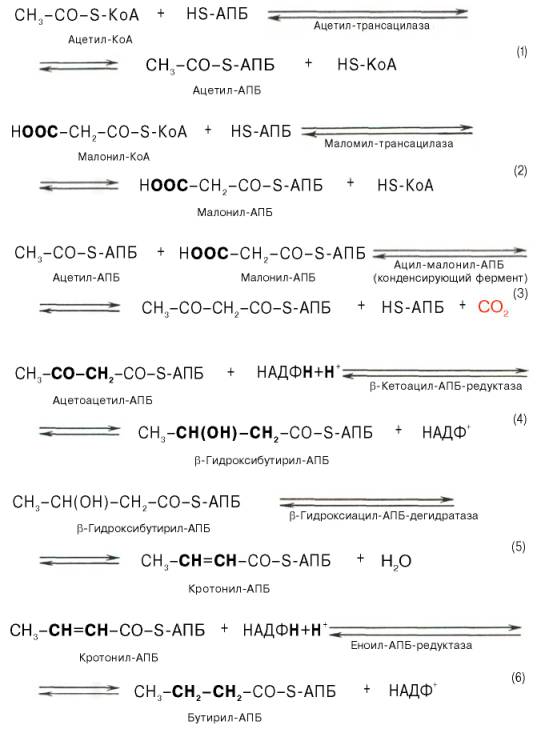 Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Например, образовавшийся в первом цикле бутирил-АПБ взаимодействует с малонил-АПБ: 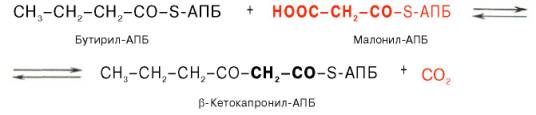 Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:  Суммарное уравнение синтеза пальмитиновой кислоты можно записать так: 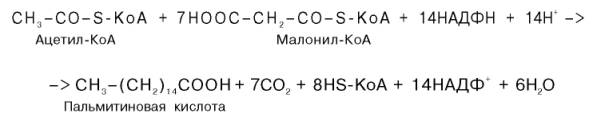 Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется, суммарное уравнение можно представить в следующем виде: 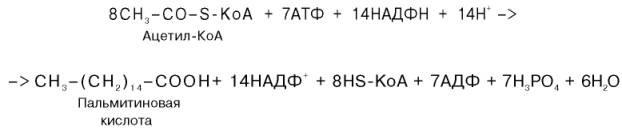 Основные этапы биосинтеза жирных кислот можно представить в виде схемы: 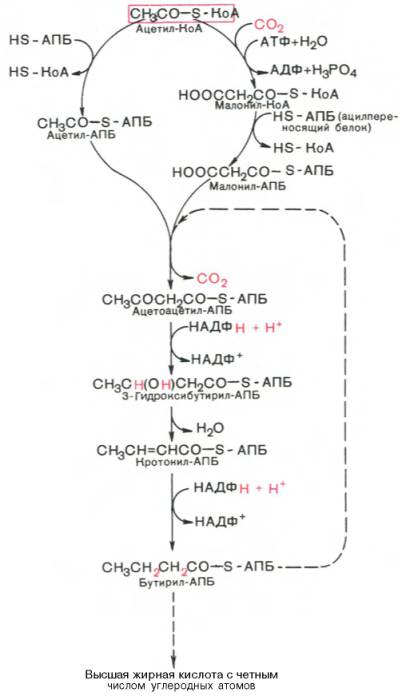 В общем виде синтез жирных кислот у кишечной палочки представлен на рис. 11.4. Последовательность и характер реакций в синтезе жирных кислот, начиная с образования β-кетоацил-АПБ (на рис. 11.4 – ацетоацетил-АПБ) и кончая завершением одного цикла удлинения цепи на два углеродных атома, являются как бы обратными реакциями окисления жирных кислот. На самом деле пути синтеза и окисления жирных кислот не пересекаются даже частично. Это становится очевидным, если принять во внимание некоторые особенности синтеза и окисления жирных кислот. 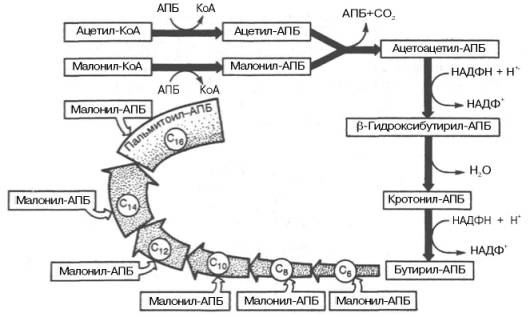 Рис. 11.4. Синтез пальмитиновой кислоты у кишечной палочки при участии одной молекулы ацетил-КоА и 7 молекул малонил-КоА. Подробно представлен первый цикл синтеза - образование бутирил-АПБ. Остальные 6 циклов аналогичны первому. По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пен-тозофосфатного цикла, частично – в других реакциях, в частности в реакциях: Малат + НАДФ+-> Пируват + С02 + НАДФН + Н+ Изоцитрат + НАДФ+-> α-Кетоглутарат + С02 + НАДФН + Н +. Образование ненасыщенных жирных кислот. Элонгация жирных кислот. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные. Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название деса-тураз. Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации. 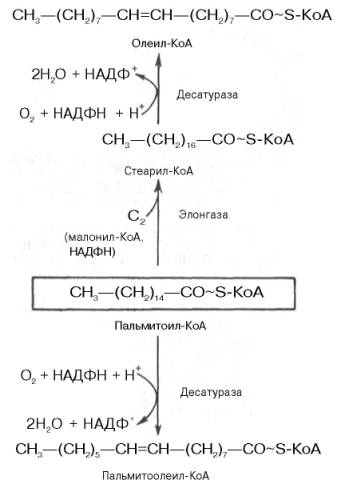 9. Строение пальмитатсинтетазы. Образование малонил-КоА и его роль в процессе синтеза жирных кислот. 10. Синтез насыщенных жирных кислот. Стадии синтеза жирных кислот. Роль пентозофосфатного пути как донора НАДФН2. Путь синтеза жирных кислот длиннее, чем их окисление Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль: может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении, обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент). 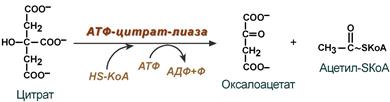 Образование ацетил-SКоА из лимонной кислоты 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов. 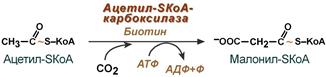 Образование малонил-SКоА из ацетил-SКоА 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН. 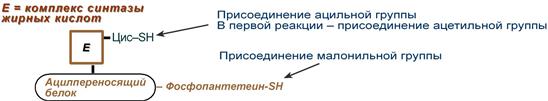 Активные группы синтазы жирных кислот В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой. 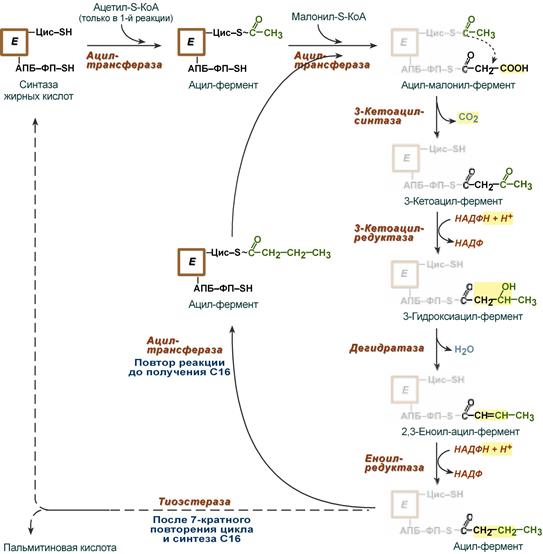 Реакции синтеза жирных кислот Удлинение цепи жирных кислот Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников. Например, арахидоновая кислота может образоваться в клетке только при наличии линоленовой или линолевой кислот. При этом линолевая кислота (18:2) дегидрируется до γ-линоленовой (18:3) и удлиняется до эйкозотриеновой кислоты (20:3), последняя далее вновь дегидрируется до арахидоновой кислоты (20:4). Так формируются жирные кислоты ω6-ряда Для образования жирных кислот ω3-ряда, например, тимнодоновой (20:5), необходимо наличие α-линоленовой кислоты (18:3), которая дегидрируется (18:4), удлиняется (20:4) и опять дегидрируется (20:5). 11. Классификация и характеристика липопротеинов сыворотки крови по плотности и способности к электрофорезу. 12. Образование и метаболизм ЛПОНП и ЛПНП. Роль ЛПВП и липопротеинлипазы в метаболизме ЛПОНП. 13. Липопротеины плазмы крови, строение и функции отдельных фракций. Атерогенные и антиатерогенные фракции липопротеинов. Плазменные липопротеины (ЛП) – это сложные комплексные соединения, имеющие характерное строение: внутри липопротеиновой частицы находится жировая капля (ядро), содержащая неполярные липиды (три-глицериды, эстерифицированный холестерин); жировая капля окружена оболочкой, в состав которой входят фосфолипиды, белок и свободный холестерин. Толщина наружной оболочки липопротеиновой частицы (ЛП-частица) составляет 2,1–2,2 нм, что соответствует половине толщины ли-пидного бислоя клеточных мембран. Это позволило сделать заключение, что в плазменных липопротеинах наружная оболочка в отличие от клеточных мембран содержит липидный монослой. Фосфолипиды, а также неэсте-рифицированный холестерин (НЭХС) расположены в наружной оболочке таким образом, что полярные группы фиксированы наружу, а гидрофобные жирно-кислотные «хвосты» – внутрь частицы, причем какая-то часть этих «хвостов» даже погружена в липидное ядро. По всей вероятности, наружная оболочка липопротеинов представляет собой не гомогенный слой, а мозаичную поверхность с выступающими участками белка. Существует много различных схем строения ЛП-частицы. Предполагают, что входящие в ее состав белки занимают только часть наружной оболочки. Допускается, что часть белковой молекулы погружена в ЛП-частицу глубже, чем толщина ее наружной оболочки (рис. 17.4). Итак, плазменные ЛП представляют собой сложные надмолекулярные комплексы, в которых химические связи между компонентами комплекса носят нековалентный характер. Поэтому применительно к ним вместо слова «молекула» употребляют выражение «частица». 14. ЛПВП. Особенности строения и их роль в обмене холестерола. Фермент лецитин-холестерин-ацилтрансфераза (ЛХАТ), его роль. Липопротеины высокой плотности Общая характеристика образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника, в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 25% ФЛ, 7% ТАГ, 13% эфиров ХС, 5% свободного ХС), основным апобелком является апо А1, содержат апоЕ и апоСII. Функция Транспорт свободного ХС от тканей к печени. Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов. Метаболизм 1. Синтезированный в печени ЛПВП (насцентный или первичный) содержит в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в нем по мере метаболизма в плазме крови. 2-3. В плазме крови насцентный ЛПВП сначала превращается в ЛПВП3 (условно его можно назвать "зрелый"). В этом превращении главным является то, что ЛПВП забирает от клеточных мембран свободный холестерин при непосредственном контакте или при участии специфических транспортных белков, взаимодействуя с мембранами клеток, отдает им часть фосфолипидов из своей оболочки, доставляя таким образом полиеновые жирные кислоты в клетки, тесно взаимодействует с ЛПНП и ЛПОНП, получая от них свободный холестерин. В обмен ЛПВП3 отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина (ФХ) на холестерин (ЛХАТ-реакция, см п.4). 4. Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от фосфатидилхолина (из оболочки самого ЛПВП) на получаемый свободный холестерин с образованием лизофосфатидилхолина (лизоФХ) и эфиров ХС. ЛизоФХ остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.  Реакция этерификации холестерола при участии лецитин:холестерол-ацилтрансферазы 5. В результате первичный ЛПВП постепенно, через зрелую форму ЛПВП3, преобразуется в ЛПВП2 (остаточный, ремнантный). При этом происходят и дополнительные события: взаимодействуя с разными формами ЛПОНП и ХМ, ЛПВП получают ацил-глицеролы (МАГ, ДАГ, ТАГ), и обмениваются холестерином и его эфирами, |
