Коллоквиум по липидам. коллок по липидам (1). Важнейшие липиды тканей человека. Классификация липидов. Характеристика отдельных групп
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
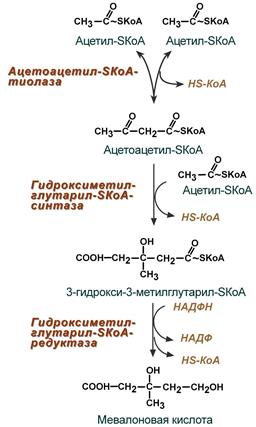
Липидный обмен Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды – холестерол и триацилглицеролы. Поскольку запасать ТАГ печень не может, то их удаление происходит при помощи липопротеинов очень низкой плотности (ЛПОНП). Холестерол используется, в первую очередь, для синтеза желчных кислот, также он включается в состав липопротеинов низкой плотности (ЛПНП) и ЛПОНП. При определенных условиях – голодание, длительная мышечная нагрузка, сахарный диабет I типа, богатая жирами диета – в печени активируется синтез кетоновых тел, используемых большинством тканей как альтернативный источник энергии. 22. Депонирование и мобилизация липидов в жировой ткани. Гормональная регуляция липолиза: роль гормончувствительной липазы, инсулина, глюкагона и адреналина. 23. Синтез ацетоновых тел (кетогенез). Избыточное образование ацетоновых тел. Роль дефицита углеводов в этом процессе. Кетонемия и кетонурия. Синтез кетоновых тел (кетогенез) Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой. 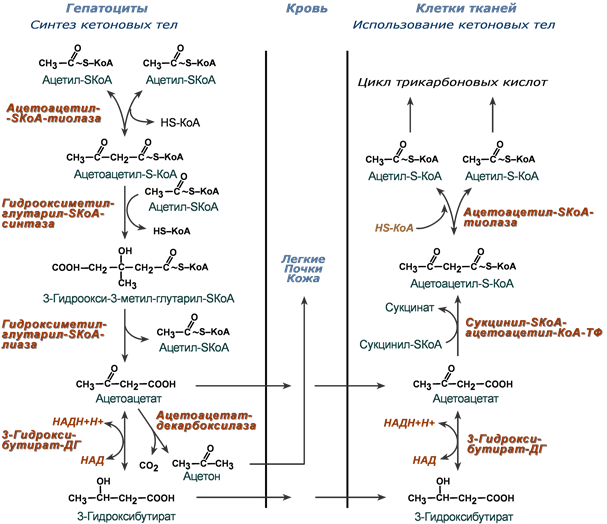 Реакции синтеза и утилизации кетоновых тел Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК. При голодании синтез кетоновых тел ускоряется в 60 раз (повышение до 0,6 г/л при норме менее 0,01 г/л), при сахарном диабете I типа – в 400 (!) раз (до 4 г/л). При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел. При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП. Кетонемия Кетонемия - повышенное содержание в крови кетоновых тел. Возникает такое состояние при тяжёлой форме сахарного диабета или голодании. При голодании в крови падает концентрация глюкозы, а при диабете глюкоза не поступает в клетку с необходимой скоростью. 24. Утилизация кетоновых тел в периферических тканях. Пути активации ацетоуксусной кислоты, энергетический эффект ее полного окисления в тканях. 25. Синтез холестерола в организме, регуляция процесса. Холестерол как источник образования биологически активных соединений. Синтез холестерола должен быть согласован с его выведением Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут. Единственным реальным способом выведения холестерола является желчь – до 1 г/сут. Биосинтез холестерола Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН. Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов. 1. Синтез мевалоновой кислоты. Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
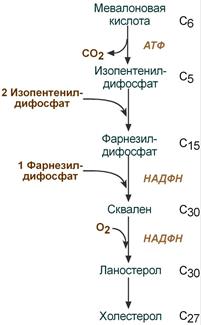
2. Синтез изопентенилдифосфата. На этом этапе три остатка фосфат присоединяются к мевалоновой кислоте, затем она декарбоксилируется и дегидрируется. 3. После объединения трех молекул изопентенилдифосфата синтезируется фарнезилдифосфат. 4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата. 5. После сложных реакций линейный сквален циклизуется в ланостерол. 6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола. Регуляция синтеза Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз. 1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным. 2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента. 3. Ковалентная модификация при гормональной регуляции: Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние. Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина. Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму. 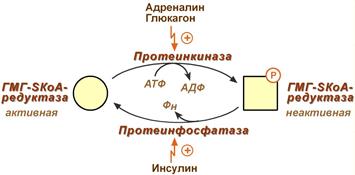 Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность). Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки - факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина. Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза. 26. Роль ацетил-КоА в липидном обмене (схема). 27. Пути использования глицерола. Глицерол как субстрат окисления: привести схему окисления до СО2 и воды. Энергетический эффект полного окисления глицерола в тканях. 28. Фосфатидная кислота как общий предшественник для синтеза нейтральных жиров и глицерофосфолипидов. Липотропные вещества, предупреждающие жировое перерождение печени. 29. Распад глицерофосфолипидов. Характеристика ферментов. Роль фосфолипазы С в образовании трифосфоинозитола и диацилглицерола. Значение фосфолипазы А2 в образовании про стагландинов. Применение лекарственных препаратов, подавляющих синтез эйкозаноидов Синтез фосфолипидов Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина. 1 путь – "спасательный" Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях. 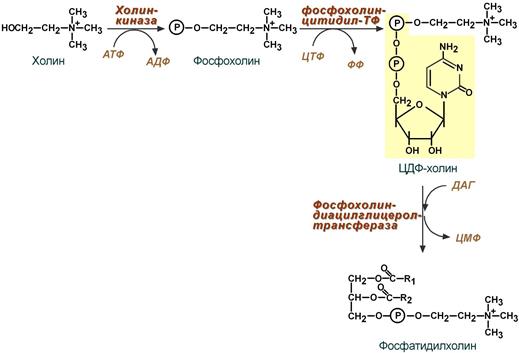 Реакции синтеза фосфолипидов с использованием 1,2-ДАГ на примере фосфатидилхолина 2 путь – основной, синтез de novo Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида. Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин. 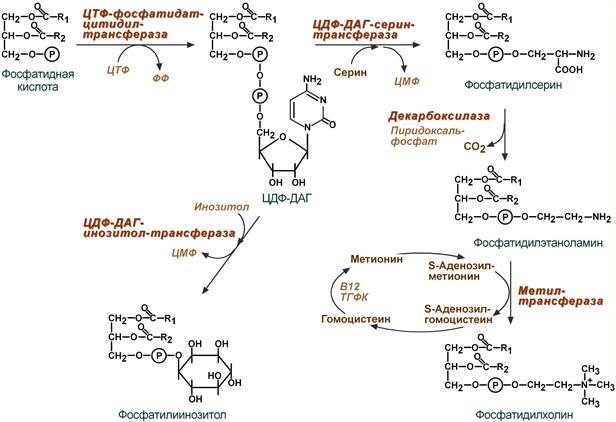 Реакции синтеза фосфолипидов с использованием фосфатидной кислоты 3 путь – обратное превращение Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина. Липотропные вещества Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся: 1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин. 2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина. 3. Витамины: пиридоксин (В6), способствующий образованию ФЭА из ФС. цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина. . К эйкозаноидам (είκοσι, греч.-двадцать) относят окисленные производные эйкозановых кислот: эйкозотриеновой (С20:3), арахидоновой (С20:4), тимнодоновой (С20:5) жирных кислот. Активность эйкозаноидов значительно разнится от числа двойных связей в молекуле, которое зависит от строения исходной жирной кислоты. Выделяют три основные группы эйкозаноидов: простагландины, лейкотриены, тромбоксаны. Простагландины (Pg) – синтезируются практически во всех клетках, кроме эритроцитов и лимфоцитов. Выделяют типы простагландинов A, B, C, D, E, F. Функции простагландинов сводятся к изменению тонуса гладких мышц бронхов, мочеполовой и сосудистой системы, желудочно-кишечного тракта, при этом направленность изменений различна в зависимости от типа простагландинов, типа клетки и условий. Они также влияют на температуру тела. Простациклины являются подвидом простагландинов (Pg I), вызывают дилатацию мелких сосудов, но еще обладают особой функцией – ингибируют агрегацию тромбоцитов. Их активность возрастает при увеличении числа двойных связей в исходных жирных кислотах. Синтезируются в эндотелии сосудов миокарда, матки, слизистой желудка. Тромбоксаны (Tx) образуются в тромбоцитах, стимулируют их агрегацию и вызывают сужение сосудов. Их активность снижается при увеличении числа двойных связей в исходных жирных кислотах. В организме суммарный эффект простациклинов и тромбоксанов на тромбообразование и артериальное давление складывается. При недостатке полиненасыщенных жирных кислот в пище возникает крен в сторону преобладающей активности тромбоксанов, что ведет к повышению вязкости крови, образованию тромбов и спазму мелких сосудов, в целом - к нарушению периферического кровообращения. Поступление в клетки ω3-жирных кислот противостоит этим патологическим сдвигам. Лейкотриены (Lt) синтезируются в лейкоцитах, в клетках легких, селезенки, мозга, сердца. Выделяют 6 типов лейкотриенов A, B, C, D, E, F. В лейкоцитах они стимулируют подвижность, хемотаксис и миграцию клеток в очаг воспаления, в целом они активируют реакции воспаления, предотвращая его хронизацию. Также вызывают сокращение мускулатуры бронхов (в дозах в 100-1000 раз меньших, чем гистамин). Депонироваться эйкозаноиды не могут, разрушаются в течение нескольких секунд, и поэтому клетка должна синтезировать их постоянно из поступающих жирных кислот ω6- и ω3-ряда. Лекарственная регуляция синтеза Гормоны коры надпочечников глюкокортикоиды опосредованно через синтез специфических белков, подавляют активность фосфолипазы А2 и, следовательно, образование всех типов эйкозаноидов. На этом основано широкое использование препаратов кортизола (преднизолон, дексаметазон) для лечения воспалительных, аутоиммунных и аллергических состояний. Нестероидные противовоспалительные средства (аспирин, индометацин, ибупрофен) ингибируют циклооксигеназу и снижают выработку простагландинов и тромбоксанов. Они нашли применение как жаропонижающее средство и в кардиологии. Блокирование циклооксигеназы в почках, как побочный эффект салицилатов, вызывает уменьшение синтеза простагландинов в почечных сосудах и снижение кровообращения в почках. В зависимости от исходной жирной кислоты все эйкозаноиды делят на три группы: Первая группа – синтезируется из эйкозотриеновой кислоты (С20:3), которая образуется из линоленовой (С18:3). В соответствии с количеством двойных связей простагландинам и тромбоксанам присваивается индекс 1, лейкотриенам – индекс 3: например, Pg E1, Pg I1, Tx A1, Lt A3. Интересно, что PgE1 ингибирует аденилатциклазу в жировой ткани и препятствует липолизу, также он участвует в патогенезе бронхоспазма. Вторая группа синтезируется из арахидоновой кислоты (С20:4). По тому же правилу ей присваивается индекс 2 или 4, например, Pg E2, Pg I2, Tx A2, Lt A4. Третья группа эйкозаноидов происходит из тимнодоновой кислоты (С20:5). По числу двойных связей присваиваются индексы 3 или 5: например, Pg E3, Pg I3, Tx A3, Lt A5. Подразделение эйкозаноидов на группы имеет клиническое значение. Особенно ярко это проявляется на примере простациклинов и тромбоксанов:
Результирующим эффектом пищевого приема или фармакологического применения более полиненасыщенных жирных кислот является образование тромбоксанов и простациклинов с большим числом двойных связей, что изменяет реологические свойства крови и снижает ее вязкость, понижает тромбообразование, расширяет мелкие сосуды и улучшает кровоснабжение тканей, снижает повышенное артериальное давление. Все эти эффекты ценны при нарушениях кровообращения, при атеросклерозе, у кардиологических больных. |