Вариант 9.
Теплота сгорания метана равна – 890 кДж/моль. Вычислите теплоту его образования.
Вычислите  реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: 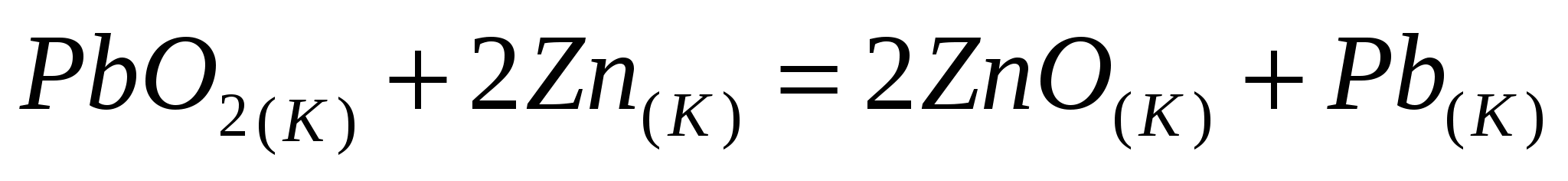 . .
Вычислите γ реакции, если константа скорости ее при 120°С равна 6,7•10-2.
Константа равновесия гомогенной системы  при некоторой температуре равна 0,2. Равновесные концентрации водорода и аммиака соответственно равны 0,4 и 0,15 при некоторой температуре равна 0,2. Равновесные концентрации водорода и аммиака соответственно равны 0,4 и 0,15 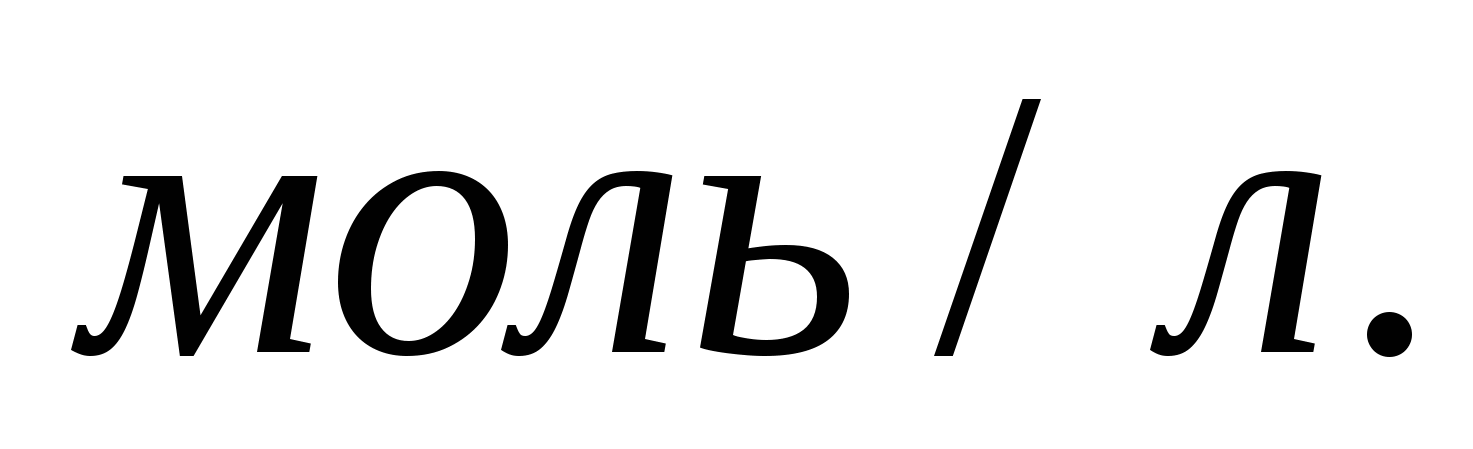 Вычислите исходную и равновесную концентрации азота. Вычислите исходную и равновесную концентрации азота.
Сколько граммов растворенного вещества и сколько граммов воды содержится в 350г 9%-ного раствора 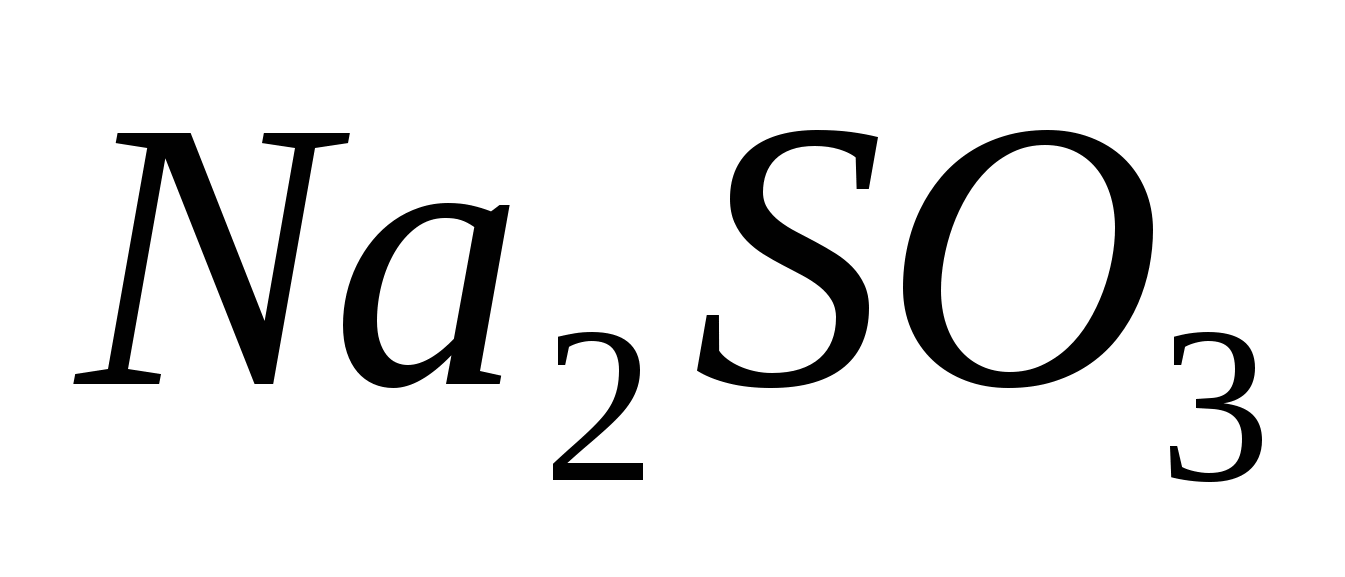 ? ?
Составьте молекулярные уравнения реакций, представленных следующими ионными уравнениями: 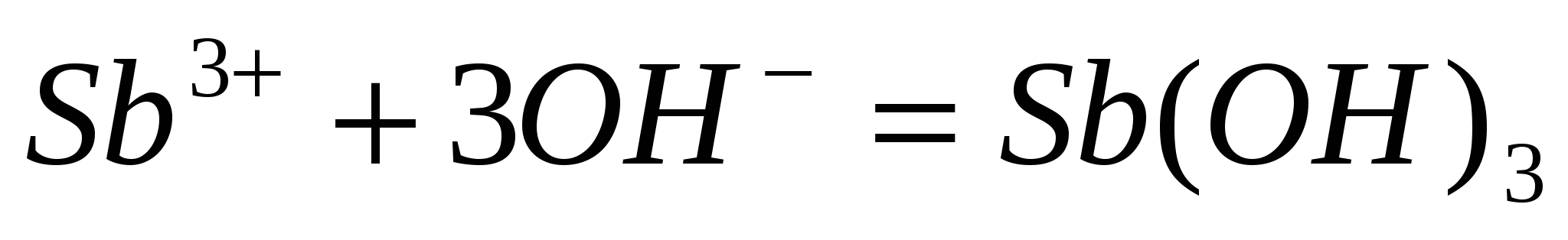 ; ; 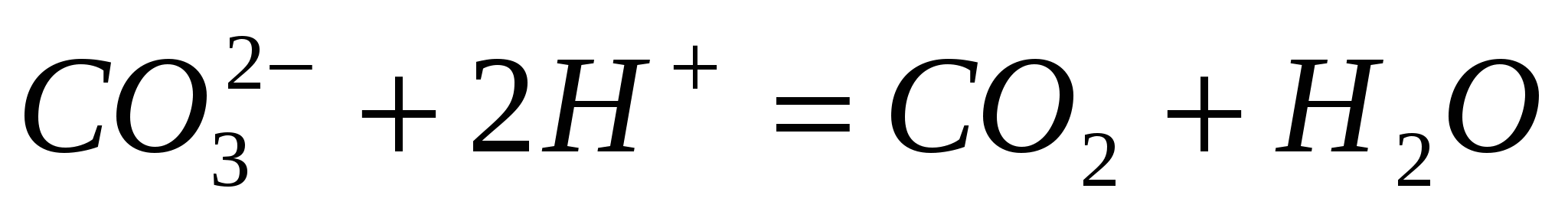 . .
Вычислите массовую долю сахара 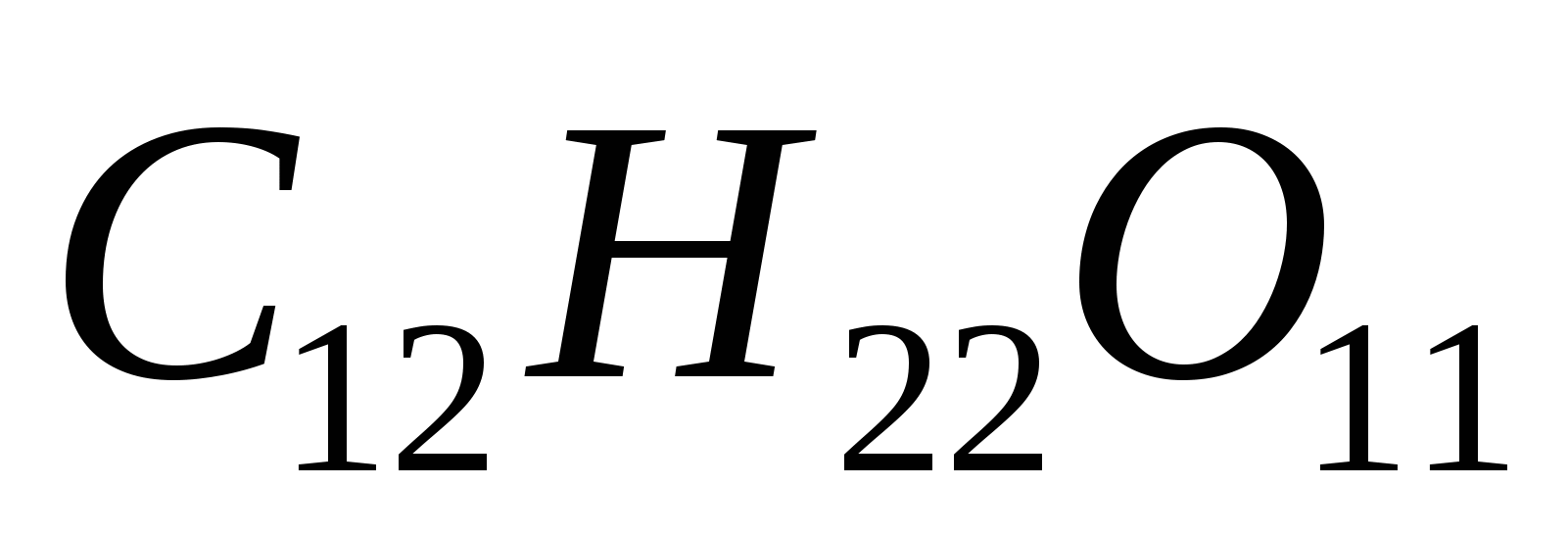 в растворе, температура кипения которого 100,24ºС. Эбуллиоскопическая константа воды равна 0,52 0. в растворе, температура кипения которого 100,24ºС. Эбуллиоскопическая константа воды равна 0,52 0.
Составьте уравнения электролитической диссоциации для электролитов: серной кислоты, ортомышьяковой кислоты, азотистой кислоты, кремнистой кислоты. Запишите выражения для констант диссоциации слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:  и и 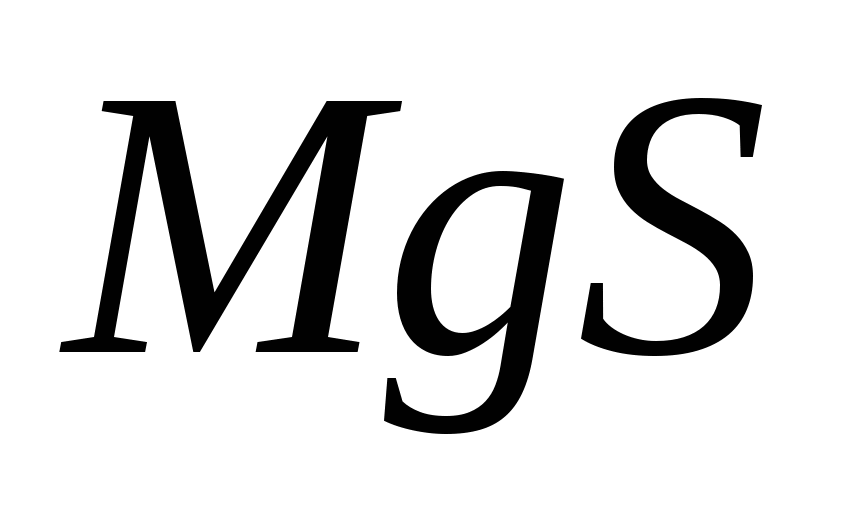 . Укажите рН среды. . Укажите рН среды.
Вариант 10.
Сколько теплоты выделится при сжигании 45 г сероуглерода?
Реакция горения сероуглерода идет по уравнению: 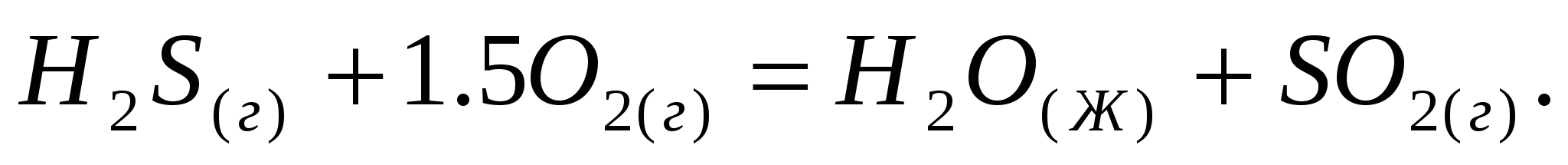 Вычислите Вычислите  , объясните уменьшение энтропии в результате этой реакции. , объясните уменьшение энтропии в результате этой реакции.
Реакция между веществами А и В выражается уравнением А + 2В =С. Начальные концентрации соответственно равны 0,3 и 0,5 моль/л. Константа скорости равна 0,4 л2/(моль2 ·с). Вычислите скорость реакции в начальный момент и в тот момент, когда концентрация вещества А уменьшилась на 0,1 моль/л.
Константа равновесия системы при постоянной температуре  равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: равна 1. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: 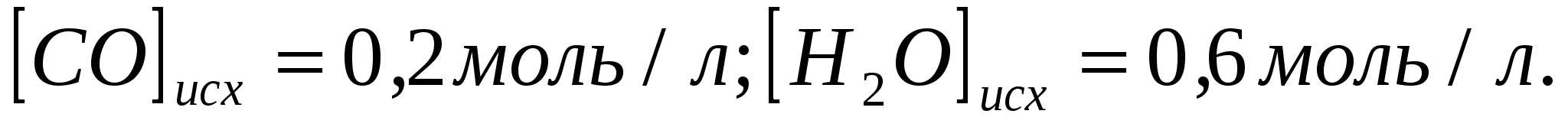
Вычислите массовую долю растворенных веществ в растворах, содержащих: а) 75 г  в 350 г воды; б) 40 г в 350 г воды; б) 40 г 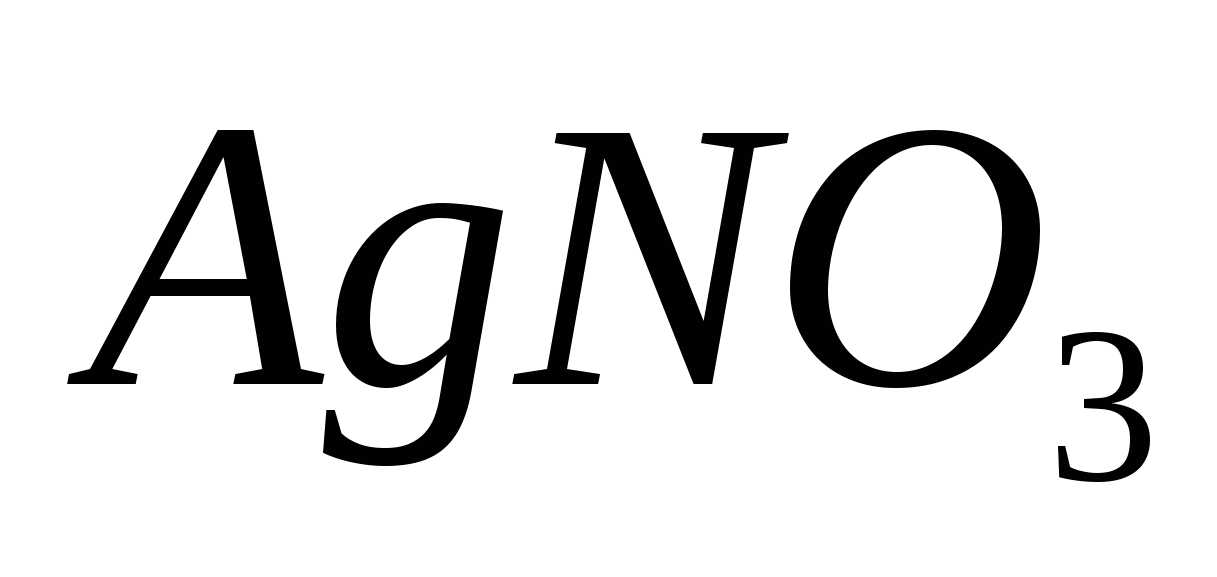 в 600 г воды. в 600 г воды.
Напишите ионно-молекулярные уравнения реакций:
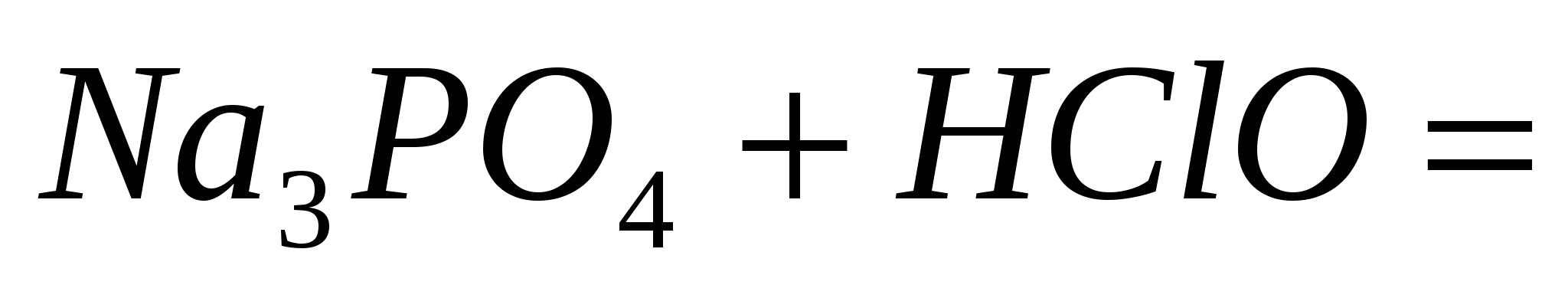 ; ; 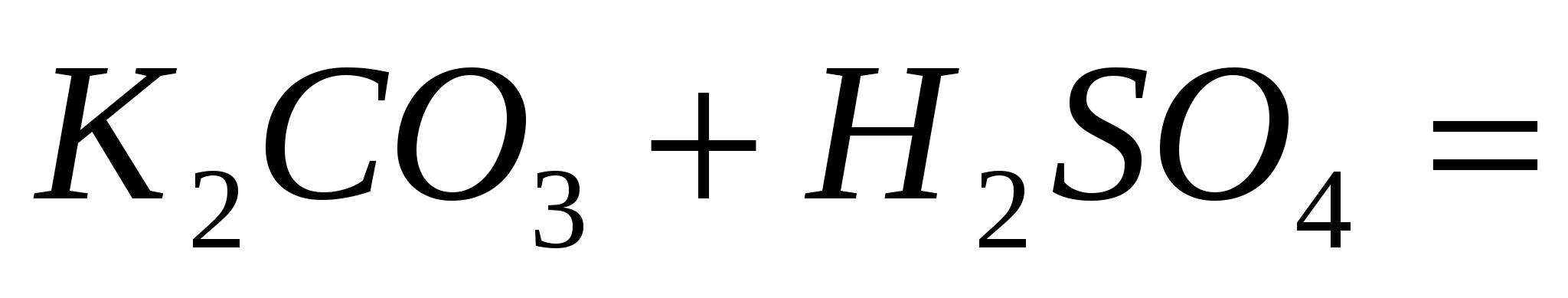 ; ; 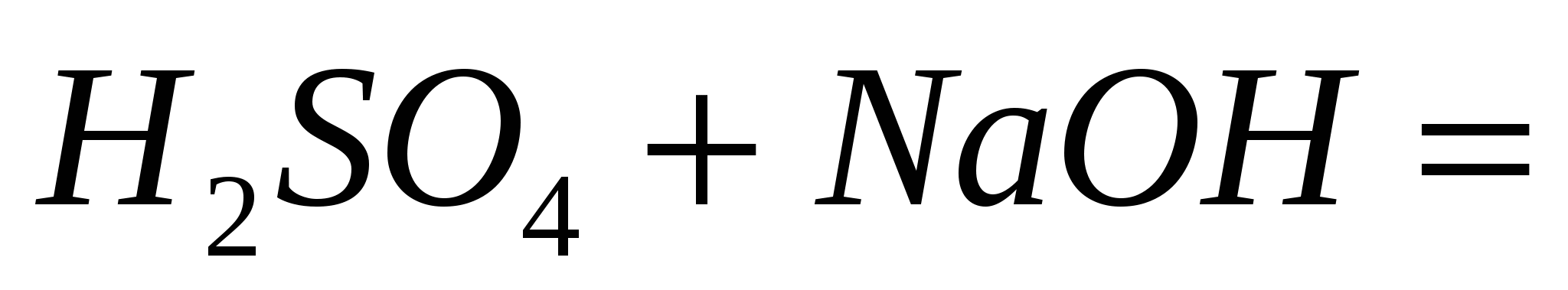 . .
В каком количестве воды следует растворить 19 г глицерина 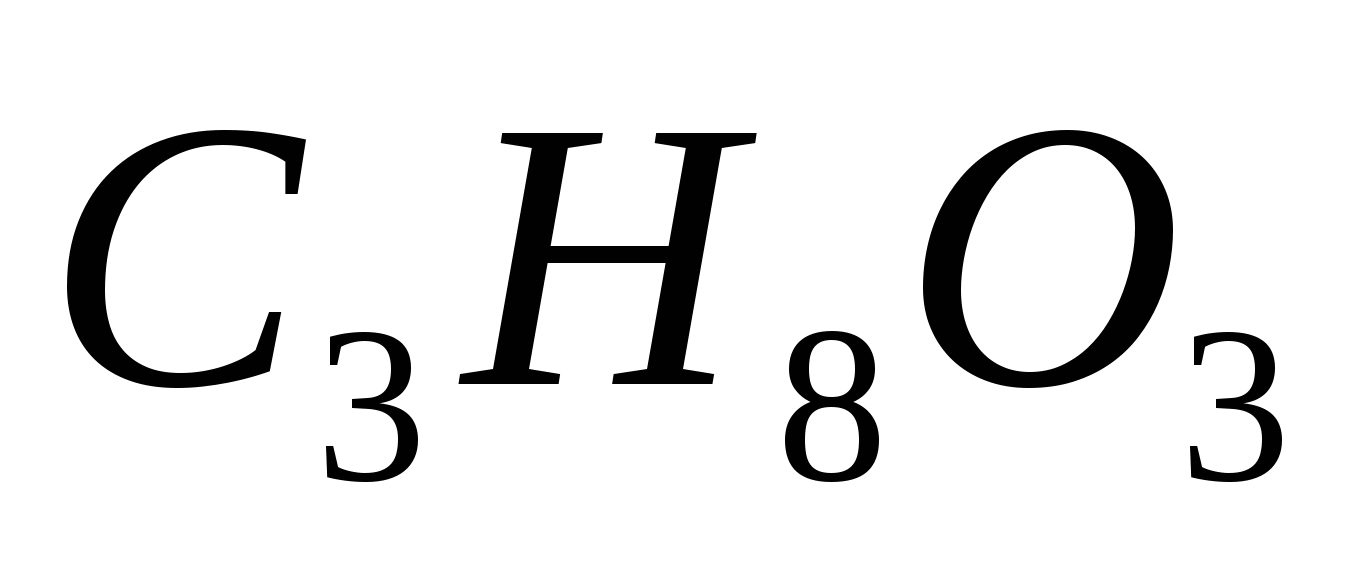 , чтобы получить раствор с температурой кипения 100,099ºС? Эбуллиоскопическая константа воды равна 0,52 0. , чтобы получить раствор с температурой кипения 100,099ºС? Эбуллиоскопическая константа воды равна 0,52 0.
Константа диссоциации одноосновной кислоты равна 1,5·10-5. Определите степень ее диссоциации в 0,003 М растворе.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 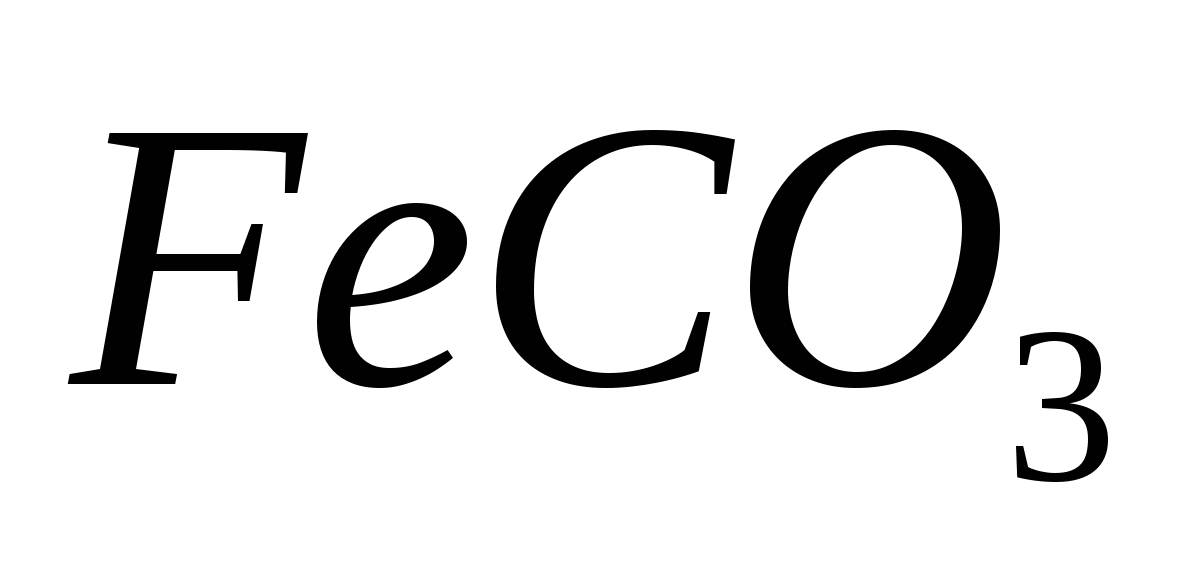 и и  . Укажите рН среды. . Укажите рН среды.
Вариант 11.
Вычислите тепловой эффект реакции гашения 15 кг извести. Процесс протекает по уравнению 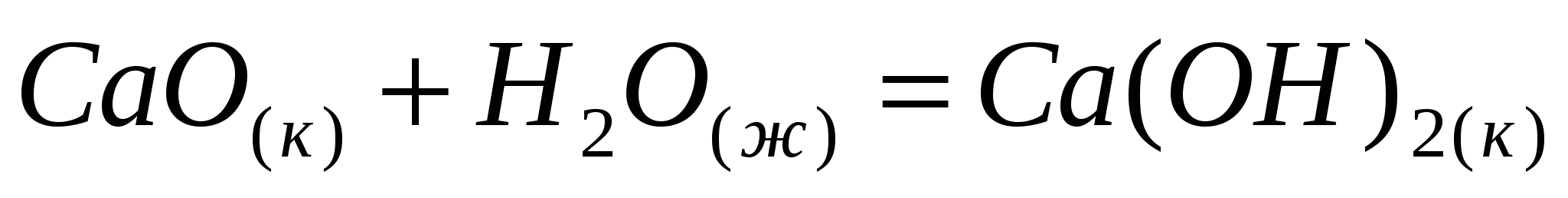 . .
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите 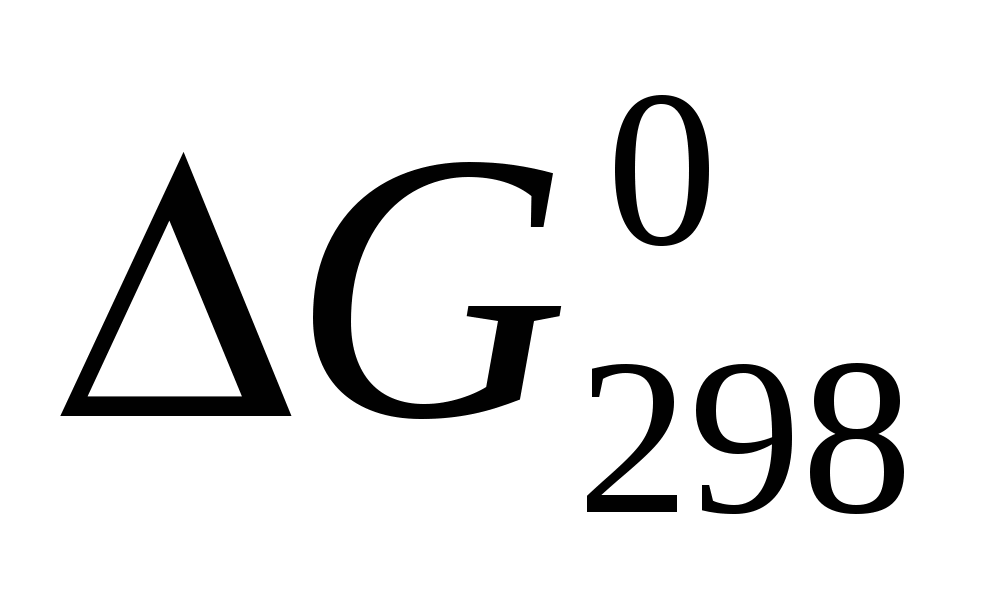 , протекающей по уравнению , протекающей по уравнению 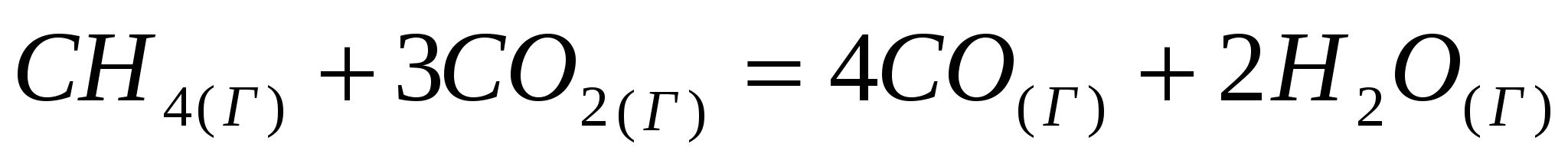 . Возможен ли этот процесс при стандартных условиях? . Возможен ли этот процесс при стандартных условиях?
Если температурный коэффициент реакции равен 3, то во сколько раз увеличится скорость реакции при увеличении температуры с 22 до 62°С?
Равновесие системы 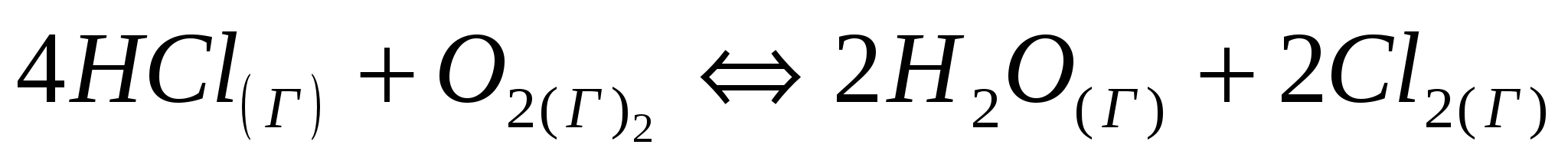 при постоянной температуре установилось при следующих концентрациях: при постоянной температуре установилось при следующих концентрациях: 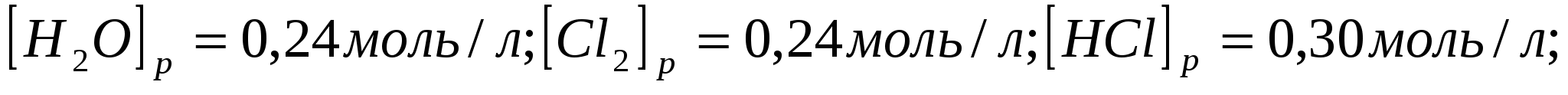 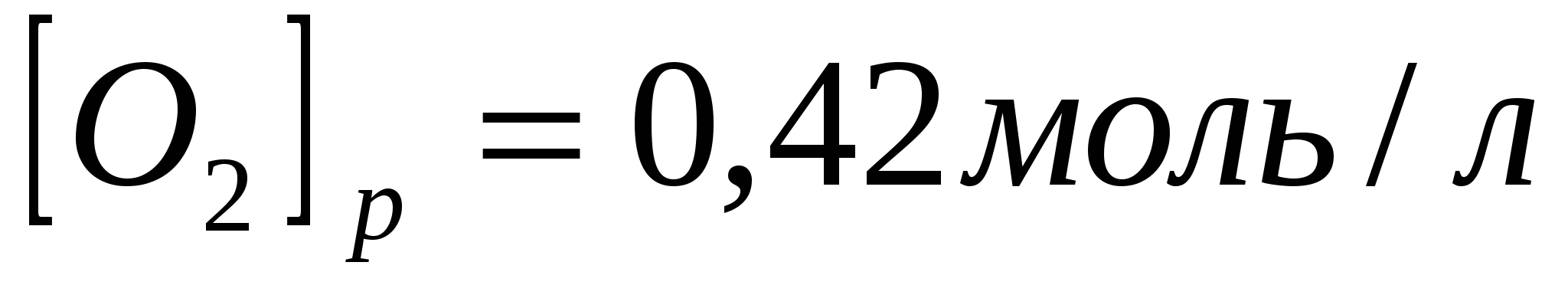 . Вычислите исходные концентрации хлороводорода и кислорода. . Вычислите исходные концентрации хлороводорода и кислорода.
Какой объем 25%-ного раствора плотностью 1,15 г/см3 надо прибавить к ее 12%-ному раствору плотностью 1,05 г/см3 объемом 1 л, чтобы получить 14%-ный раствор карбоната натрия?
Закончите молекулярные и составьте ионно-молекулярные уравнения процессов, проходящих по схемам: 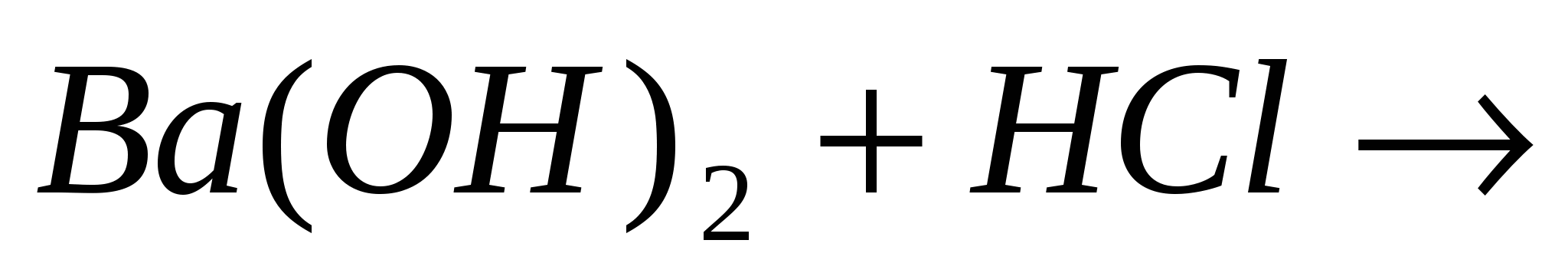 …; …; 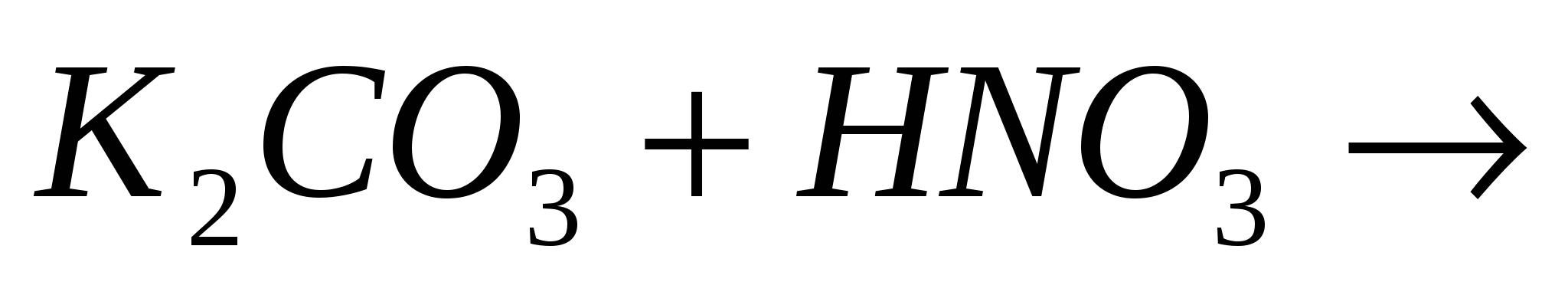 …. ….
Чему равно при температуре 8ºС осмотическое давление раствора, в 1,6 л которого содержится 256 мг глицерина 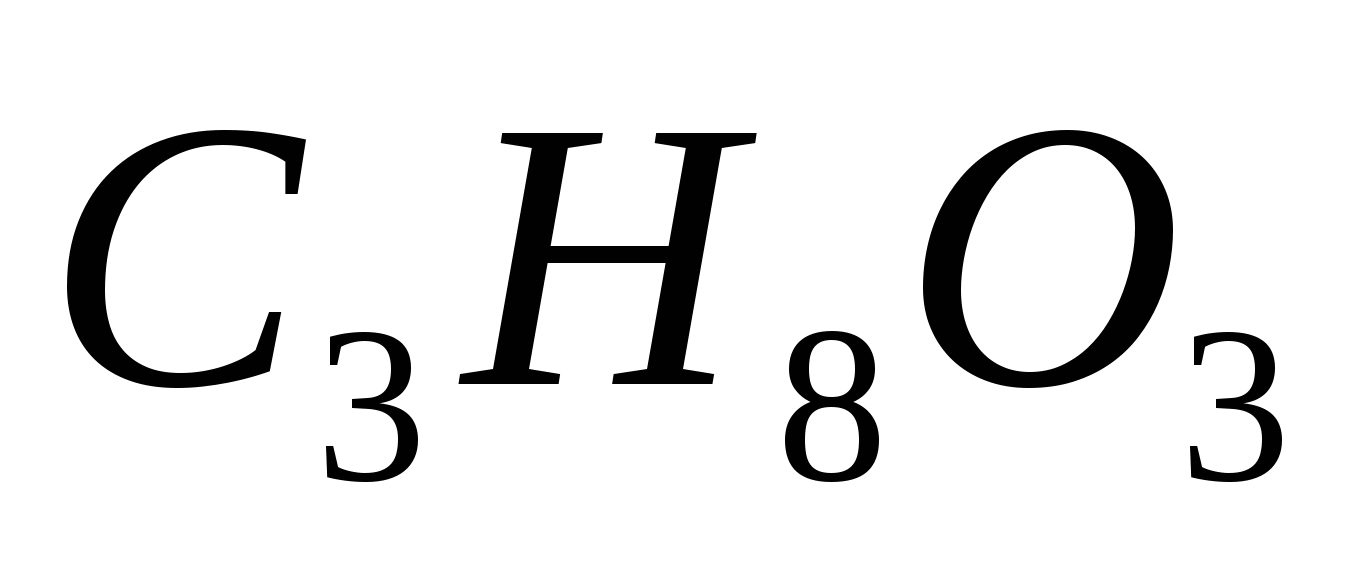 ? ?
Приведите по три примера сильных и слабых электролитов, составьте уравнения их диссоциации.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 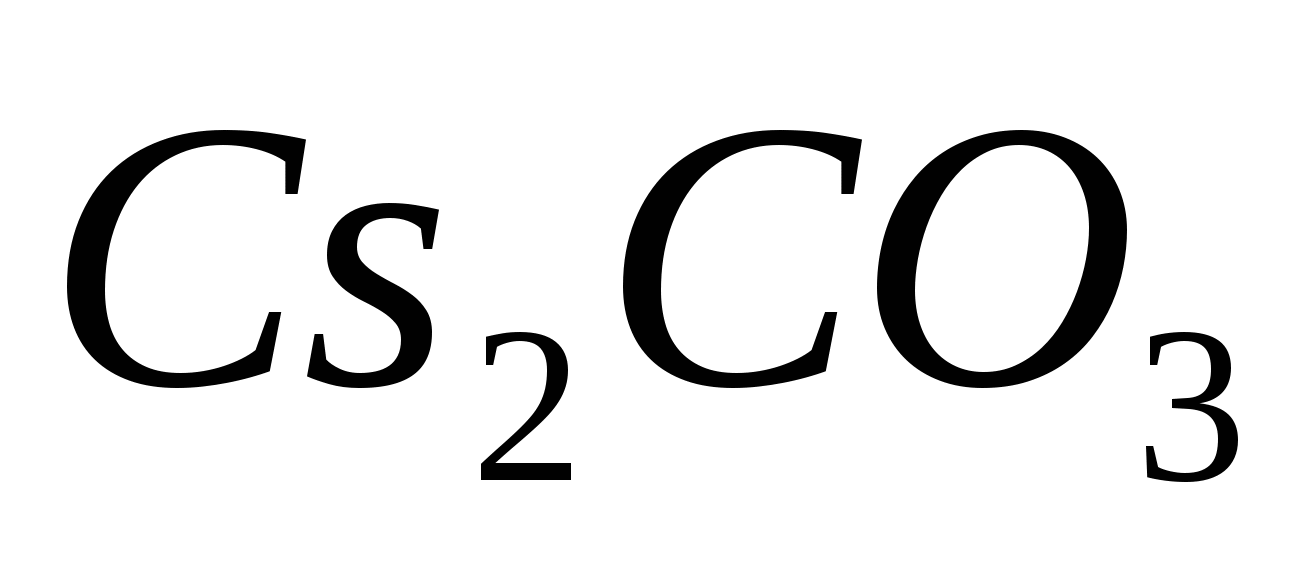 и и 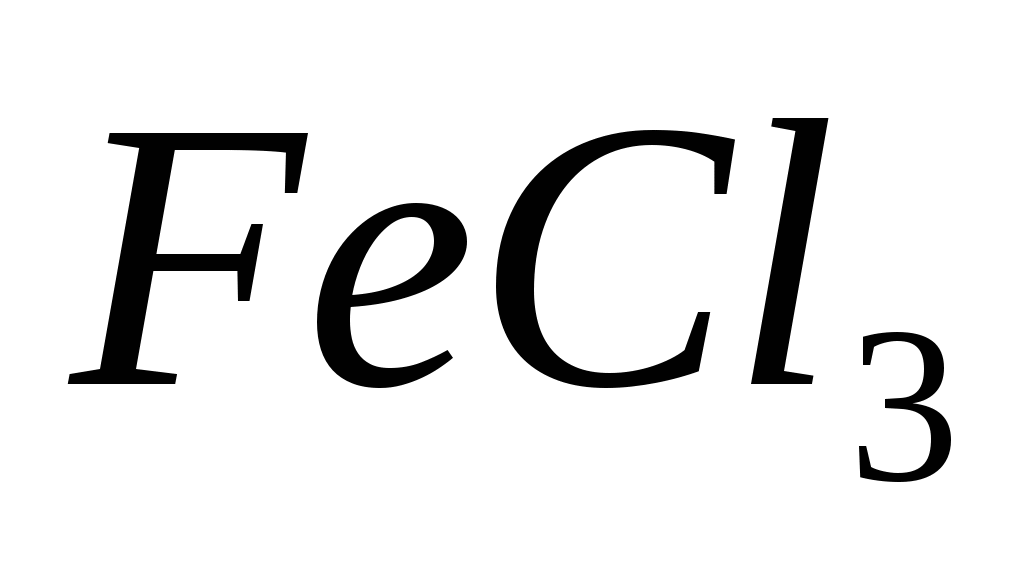 . Укажите рН среды. . Укажите рН среды.
Вариант 12.
Вычислите величину изменения энтальпии реакций: 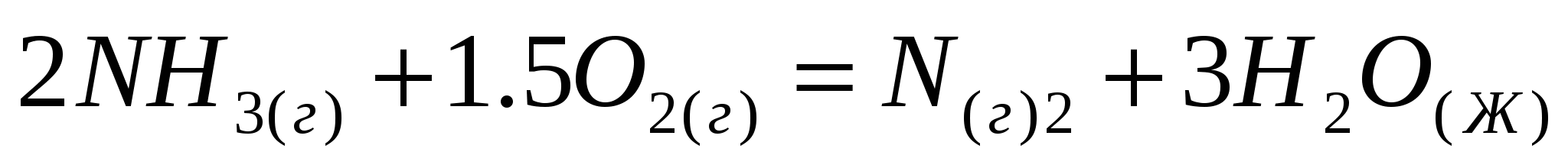 ; ; 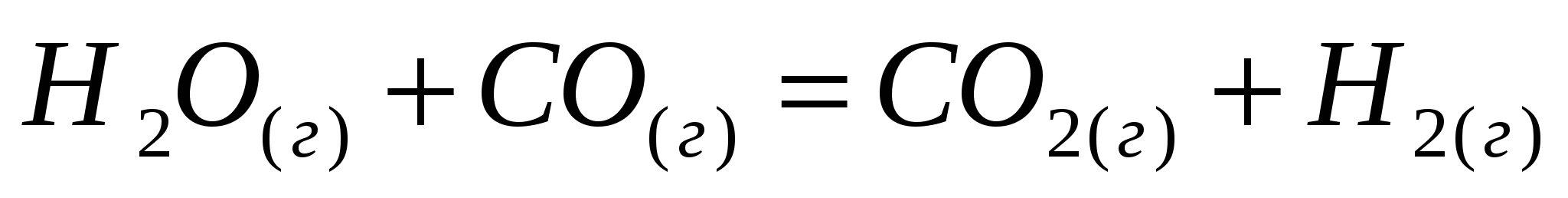 . .
Прямая или обратная реакция будет протекать при стандартных условиях в системе 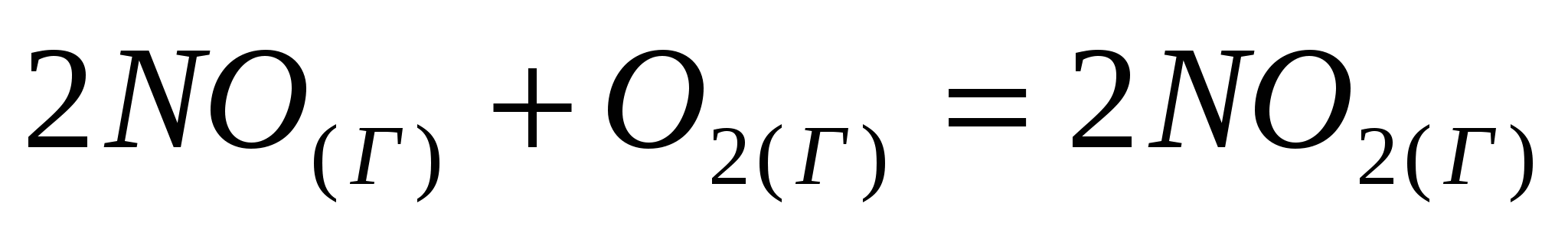 . Ответ мотивируйте, вычислив . Ответ мотивируйте, вычислив  прямой реакции. прямой реакции.
Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гомогенной системе: a) CO + Cl2 → COCl2; б) 2NO + O2 → 2NO2;
в) 4HCl + O2 → 2H2O + 2Cl2.
Напишите выражение для константы равновесия гетерогенной системы 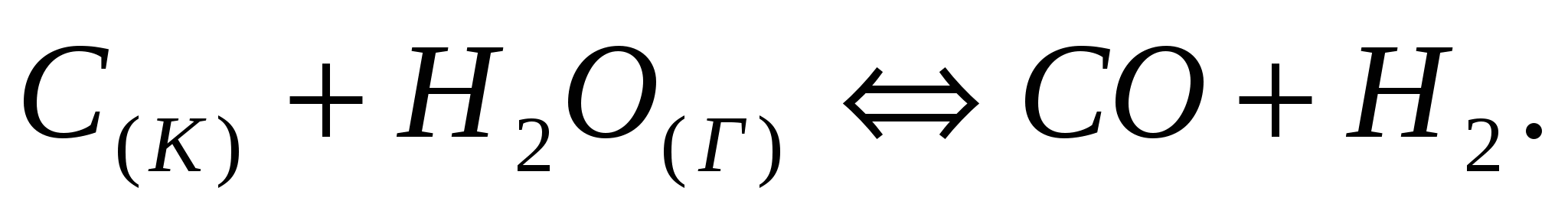 Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции? Как следует изменить давление и концентрацию веществ, чтобы сместить равновесие в сторону прямой реакции?
Какой объем раствора серной кислоты с массовой долей  15% (ρ=1.219 г/см3) можно приготовить из 4 кг раствора серной кислоты с массовой долей 15% (ρ=1.219 г/см3) можно приготовить из 4 кг раствора серной кислоты с массовой долей  65%? 65%?
Составьте молекулярные уравнения по ионно-молекулярным: 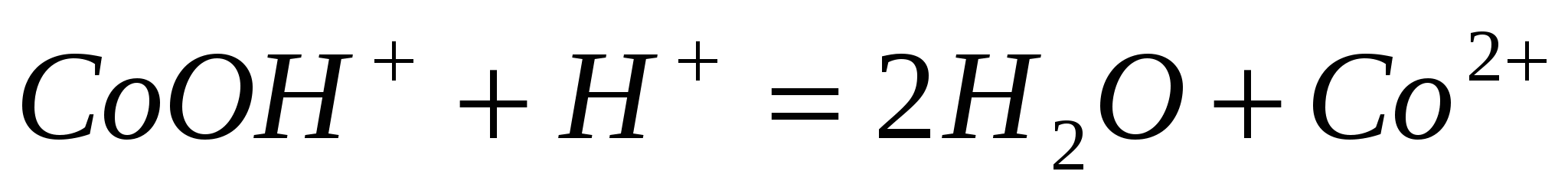 ; ; 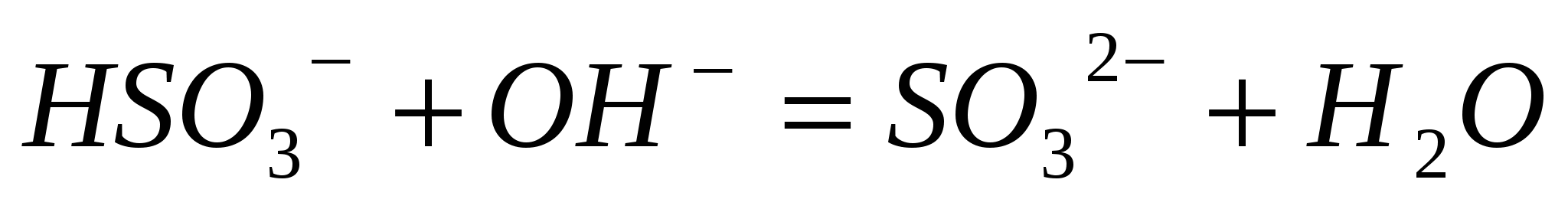
Вычислите осмотическое давление 0,035 М раствора сахара 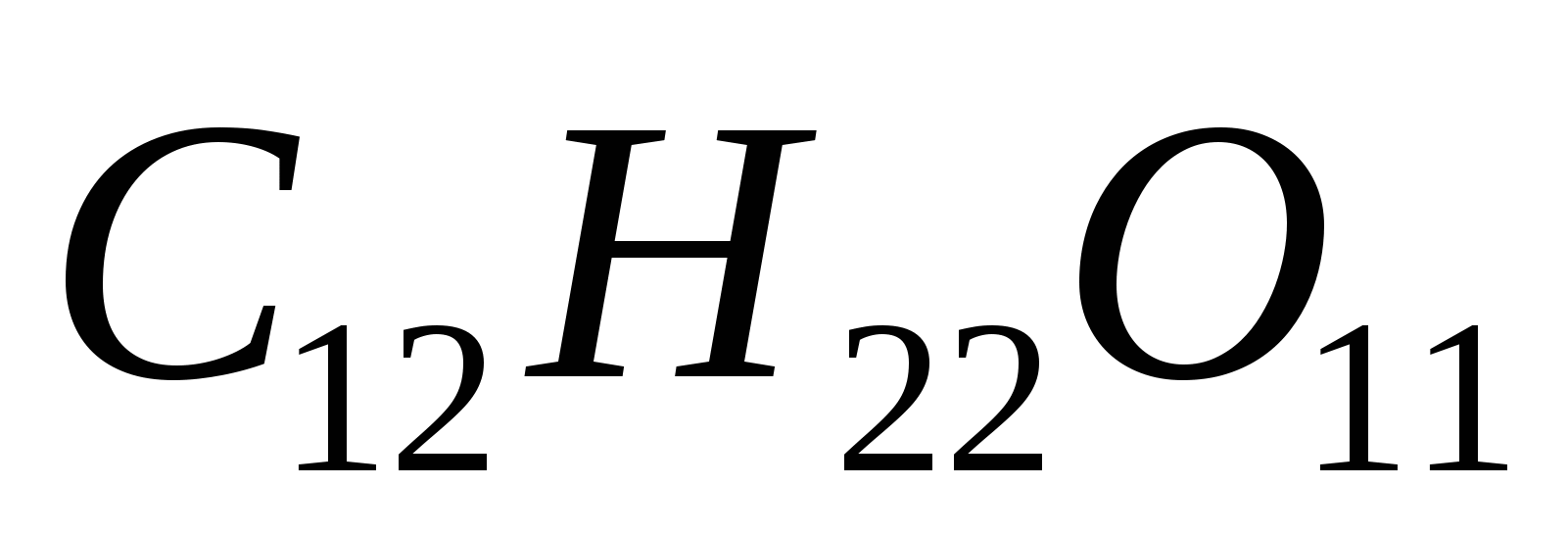 при 35ºС. при 35ºС.
Составьте уравнения электролитической диссоциации следующих электролитов: 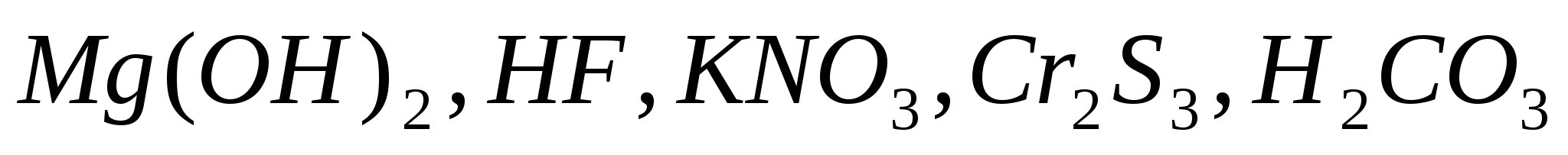 . Запишите выражения констант равновесия для слабых электролитов. . Запишите выражения констант равновесия для слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 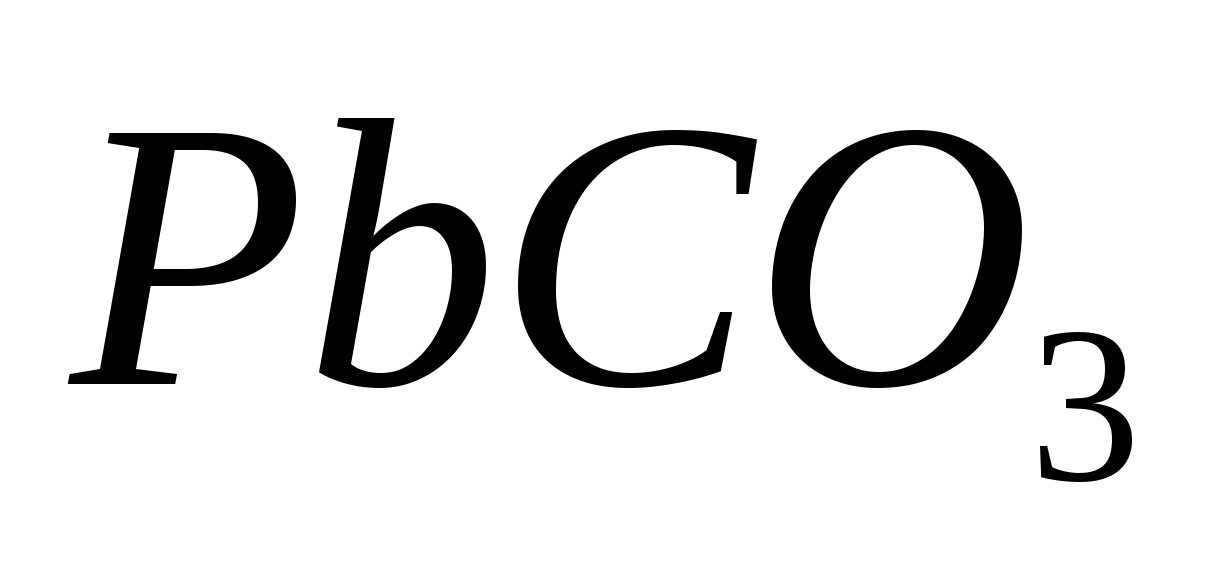 и и  . Укажите рН среды. . Укажите рН среды.
Вариант 13.
Теплоты растворения безводного сульфата меди составляет 66,1 кДж/моль, а теплота перевода его в пятиводный гидрат 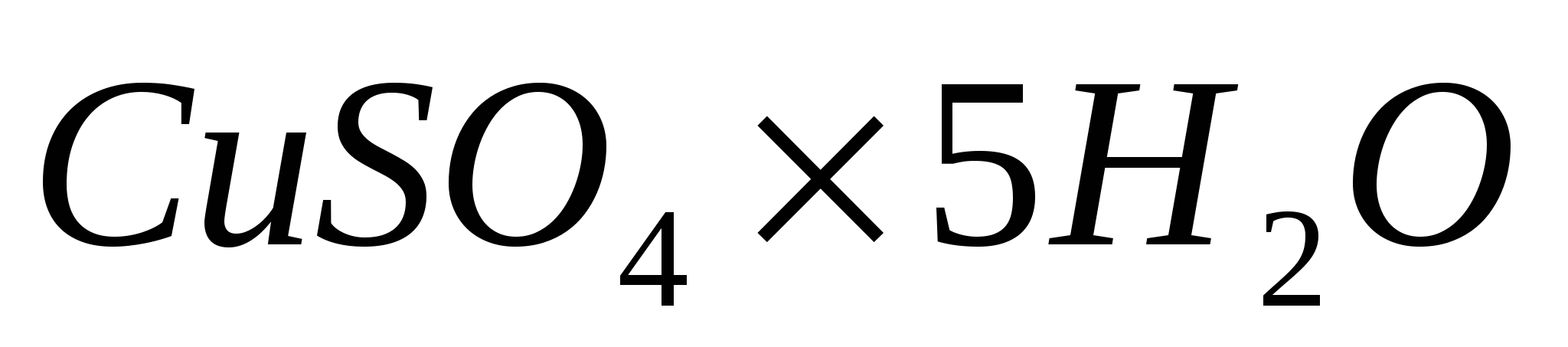 равна –78,8 КдЖ/моль. Вычислите теплоту растворения равна –78,8 КдЖ/моль. Вычислите теплоту растворения 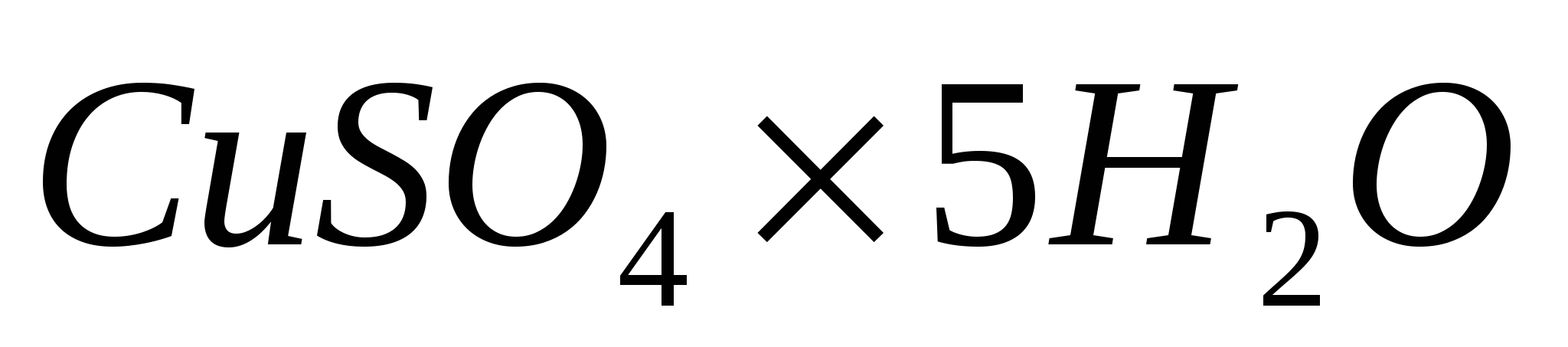 . .
Вычислите 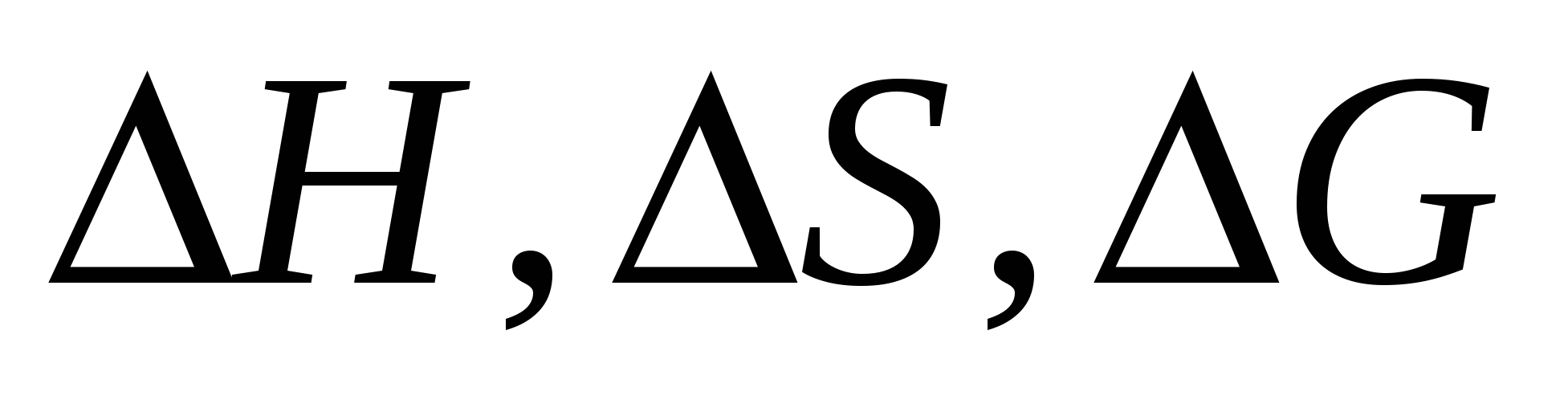 реакции восстановления реакции восстановления  углеродом: углеродом:  при стандартных условиях. Возможна ли эта реакция при 300 К? при стандартных условиях. Возможна ли эта реакция при 300 К?
Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гетерогенной системе: а) С(к) + O2(г) → СO2 (г); б) СO2(г) + С(к) → 2СО(г); в) СаО(к) + СO2(г) → СаСО3(к).
Напишите выражение для константы равновесия гетерогенной системы 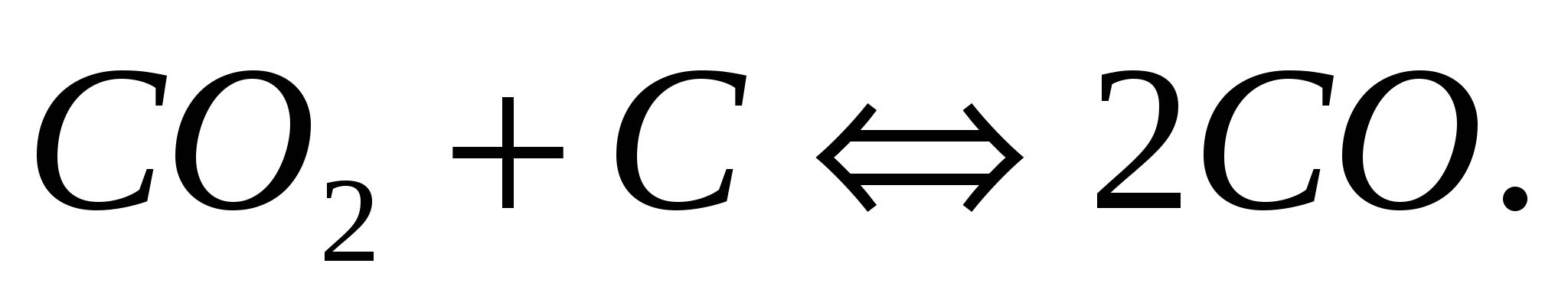 Что необходимо предпринять для повышения выхода оксида углерода? Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза? Что необходимо предпринять для повышения выхода оксида углерода? Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза?
10 мл 25%-ного раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
Составьте молекулярные и ионно-молекулярные уравнения реакций, которые возможны при попарном взаимодействии растворов следующих солей: 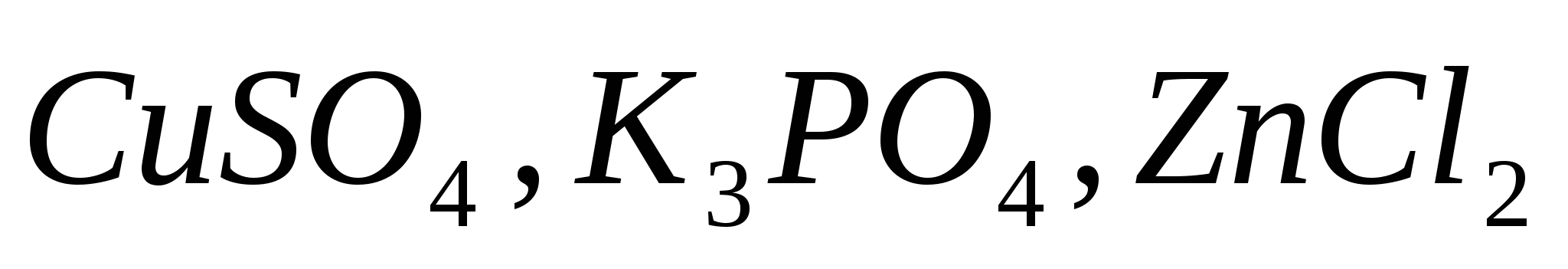 . .
Температура кипения ацетона 56,1ºС, а его эбуллиоскопическая константа равна 1,73º. Вычислите температуру кипения 8%-ного раствора глицерина 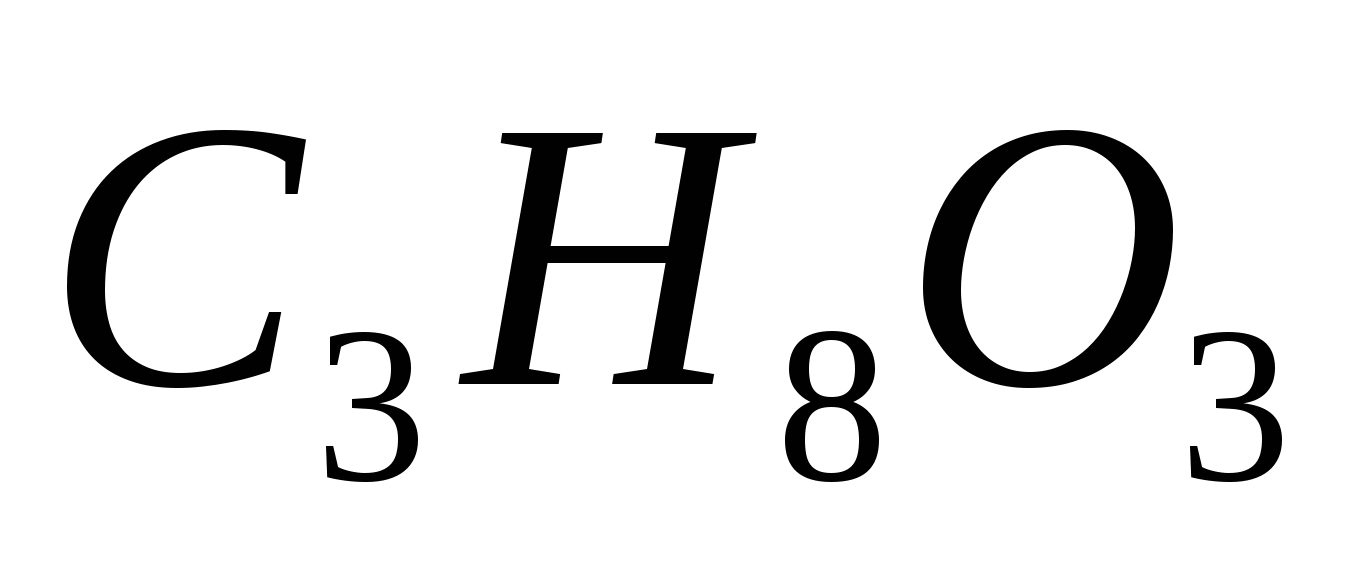 в ацетоне. в ацетоне.
Составьте уравнения электролитической диссоциации электролитов 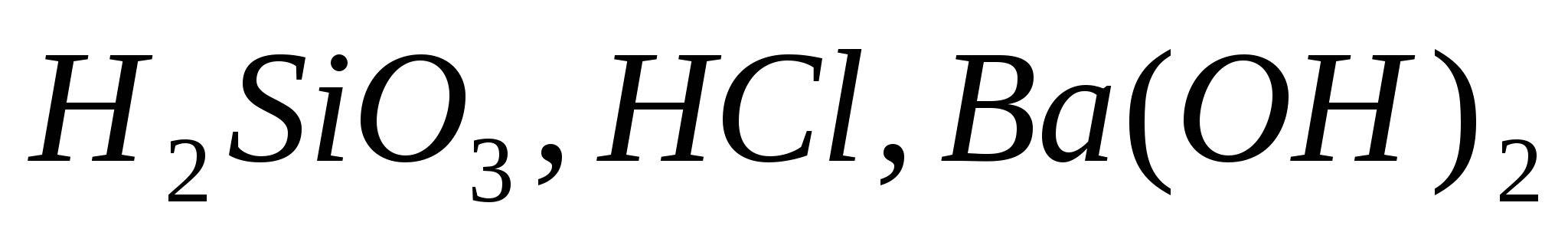 . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов. . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 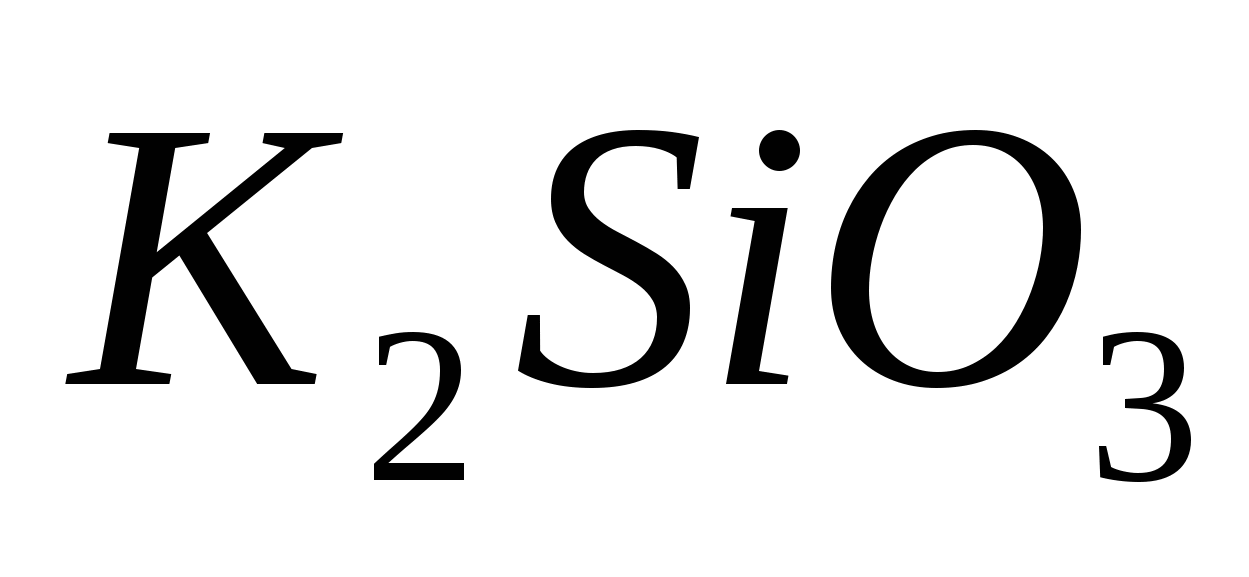 и и 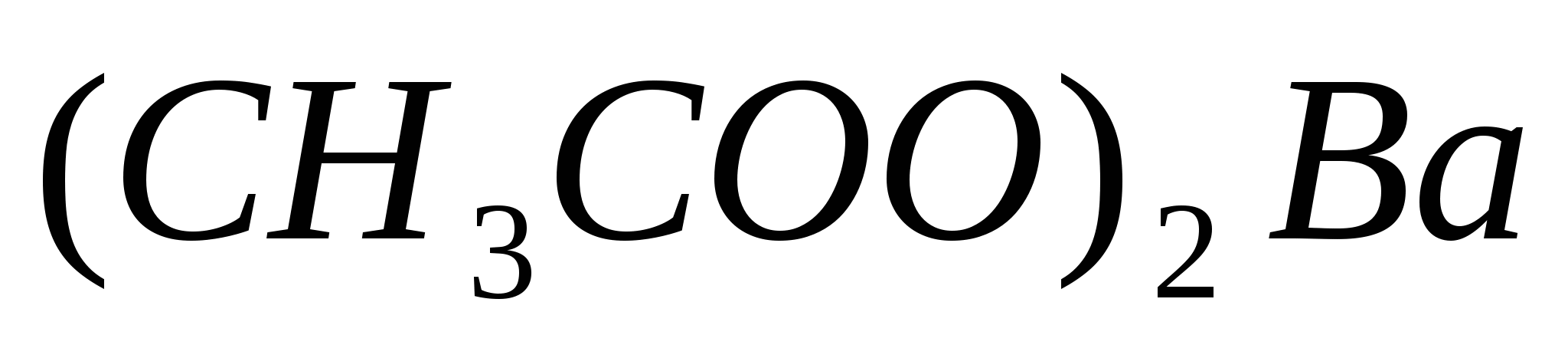 . Укажите рН среды. . Укажите рН среды.
Вариант 14.
Определите тепловой эффект следующих химических реакций: 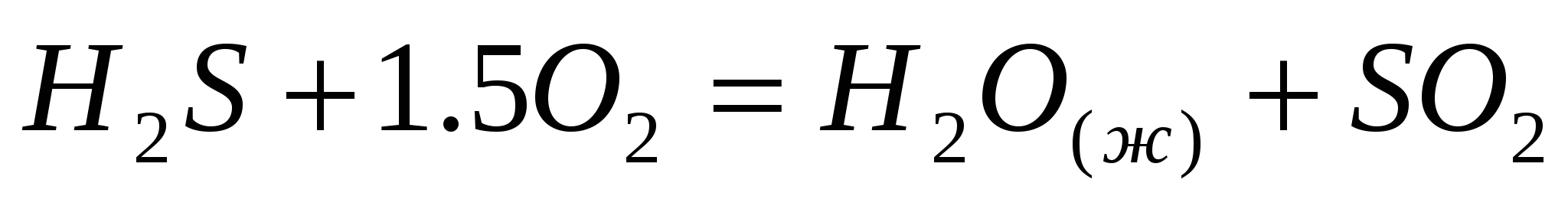 ; ; 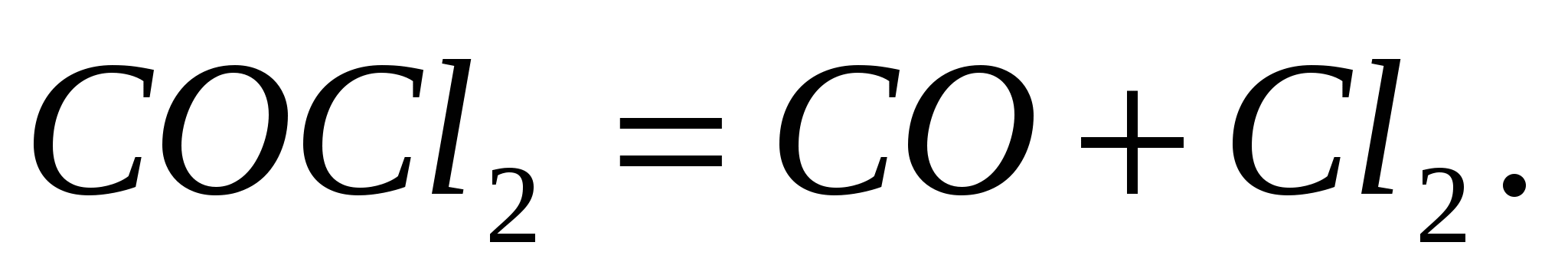
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите  реакции, протекающей по уравнению реакции, протекающей по уравнению 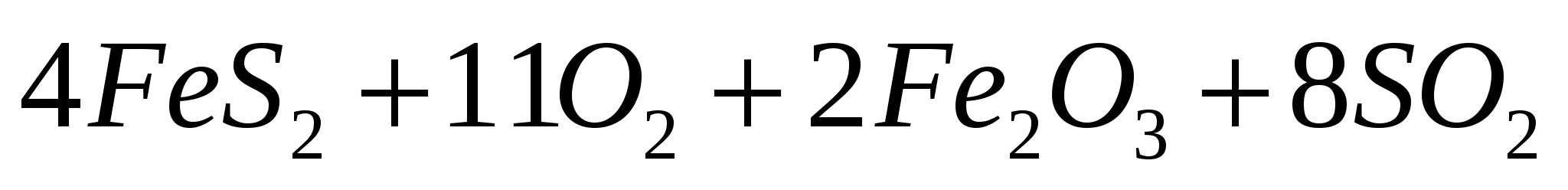  . .
Определите, как изменится скорость прямой реакции
2SO2(г) + O2(г) ↔ 2 SO3(г), если давление в системе увеличить в 5 раз?
Составьте выражение для константы равновесия реакции, протекающей в закрытой системе при постоянной температуре: 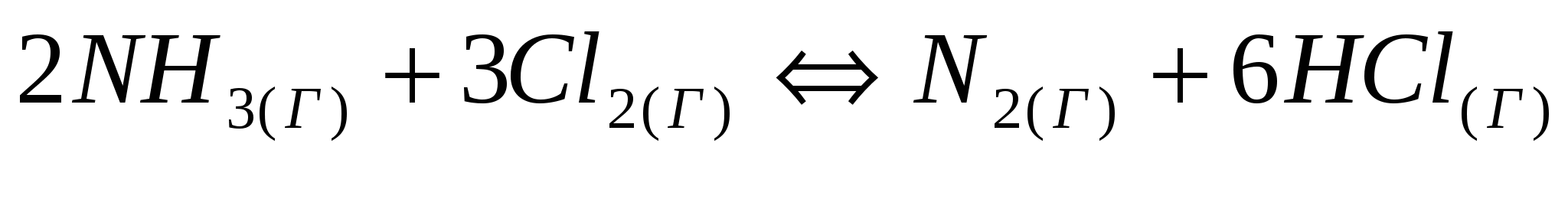 . Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз. . Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз.
Какой объем 10%-ного раствора соли плотностью 1,05 г/см3 надо прибавить к ее 2%-ному раствору плотностью 1,02 г/см3 объемом 1 л, чтобы получить 3%-ный раствор карбоната натрия?
Выразите ионными и молекулярными уравнениями следующие процессы: а) действие сероводорода на сульфат никеля; б) взаимодействие хлорида гидроксоалюминия с соляной кислотой.
При какой температуре осмотическое давление раствора, содержащего в 2 л 85 мг глюкозы 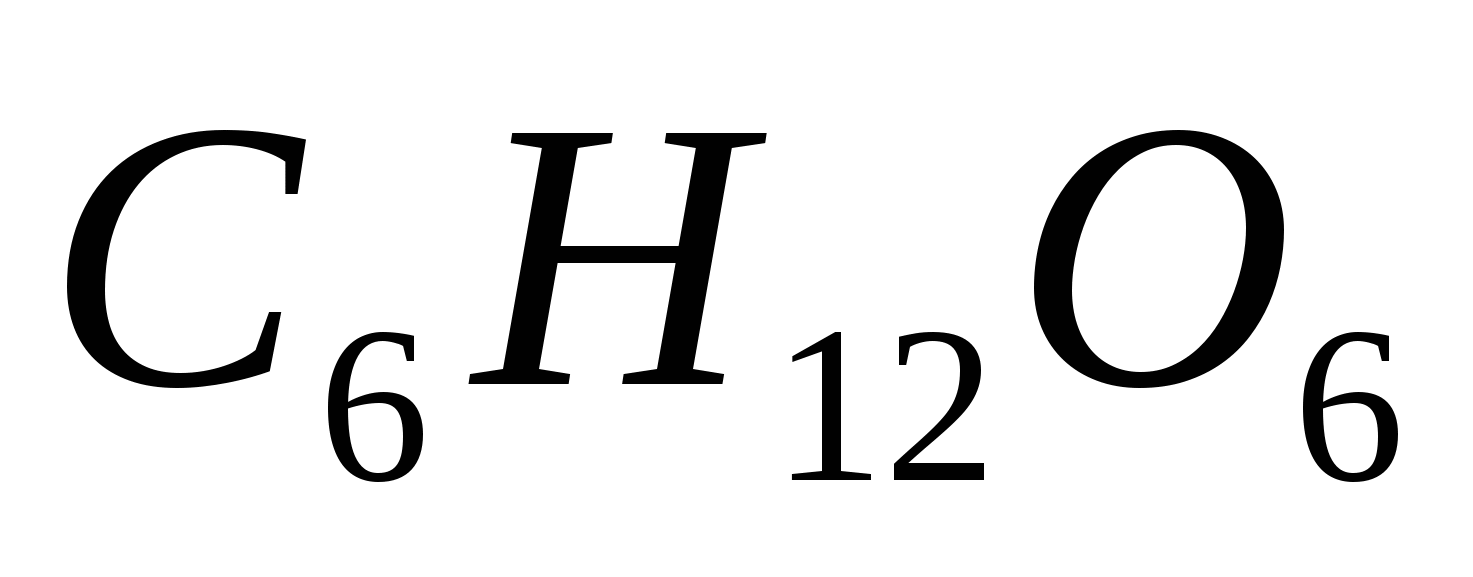 , составит 607,8 Па? Вычислите молярную концентрацию раствора. , составит 607,8 Па? Вычислите молярную концентрацию раствора.
Определите степень диссоциации 0,2 М раствора гидроксида аммония, константа его диссоциации равна 1,77·10-5. Запишите уравнение диссоциации.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 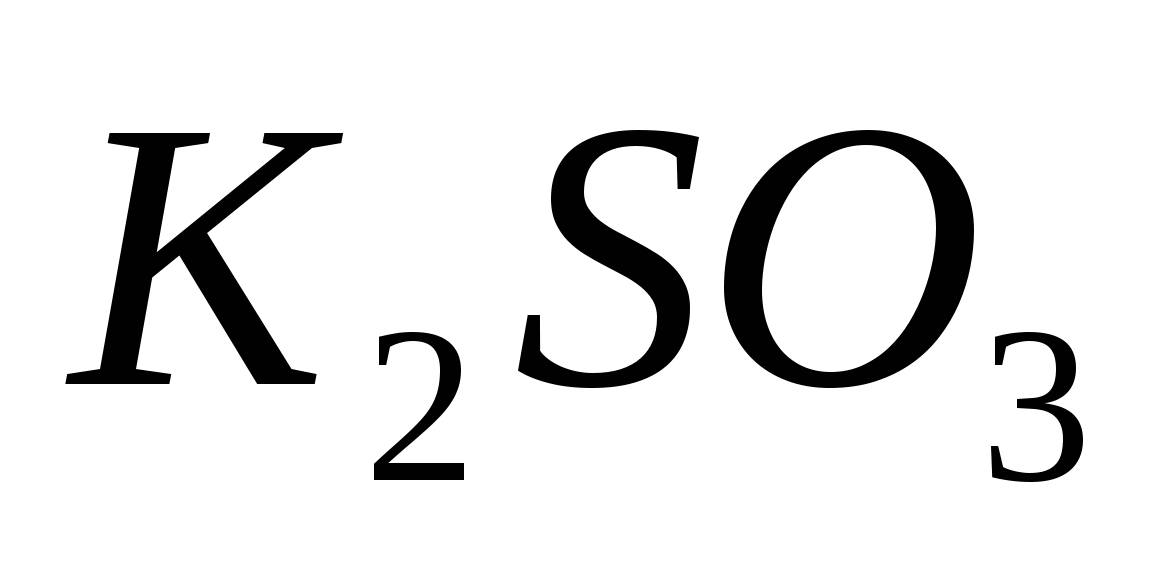 и и 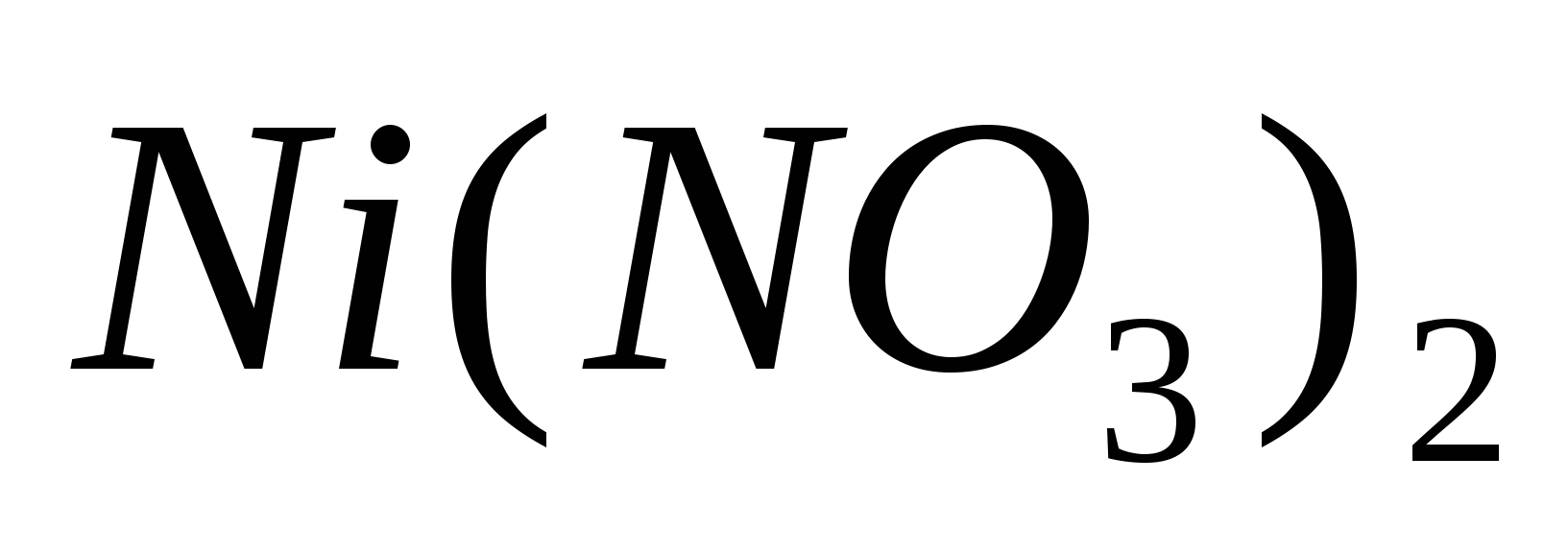 . Укажите рН среды. . Укажите рН среды.
Вариант 15.
Произведя соответствующие термодинамические расчеты, установите, являются ли данные реакции экзо- или эндотермическими:
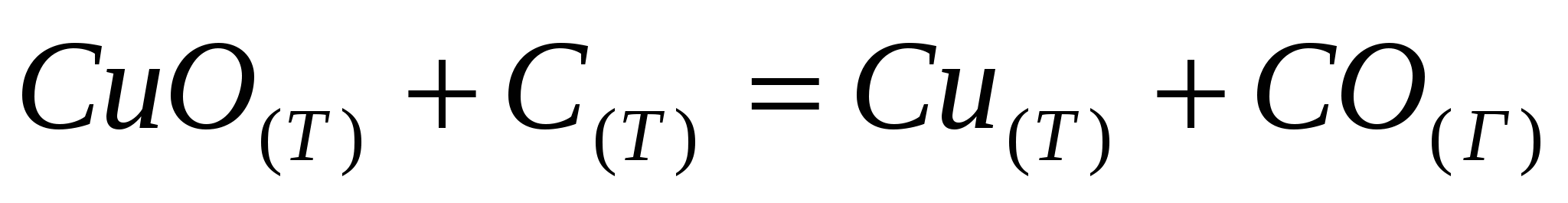 ; ; 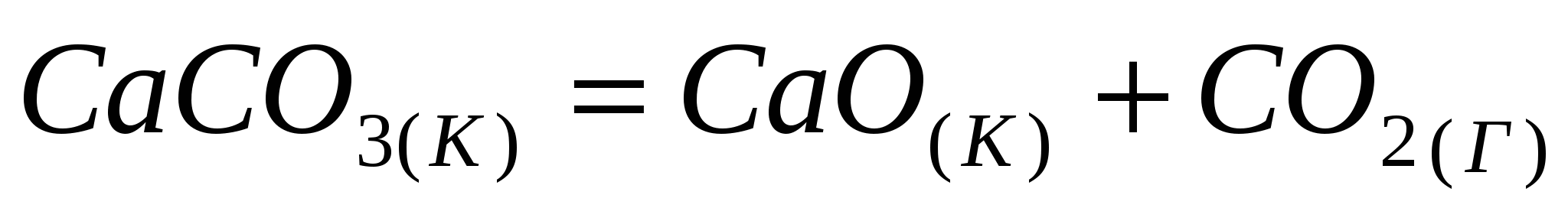
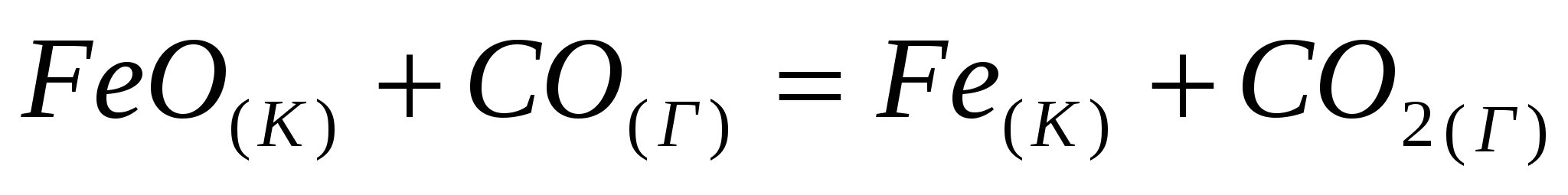 . .
При какой температуре наступит равновесие в системе: 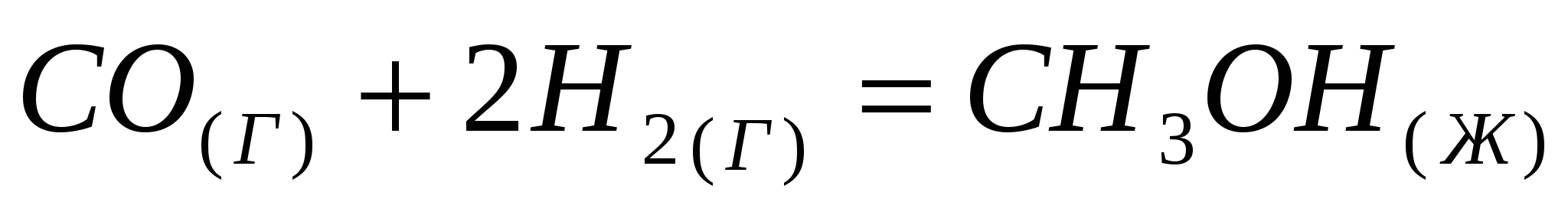 ; ; 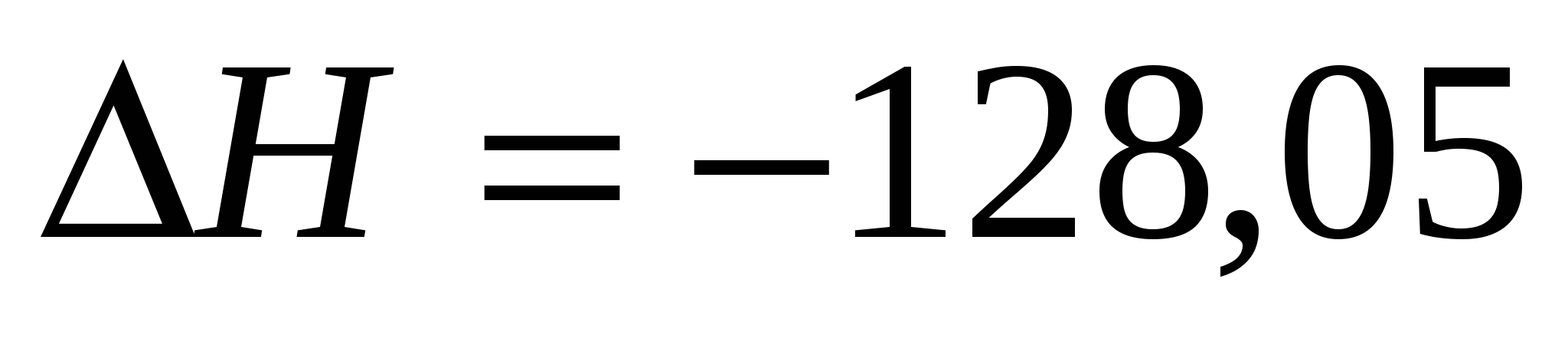 кДж? кДж?
Как изменится скорость прямой реакции 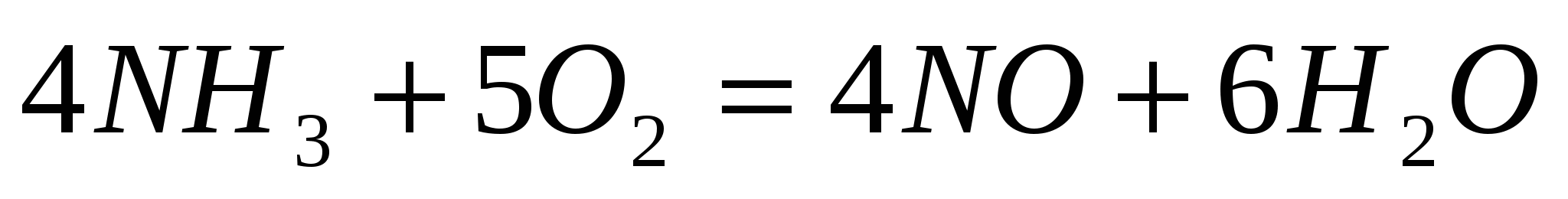 если объем газовой смеси уменьшить в 3 раза? если объем газовой смеси уменьшить в 3 раза?
Установите, во сколько раз уменьшится или увеличится равновесная концентрация оксида углерода в реакции: 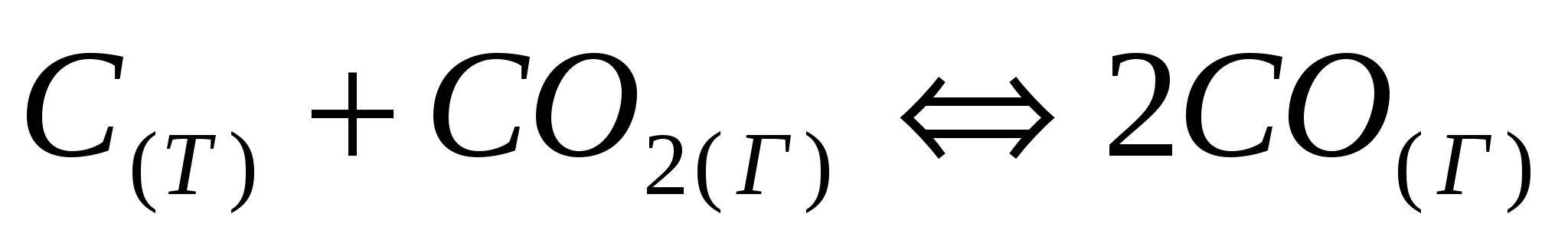 при увеличении значения равновесной концентрации диоксида углерода в 3 раза. при увеличении значения равновесной концентрации диоксида углерода в 3 раза.
Какой объем 0.1 н.  можно приготовить из 1,7 л раствора азотной кислоты с массовой долей 25% (ρ=1.18г/см3)? можно приготовить из 1,7 л раствора азотной кислоты с массовой долей 25% (ρ=1.18г/см3)?
Составьте молекулярные уравнения реакций, представленных следующими ионными уравнениями: 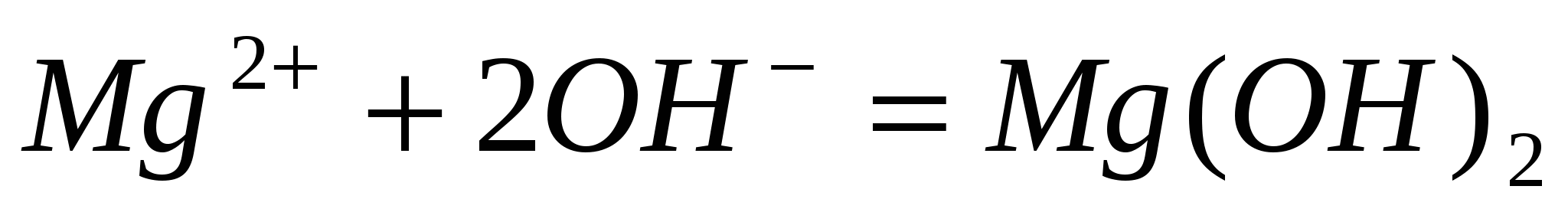 ; ; 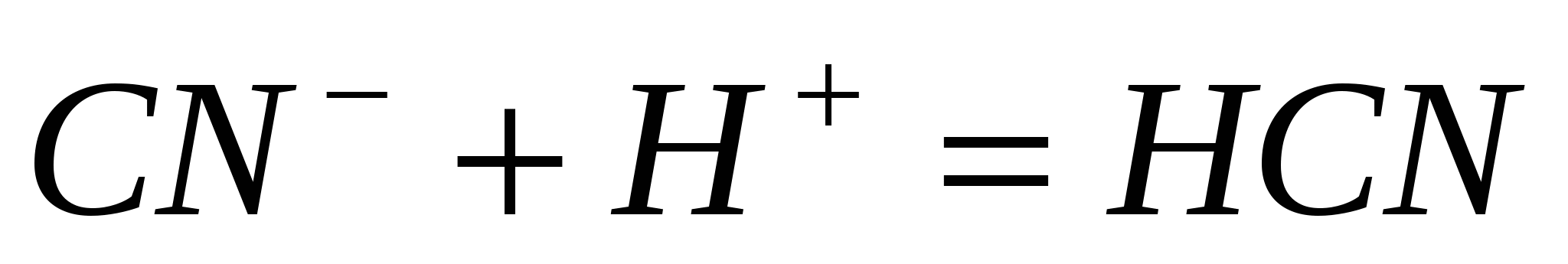 . .
Температура кипения эфира 34,6ºС, а его эбуллиоскопическая константа равна 2,16º. Вычислите молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,53ºС.
Составьте уравнения электролитической диссоциации следующих электролитов: 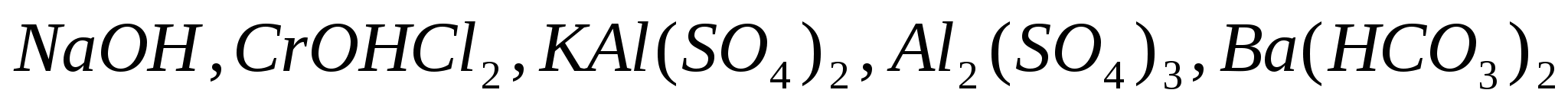 . .
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 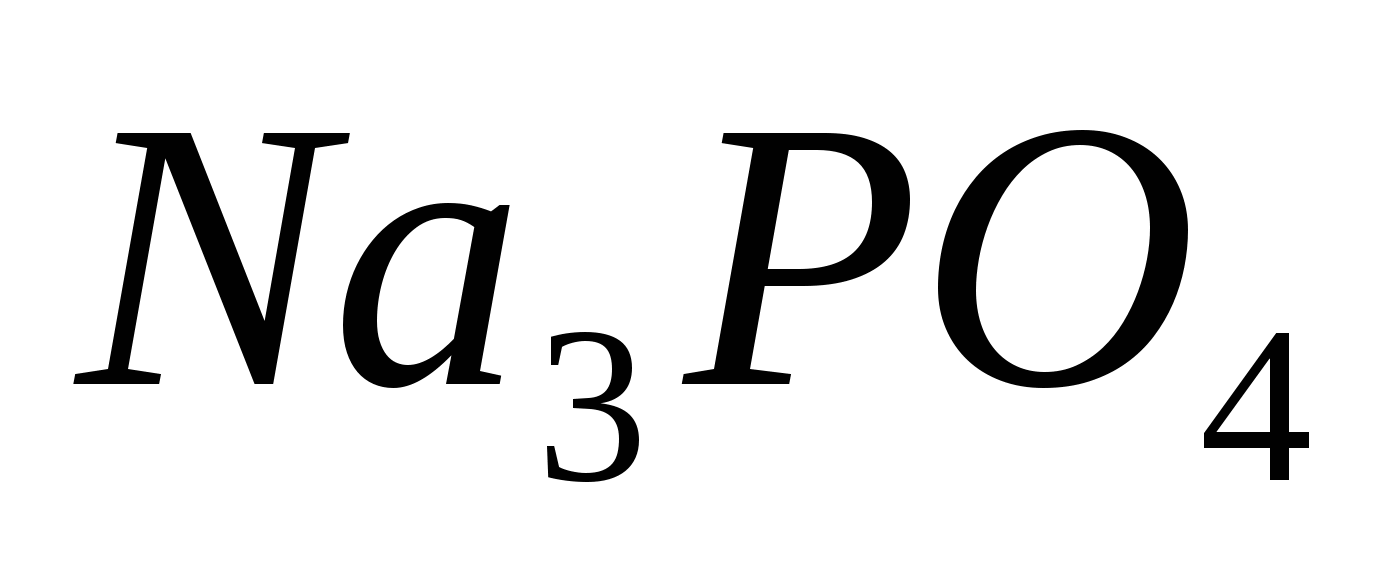 и и  . Укажите рН среды. . Укажите рН среды.
Вариант 16.
Вычислите теплоту образования 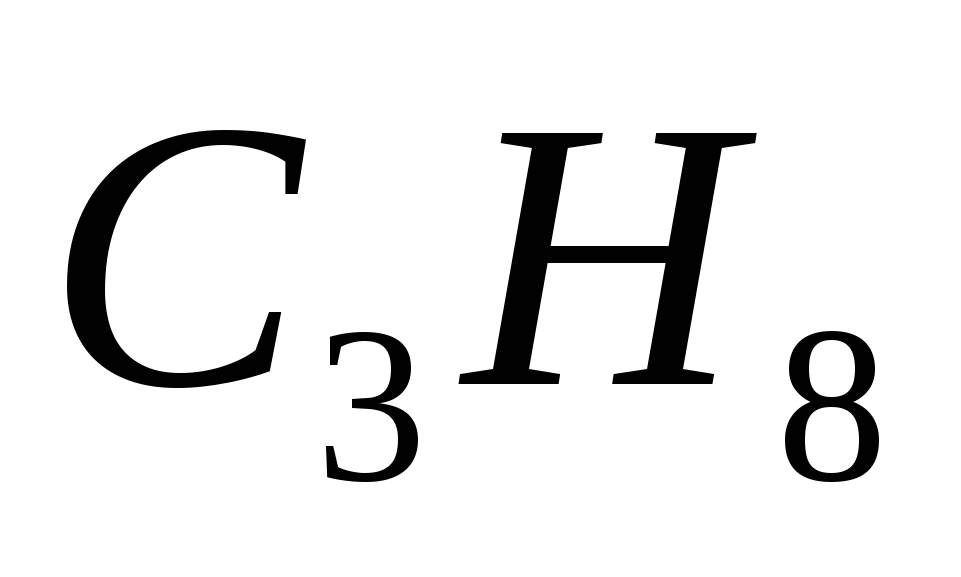 , если известно, что при сгорании 11г его выделилось 552 кДж. , если известно, что при сгорании 11г его выделилось 552 кДж.
Вычислите температуру, при которой система находится в равновесии, считая, что 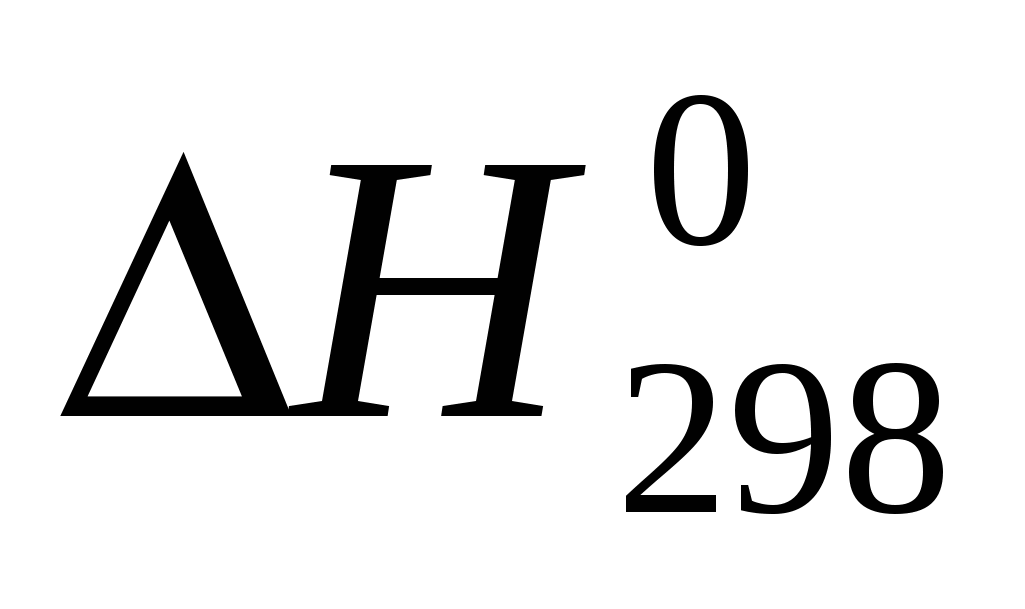 и и 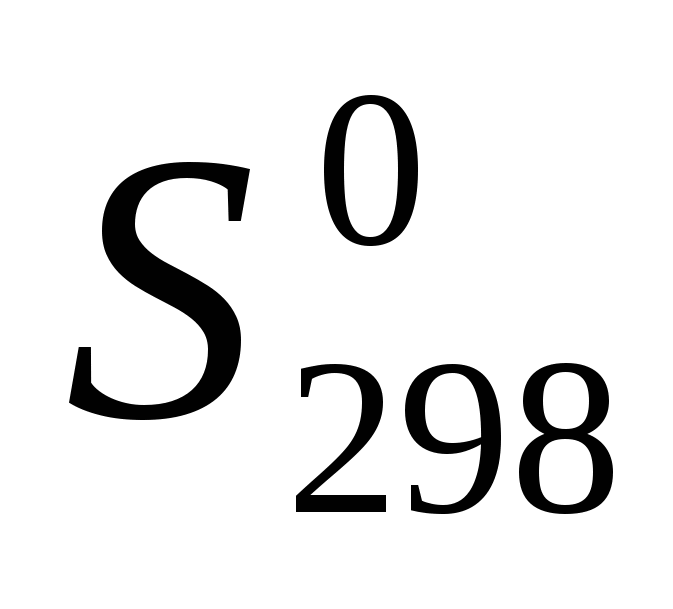 не зависят от температуры: не зависят от температуры:
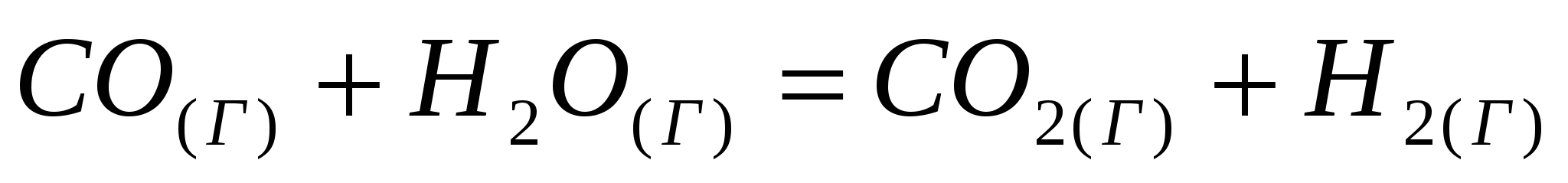
При повышении температуры на 30°С скорость химической реакции увеличилась в 64 раза. Вычислите, во сколько раз увеличится скорость этой реакции при повышении температуры на каждые 10°.
Как увеличить выход продуктов следующих реакций:
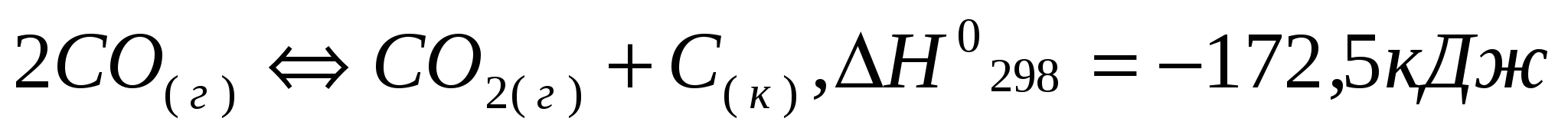
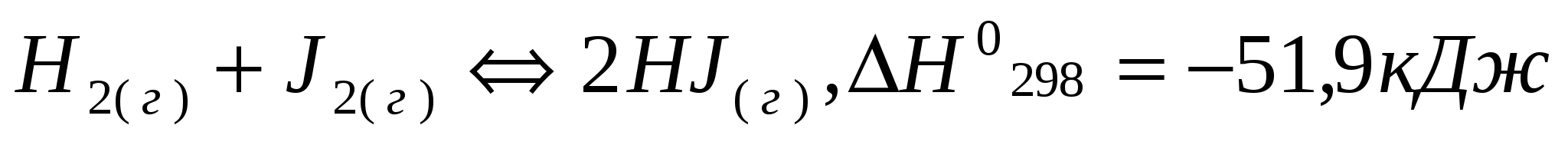
за счет изменения концентрации реагентов, давления, температуры?
Сколько граммов 30%-ного (по массе) раствора 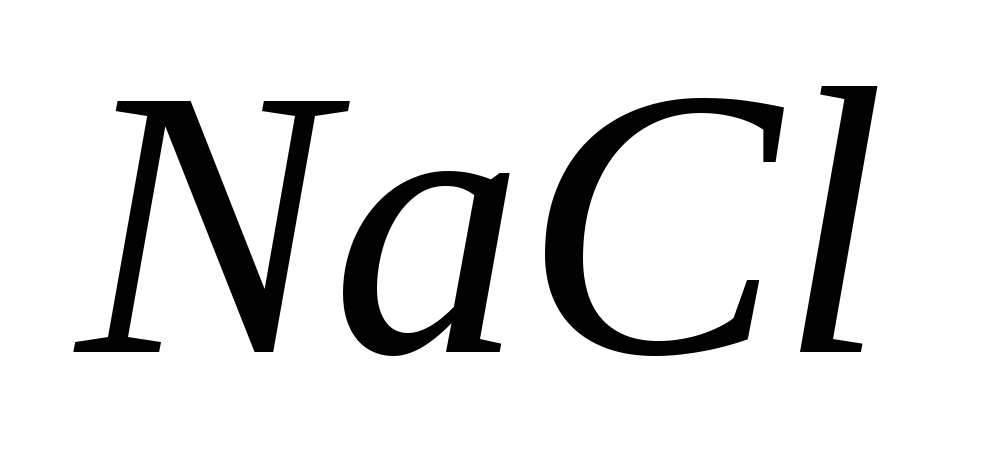 нужно добавить к 300 г воды, чтобы получить 10%-ный раствор соли? нужно добавить к 300 г воды, чтобы получить 10%-ный раствор соли?
Закончите молекулярные и составьте ионно-молекулярные уравнения процессов, проходящих по схемам: 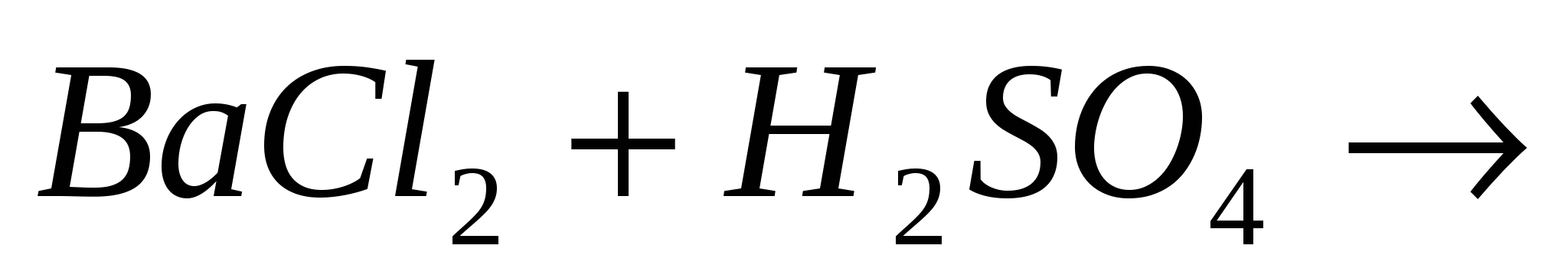 …; …; 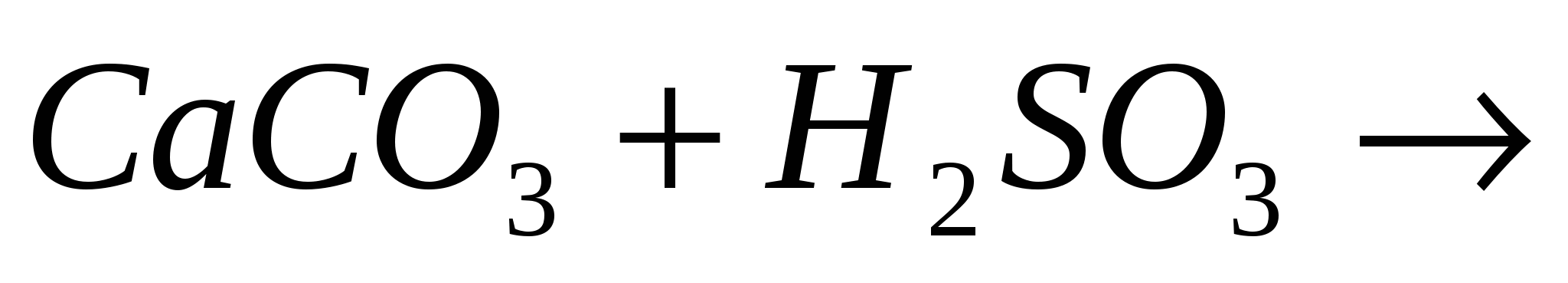 …. ….
Раствор, содержащий 0,512 г вещества в 100 г бензола, кристаллизуется при 5,296ºС. Вычислите мольную массу вещества, если известно, что температура кристаллизации бензола составляет 5,5ºС, а криоскопическая константа равна 5,1º
Составьте уравнения электролитической диссоциации следующих электролитов: 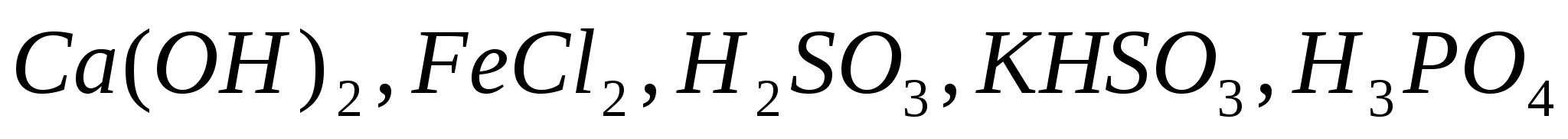 . Запишите выражения констант равновесия для слабых электролитов. . Запишите выражения констант равновесия для слабых электролитов.
Какие из солей 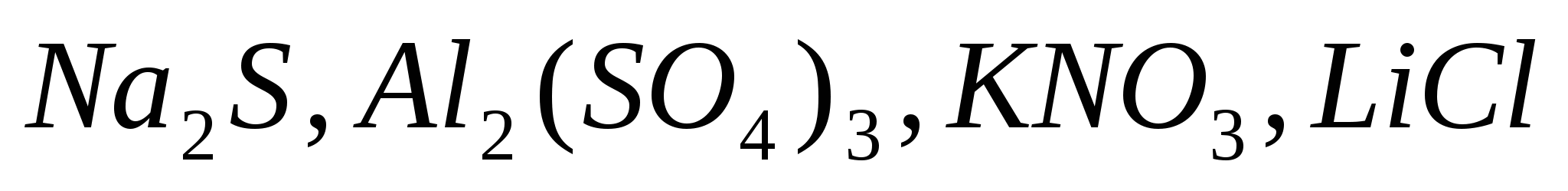 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей. подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей.
|
 Скачать 0.72 Mb.
Скачать 0.72 Mb.
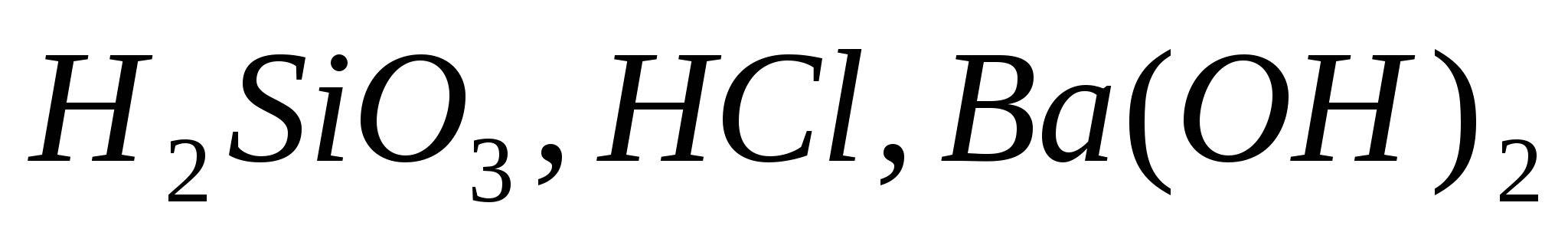 . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
. Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.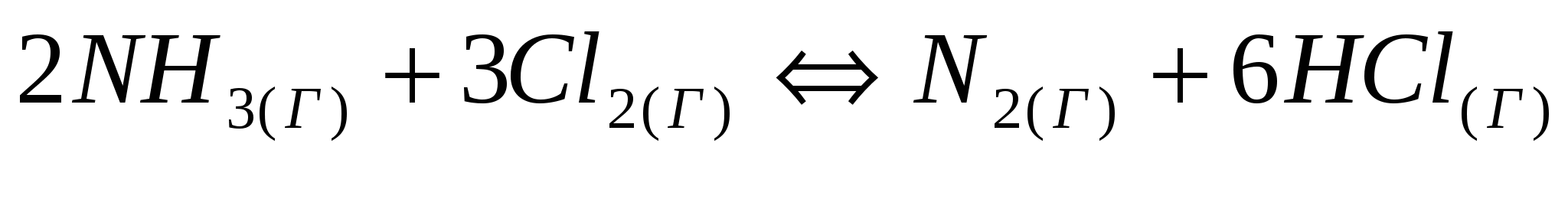 . Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз.
. Укажите, во сколько раз изменится значение константы равновесия, если: а) концентрацию хлора увеличить в 2 раза; б) концентрацию хлороводорода увеличить в 6 раз.