Вариант 17.
Процесс выражается термохимическим уравнением
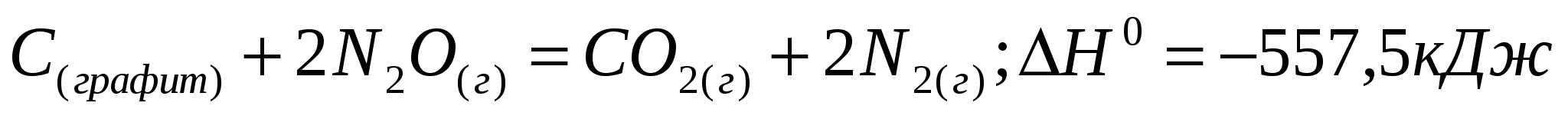
Вычислите теплоту сгорания этилена, если теплота его образования
равна 52,3 кДж/моль. Каков тепловой эффект сгорания 5 л этилена?
Вычислите 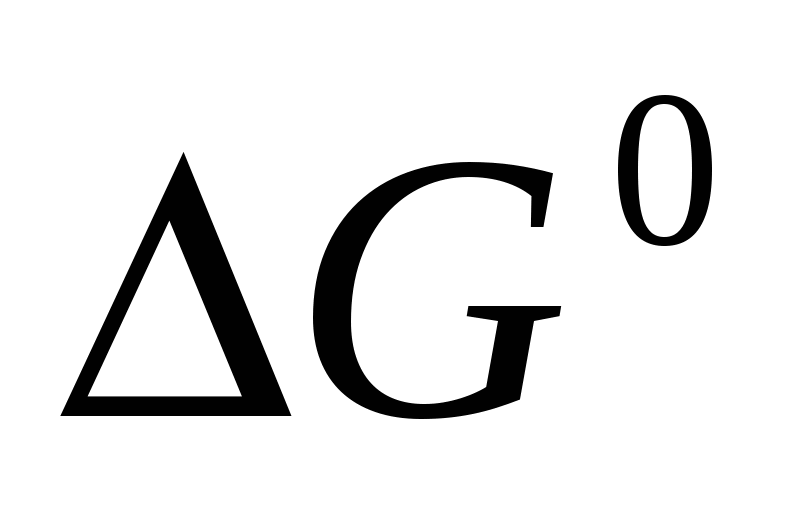 образования метана, этана и аммиака, исходя из значений образования метана, этана и аммиака, исходя из значений 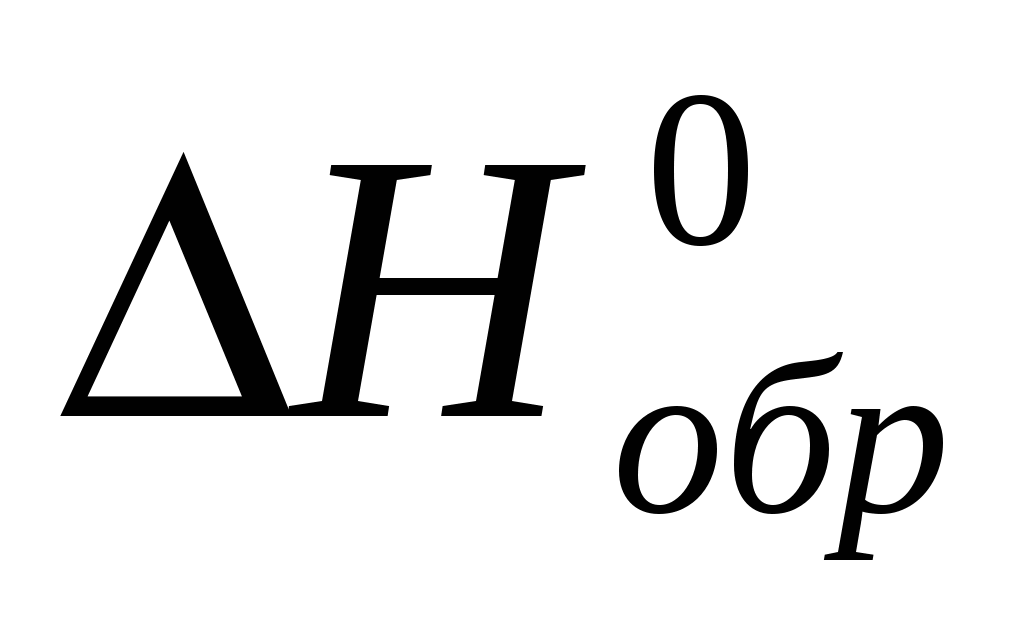 и изменения энтропии и изменения энтропии 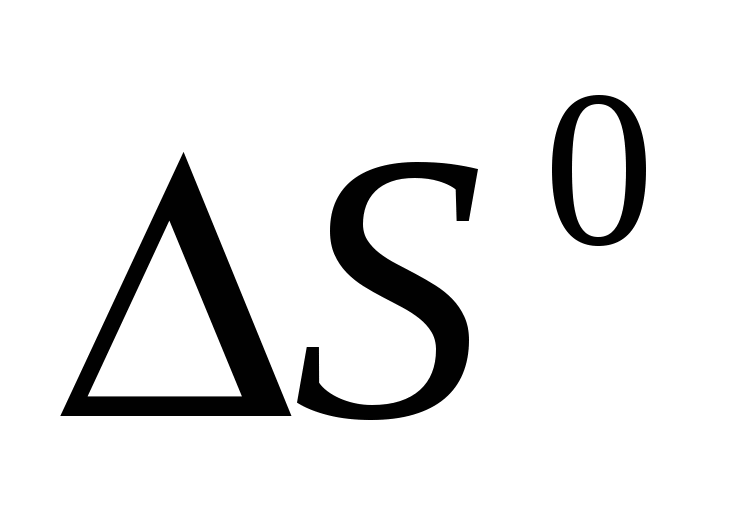 . Полученные величины сравните со справочными данными. . Полученные величины сравните со справочными данными.
Рассчитайте температурный коэффициент реакции, если при нагревании системы от 40° до 80° скорость возросла в 64 раза.
Вычислите константу равновесия для следующей реакции 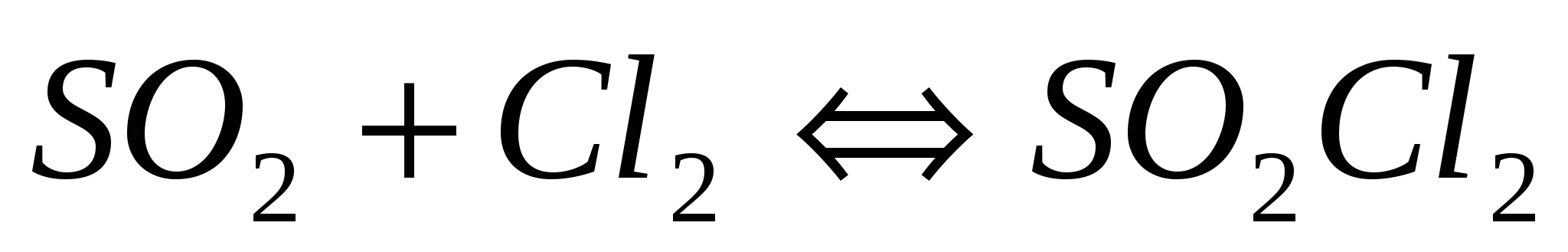 , если при некоторой температуре образовалось 2,3 моль , если при некоторой температуре образовалось 2,3 моль 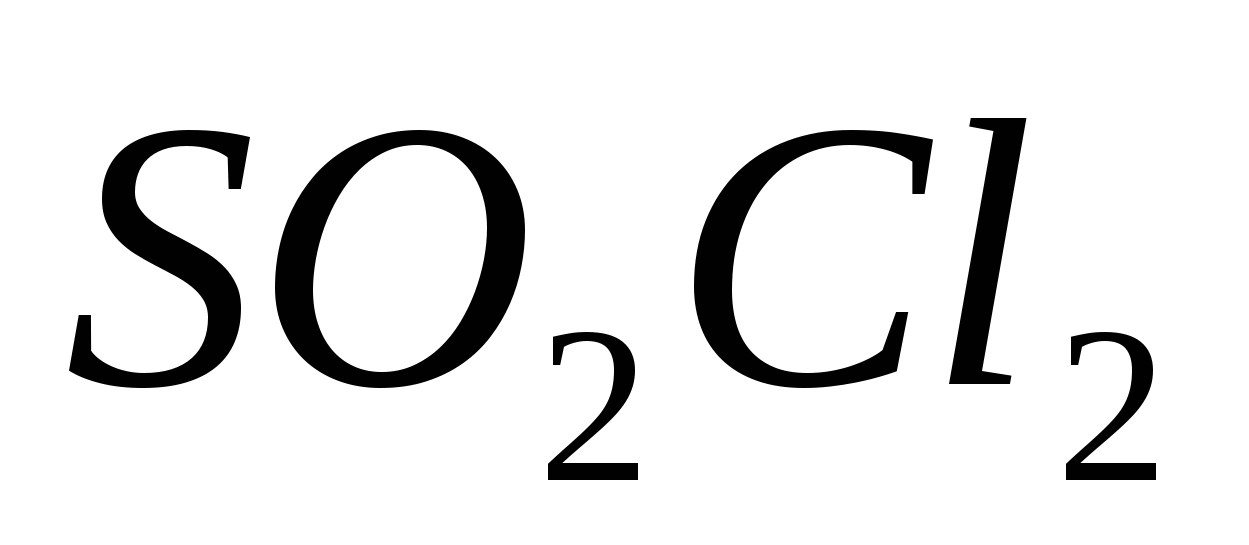 , а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/л и 5,5 моль/л. , а исходные концентрации двуокиси серы и хлора соответственно составляли 6,2 моль/л и 5,5 моль/л.
Рассчитайте молярную концентрацию эквивалента концентрированной соляной кислоты (плотность 1,18 г/см3), содержащей 38 % (масс.) 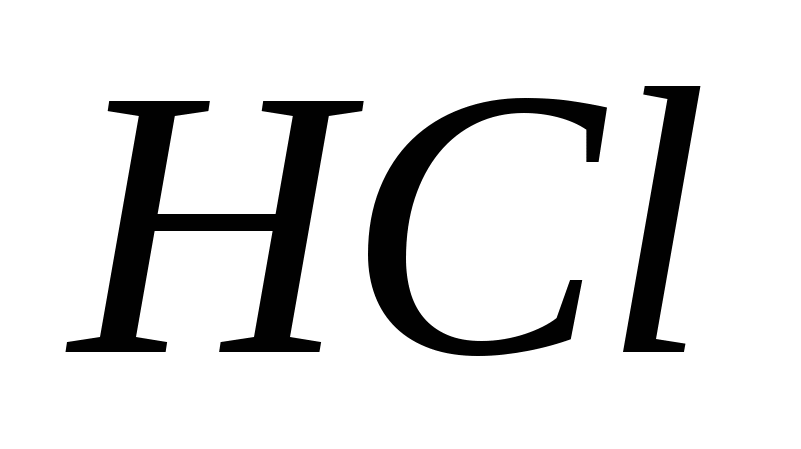 . .
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: 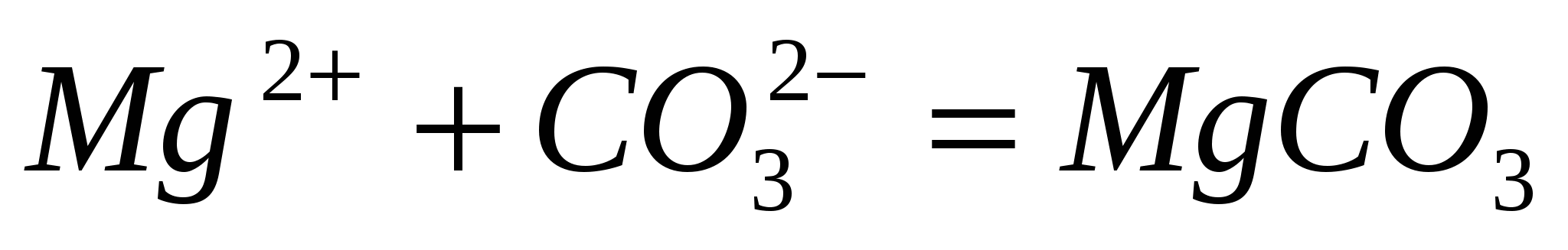 ; ; 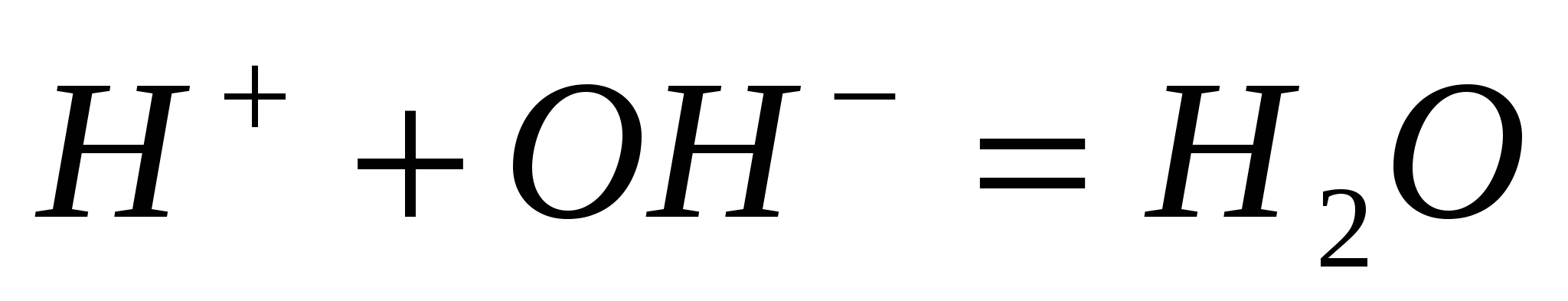 . .
Разбавленный раствор сахара 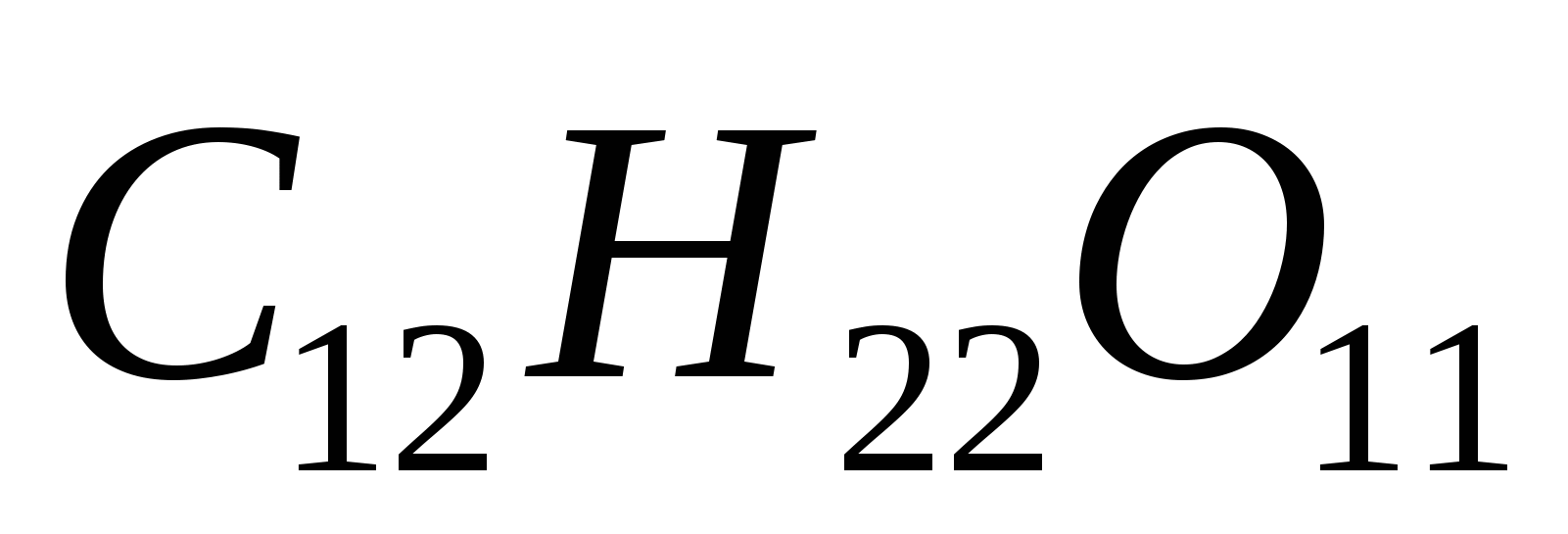 кипит при 100,065ºС. Вычислите осмотическое давление раствора при 0ºС, приняв плотность раствора равной единице. кипит при 100,065ºС. Вычислите осмотическое давление раствора при 0ºС, приняв плотность раствора равной единице.
Составьте уравнения полной электролитической диссоциации для сильных электролитов: 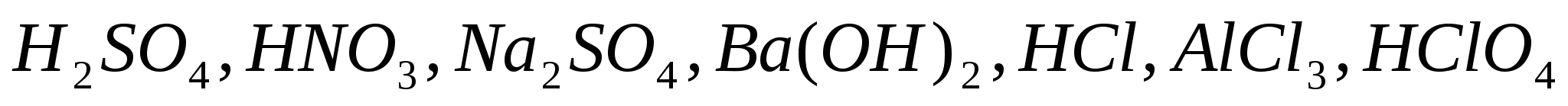 . .
Какие из солей 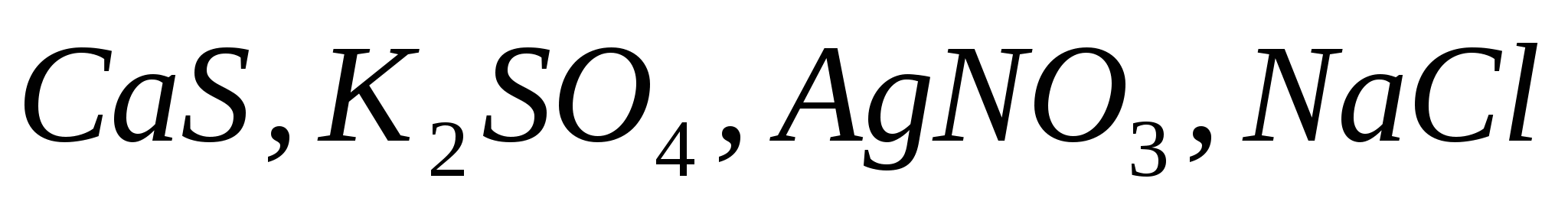 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей. подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей.
Вариант 18.
Вычислите теплоту образования карбида кальция 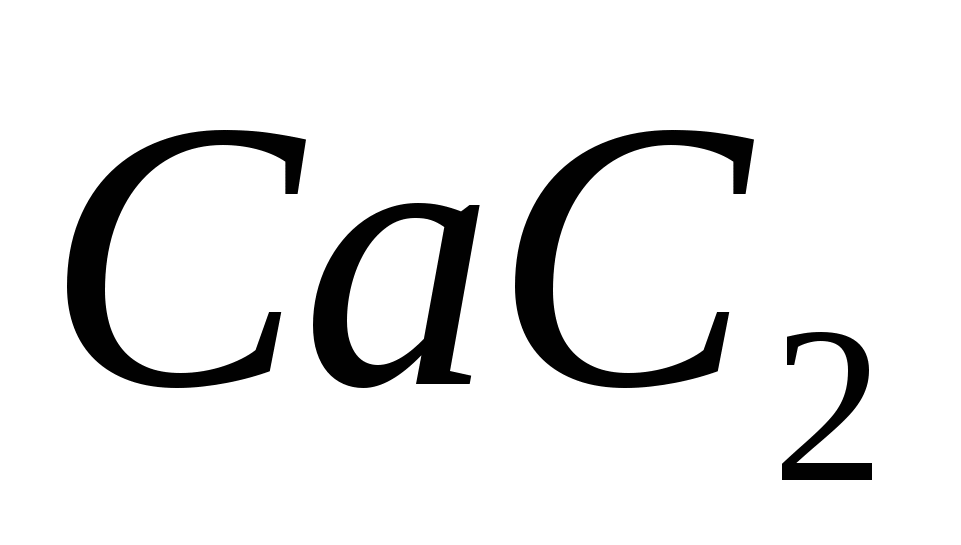 , пользуясь термохимическим уравнением: , пользуясь термохимическим уравнением: 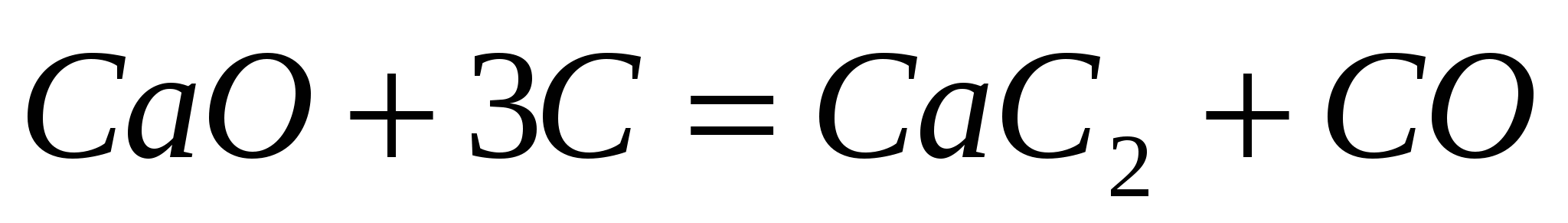 ; ;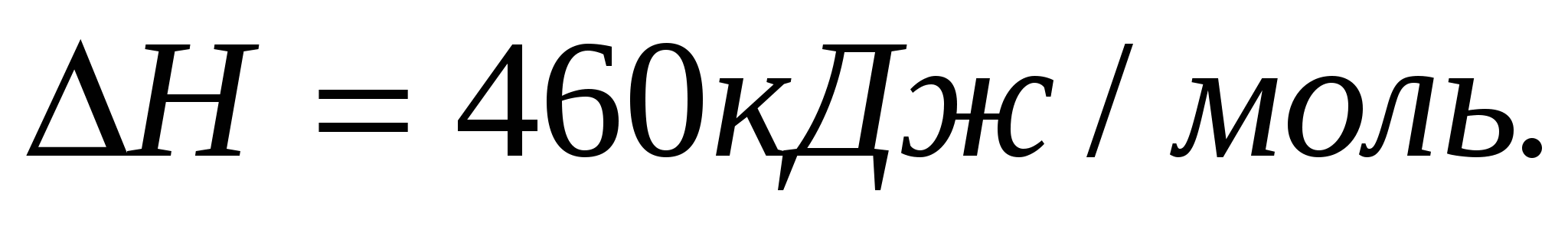
Вычислите энергию Гиббса следующих реакций и определите, в каком направлении они будут протекать, если все вещества взяты при стандартных условиях:  ; ;
Температурный коэффициент реакции равен 3. При какой температуре следует проводить эту реакцию, чтобы скорость реакции, идущей при 100°С, уменьшилась в 27 раз?
Вычислите константу равновесия реакции 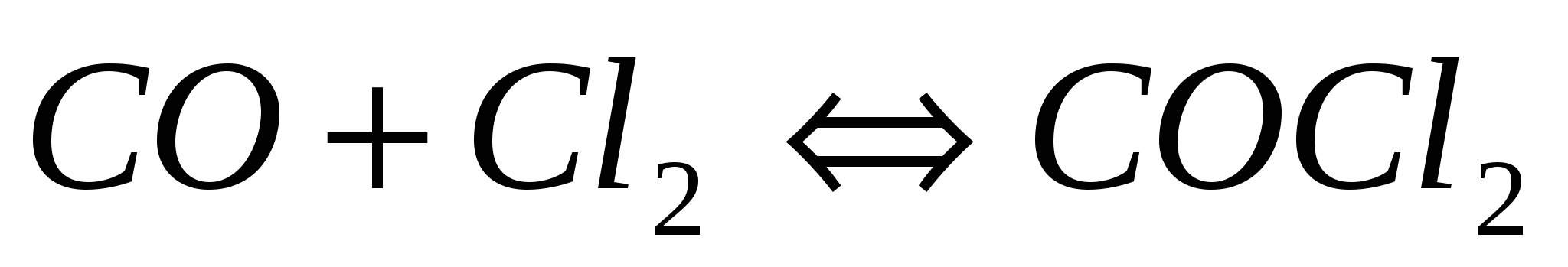 , если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль , если исходные концентрации оксида углерода и хлора составляли соответственно 6 и 8 моль/л, а равновесие установилось, когда образовалось 3 моль 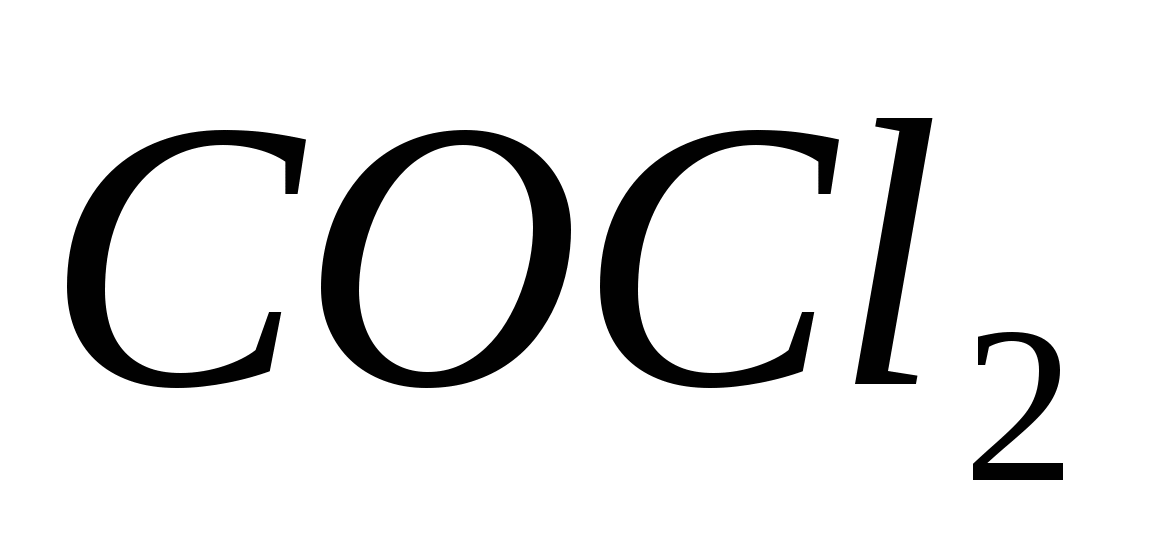 . .
До какого объема нужно довести раствор, содержащий 250 г медного купороса 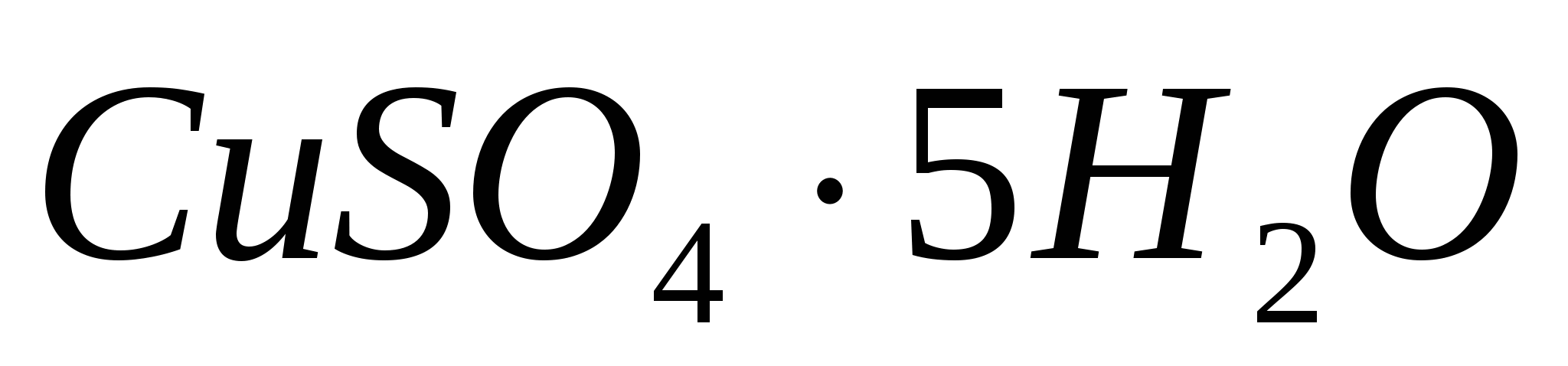 , чтобы молярная концентрация эквивалента (нормальность) полученного раствора была 0.5 н? , чтобы молярная концентрация эквивалента (нормальность) полученного раствора была 0.5 н?
Какое из веществ: гидроксид алюминия, серная кислота, гидроксид бария - будет взаимодействовать с гидроксидом натрия? Составьте уравнения соответствующих реакций в молекулярном и ионно-молекулярном виде.
Вычислите температуру кристаллизации раствора мочевины 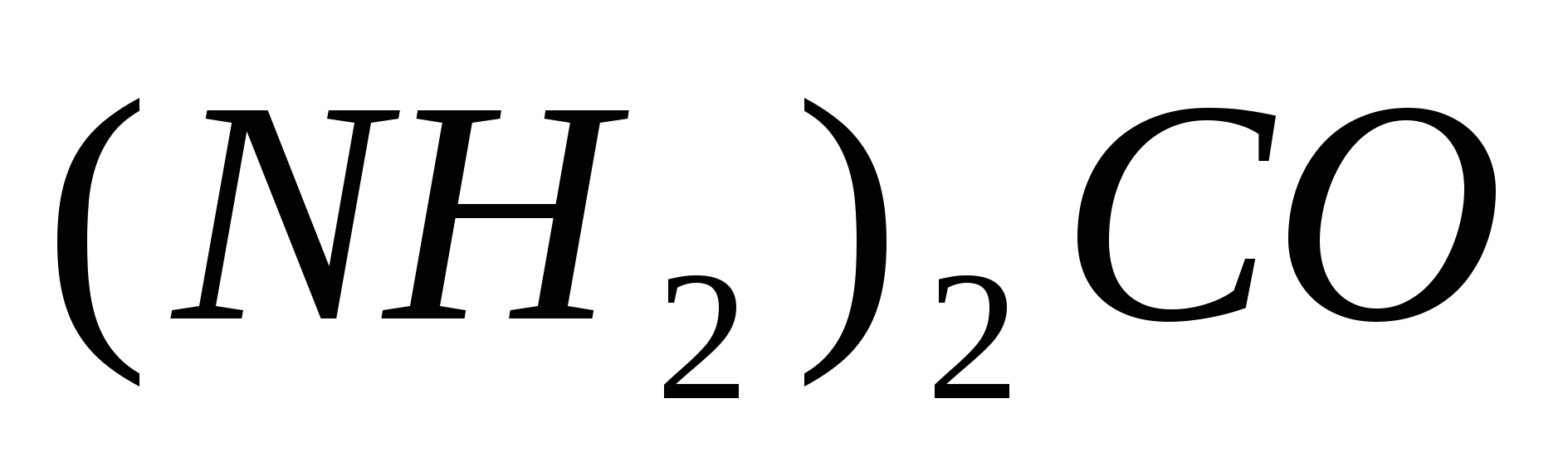 , содержащего 10 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86º. , содержащего 10 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86º.
Увеличится или уменьшится концентрация ионов водорода в растворах кислот при введении в них одноименных анионов: а)  ; б) ; б)  ; в) ; в)  ; г) ; г) 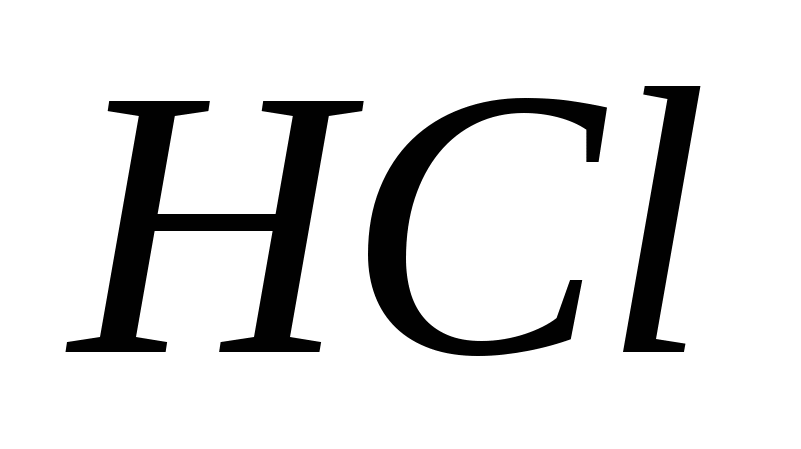 . .
Какие из солей 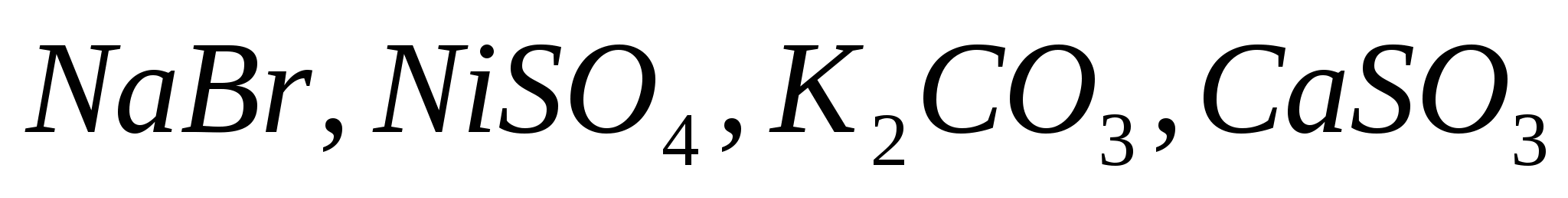 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей. подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей.
Вариант 19.
При сгорании 1 л ацетилена выделяется 58,2 кДж. Вычислите 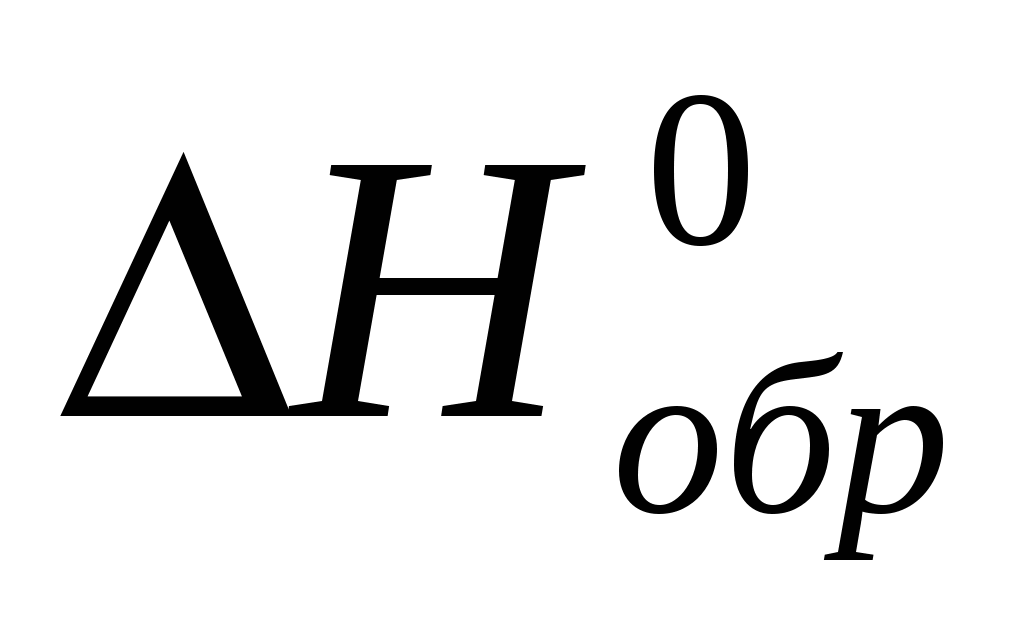 ацетилена. ацетилена.
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите 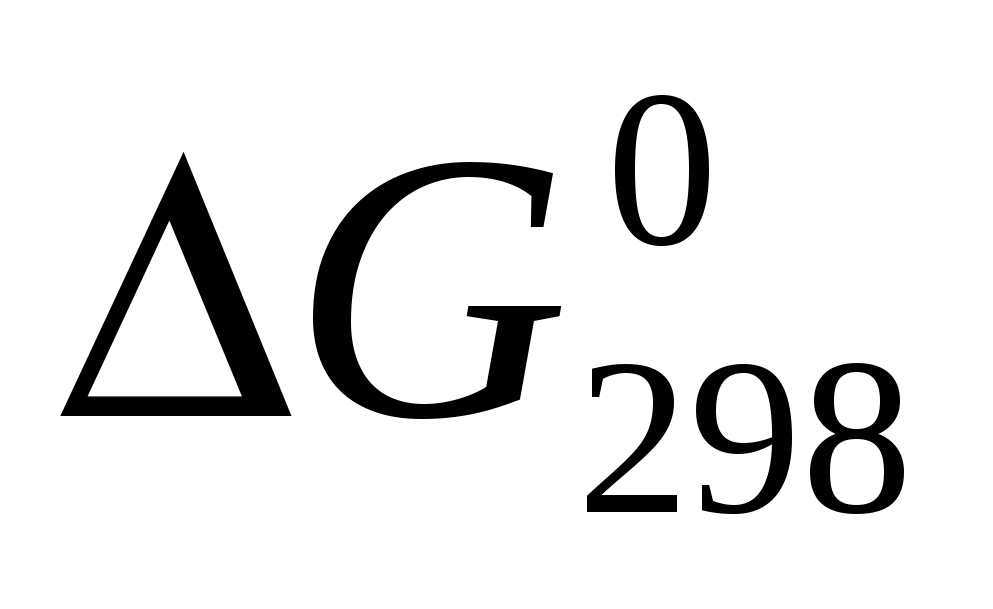 , протекающей по уравнению , протекающей по уравнению 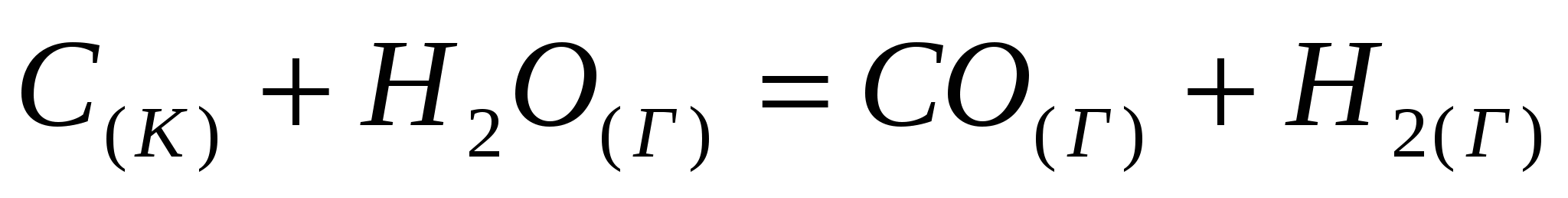 . Возможен ли этот процесс при стандартных условиях? . Возможен ли этот процесс при стандартных условиях?
Как изменится скорость прямой и обратной реакции, если объем газовой смеси 4HCl(г) + O2(г)↔ 2 H2O(г) + 2Cl2(г) увеличить в 2 раза?
Константа равновесия системы 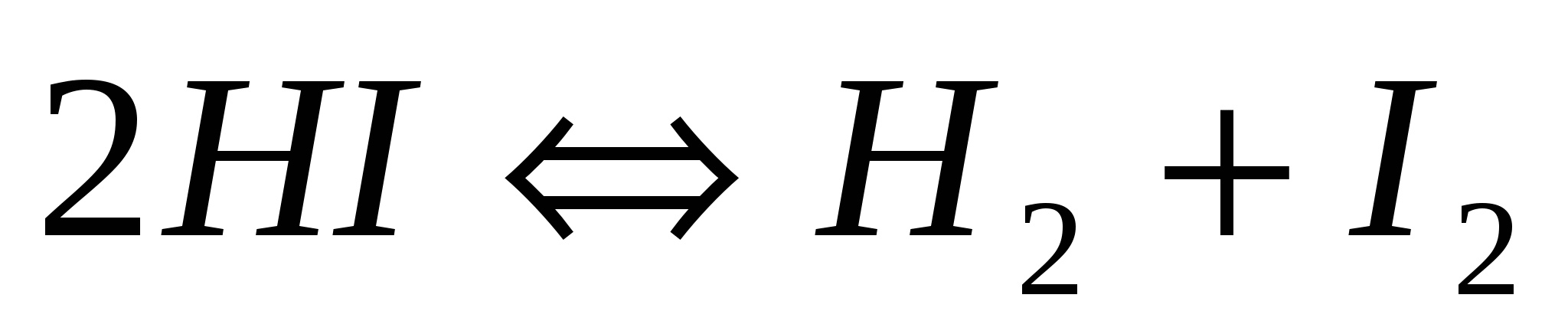 равна 0,35. Определите равновесные концентрации равна 0,35. Определите равновесные концентрации 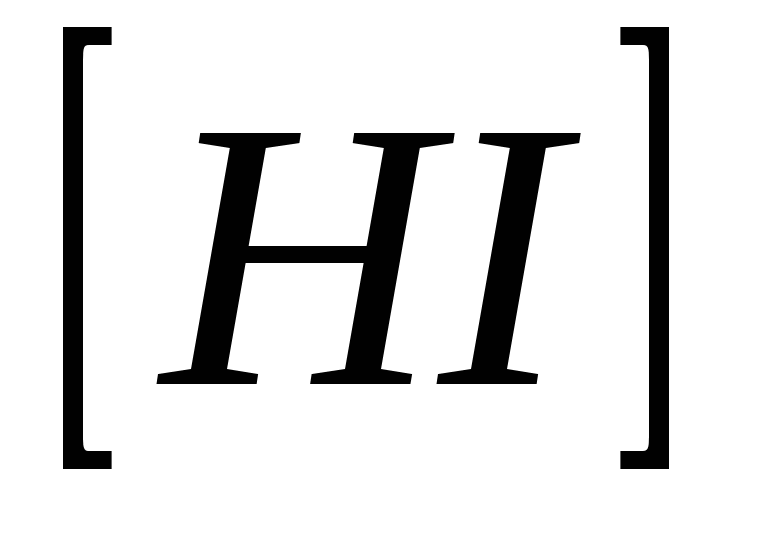 и и 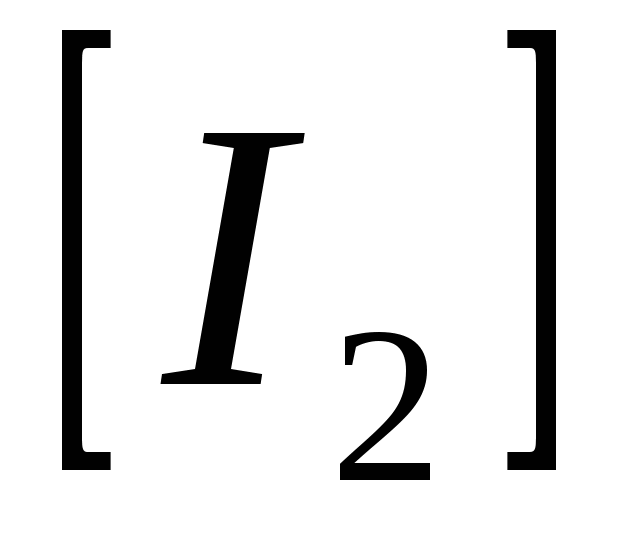 , если исходная концентрация йодоводорода равна 2 моль/л. , если исходная концентрация йодоводорода равна 2 моль/л.
Сколько фосфата натрия нужно взять, чтобы приготовить 2л 0.5 н. раствора? Какова молярность раствора?
Напишите ионно-молекулярные уравнения реакций:
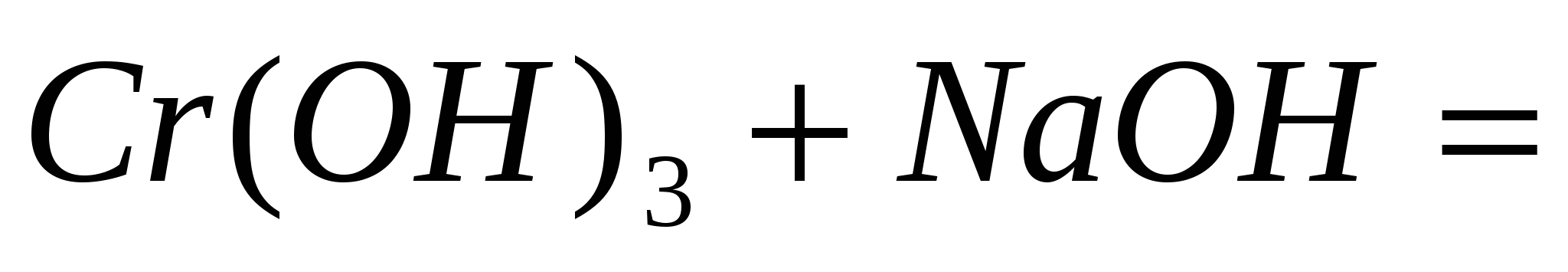 ; ; 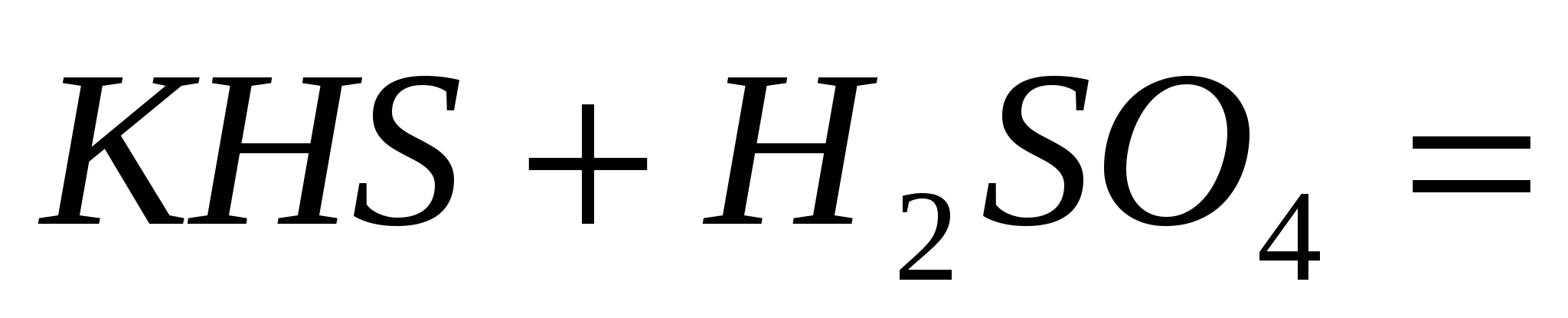 ; ; 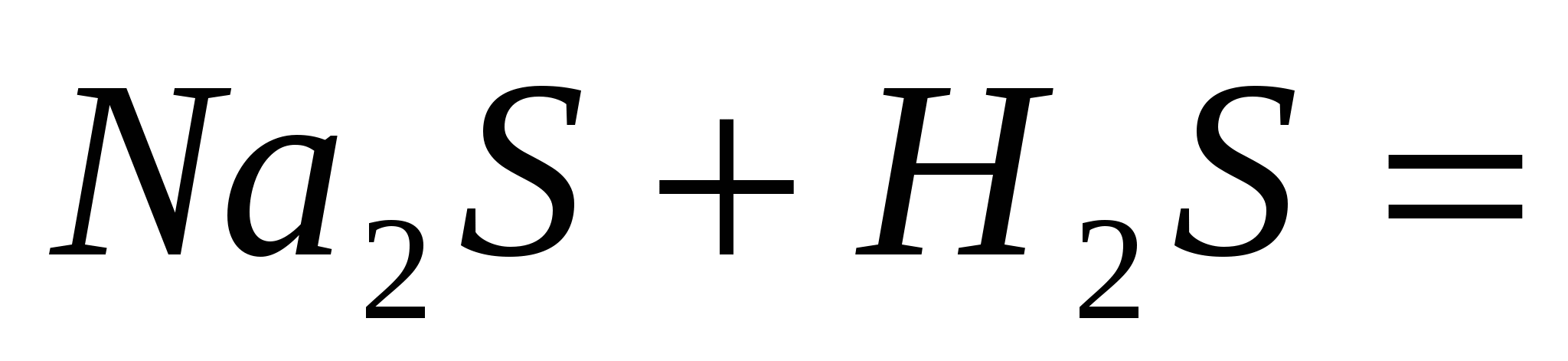 . .
Вычислите температуру кристаллизации 10%-ного раствора глицерина 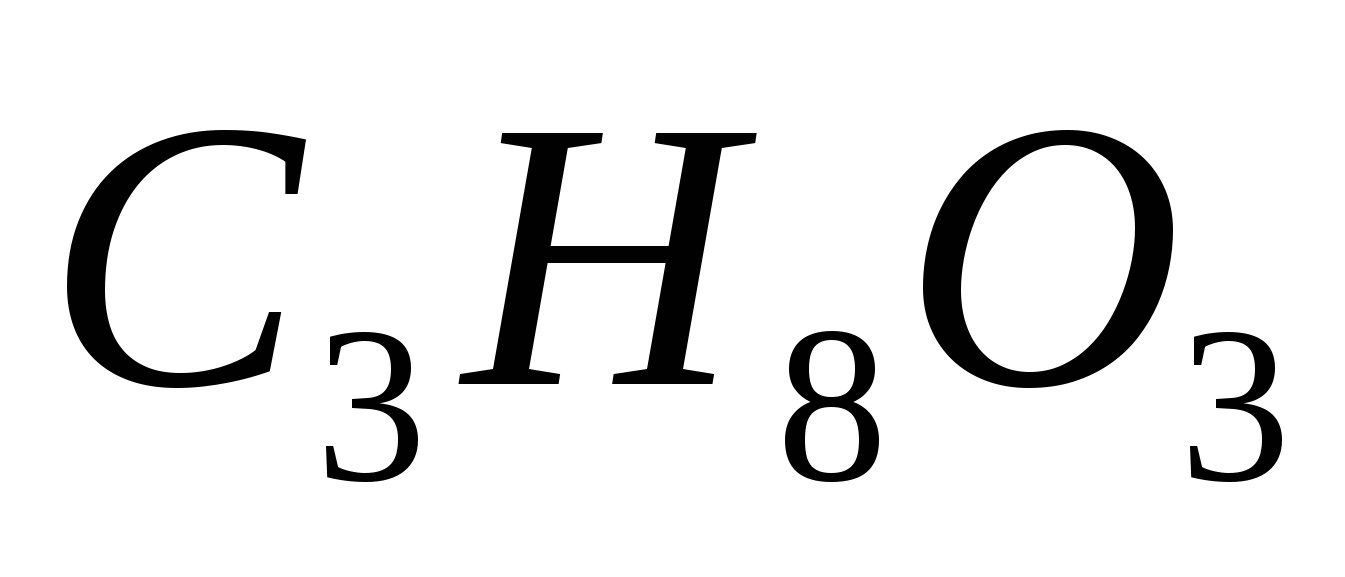 в воде. Криоскопическая константа воды равна 1,860 . в воде. Криоскопическая константа воды равна 1,860 .
Как влияет разбавление раствора на процесс диссоциации слабых и сильных электролитов. Объяснить на примерах.
Какие из солей 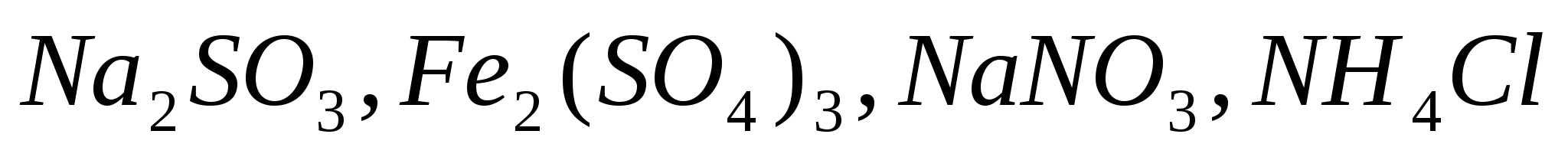 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей. подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза, укажите значение рН растворов этих солей.
Вариант 20.
Вычислите тепловой эффект реакции гидрирования этилена 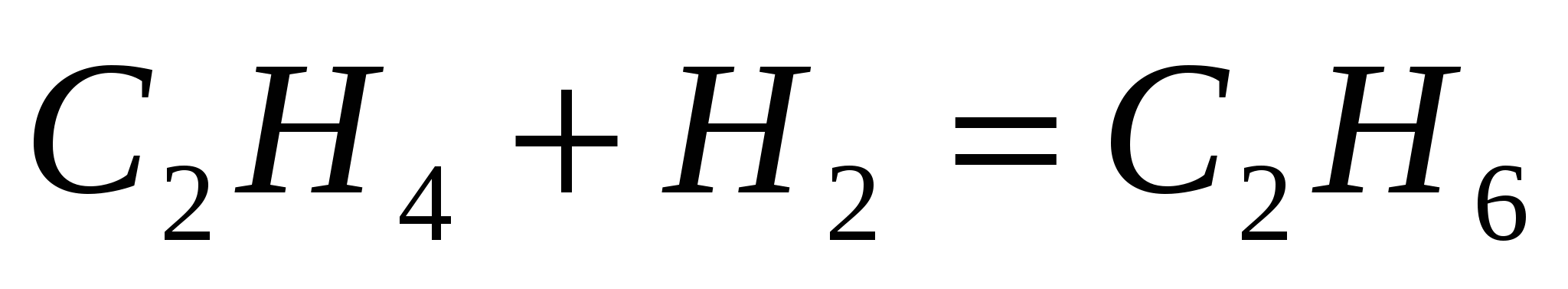 , если теплоты сгорания этана и этилена соответственно равны –1560 и –1411 кДж/моль. , если теплоты сгорания этана и этилена соответственно равны –1560 и –1411 кДж/моль.
Запишите в общем виде формулу для определения энтропии следующей реакции 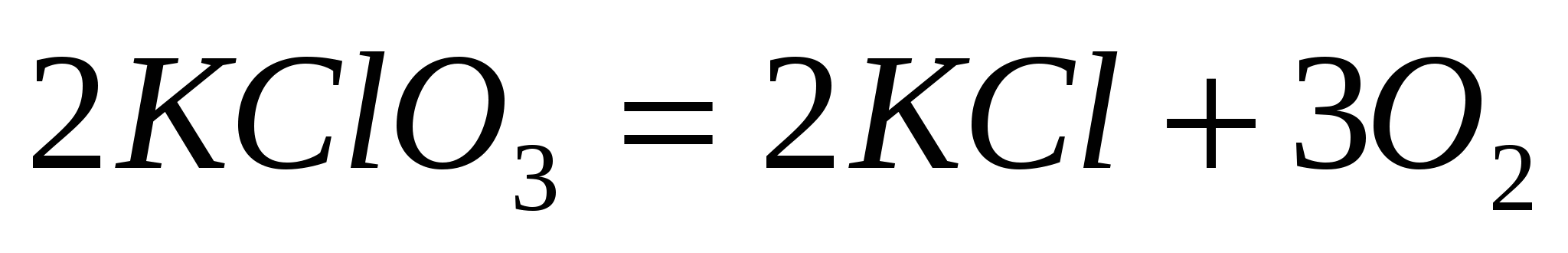 и, используя справочные данные, рассчитайте ее величину. и, используя справочные данные, рассчитайте ее величину.
Во сколько раз следует увеличить давление в газообразной системе 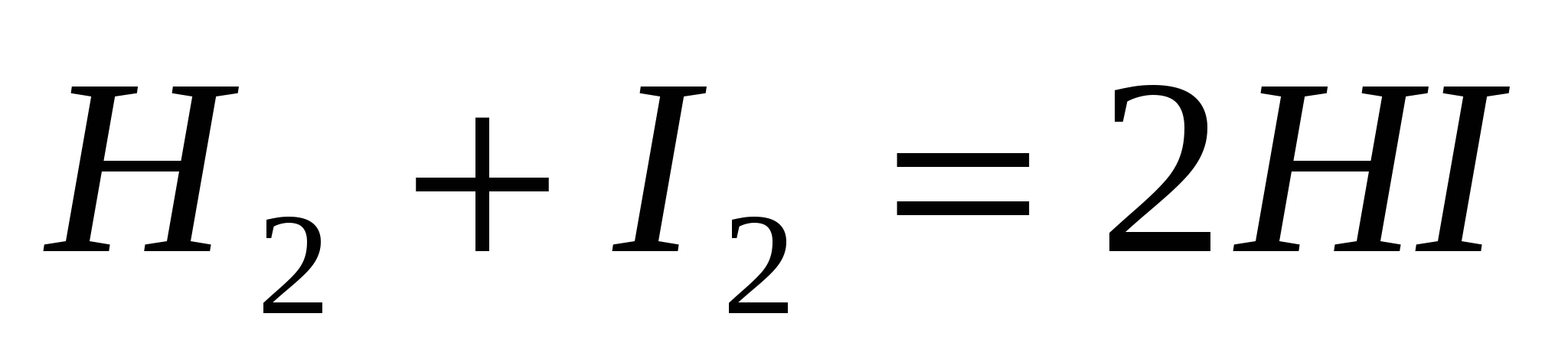 , чтобы скорость образования HI возросла в 100 раз? , чтобы скорость образования HI возросла в 100 раз?
Вычислите равновесные концентрации веществ в реакции 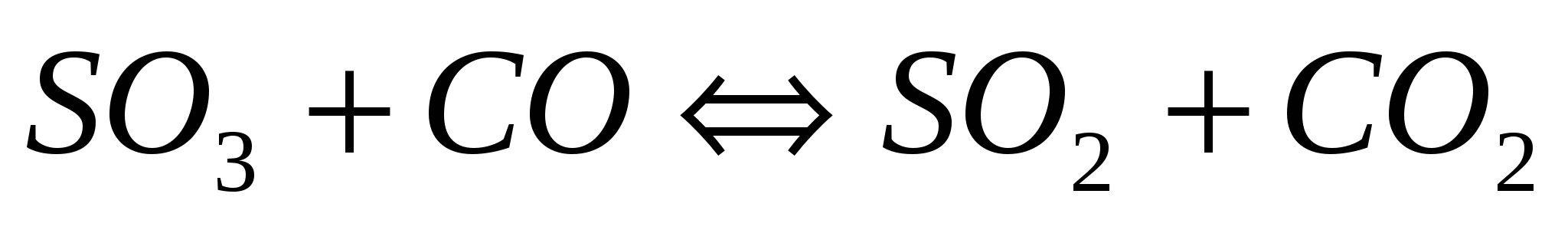 , если константа равновесия реакции равна 1,89, а исходная концентрация , если константа равновесия реакции равна 1,89, а исходная концентрация 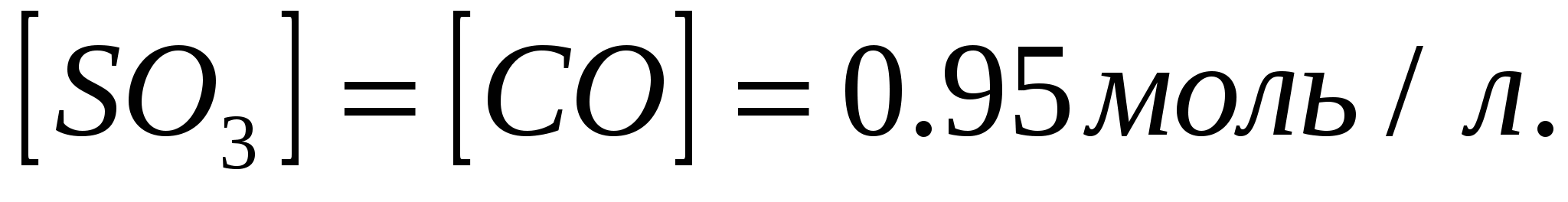
До какого объема нужно довести раствор при растворении 20 г хлорида магния, чтобы концентрация полученного раствора была 0.25М?
Выразите ионными и молекулярными уравнениями следующие процессы: а) взаимодействие дигидрофосфата кальция с гидроксидом кальция; б) взаимодействие гидросульфида калия с гидроксидом калия.
Вычислите процентную концентрацию водного раствора глицерина 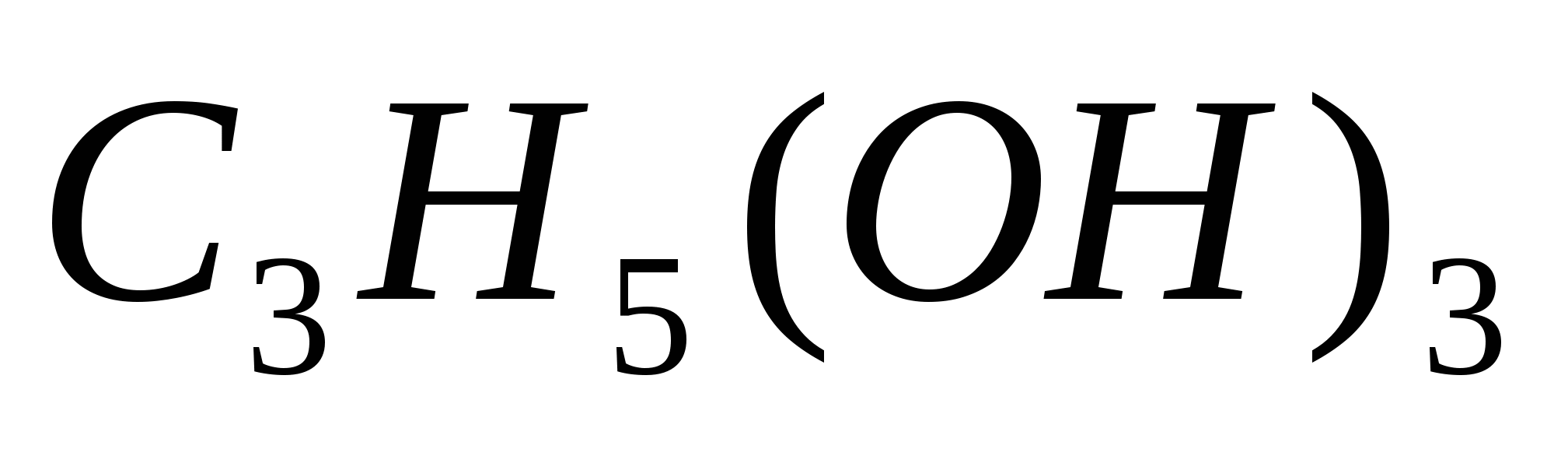 , зная, что этот раствор кипит при 100,45ºС. Эбуллиоскопическая константа воды равна 0,52º. , зная, что этот раствор кипит при 100,45ºС. Эбуллиоскопическая константа воды равна 0,52º.
Вычислите концентрацию катионов водорода (моль/л) в 0,025 м растворе сернистой кислоты, константа диссоциации которой составляет 1,7·10-2.
Какое значение рН (>7< ) имеют растворы следующих солей: 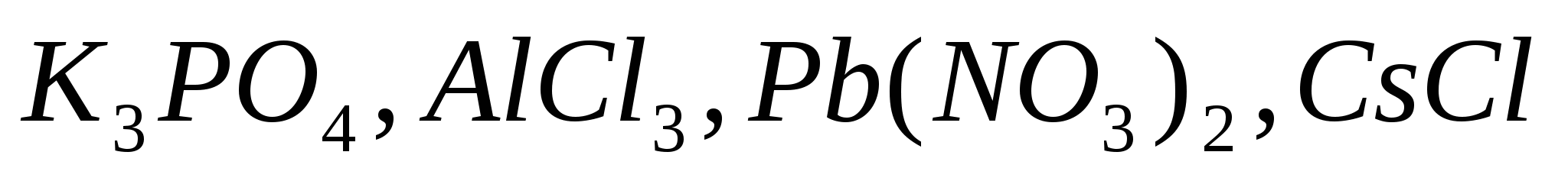 ? Составьте ионно-молекулярные уравнения гидролиза. ? Составьте ионно-молекулярные уравнения гидролиза.
Вариант 21.
Теплоты сгорания бензола и ацетилена соответственно составляют
–3268 и –1301 кДж/моль. Вычислите энтальпию реакции 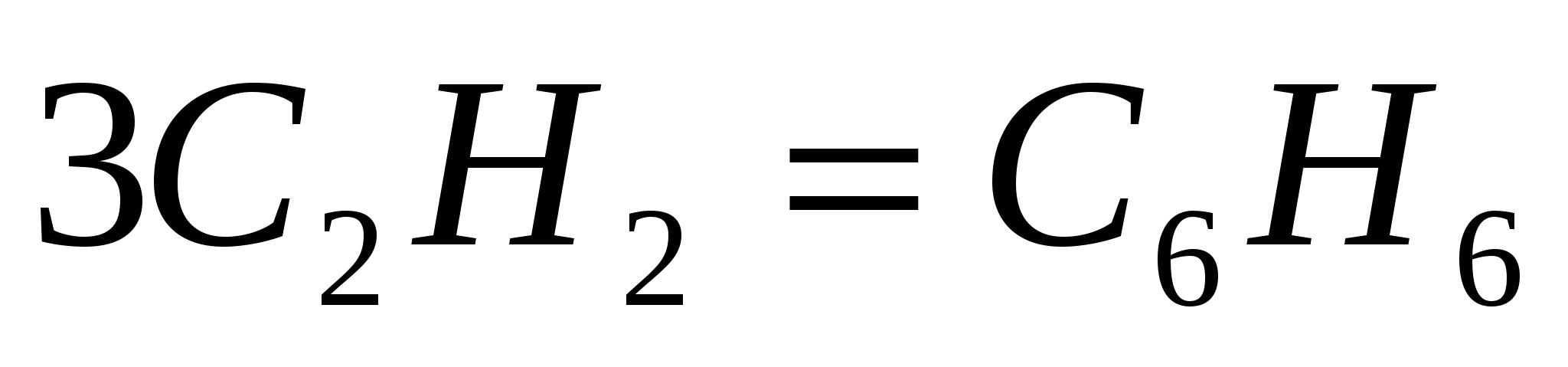 . .
Вычислите 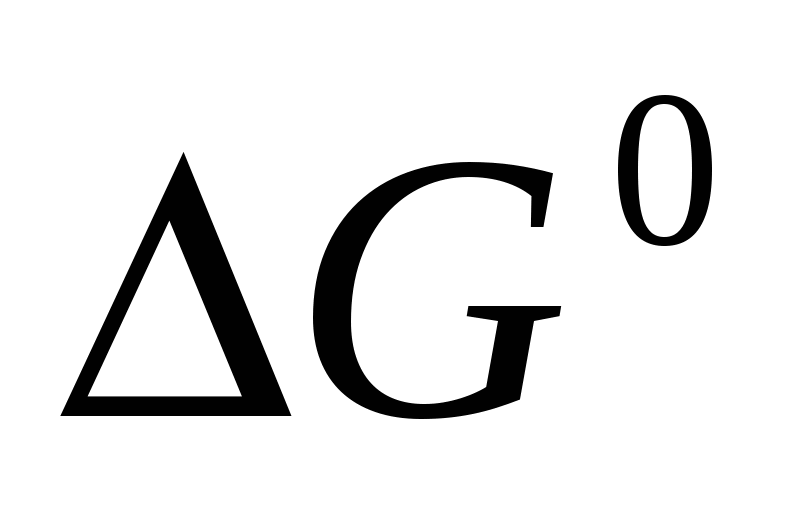 образования пропана, хлороводорода и диоксида углерода, исходя из значений образования пропана, хлороводорода и диоксида углерода, исходя из значений 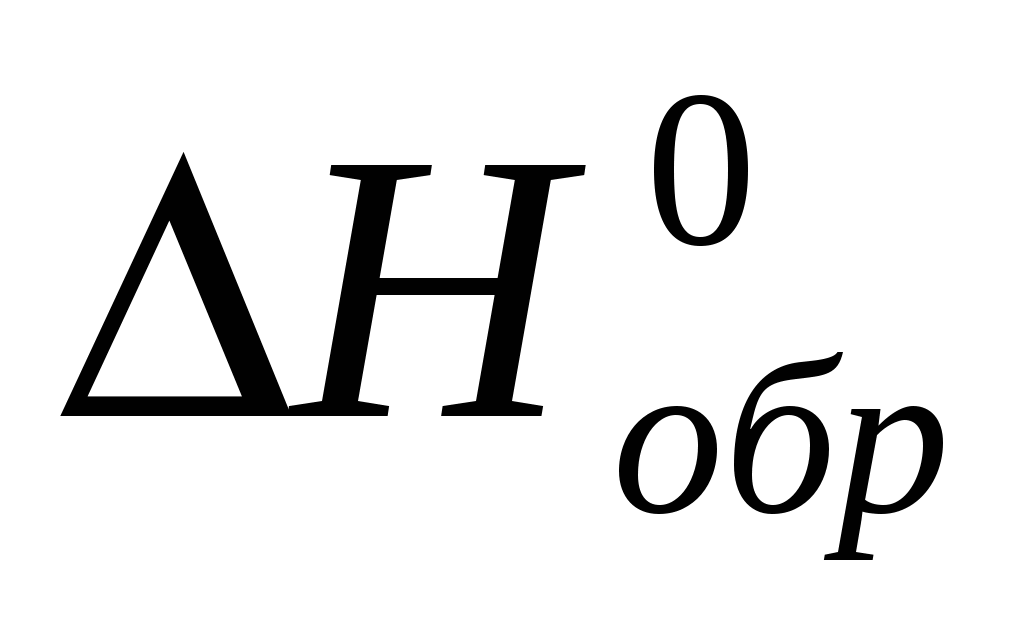 и изменения энтропии и изменения энтропии 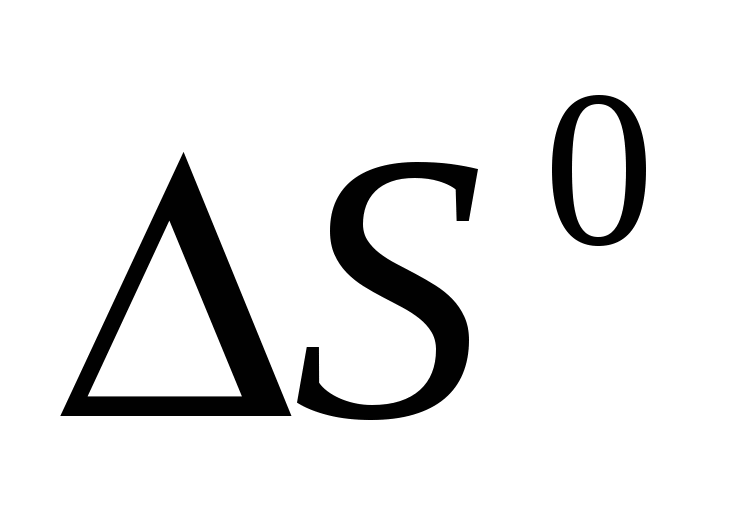 . Полученные величины сравните со справочными данными. . Полученные величины сравните со справочными данными.
Напишите скорости выражения реакций, протекающих по схеме А+В=АВ, если а) А и В – газообразные вещества; б) А и В – жидкости, смешивающиеся в любых пропорциях.
При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2]=1,5, [H2]=0,8, [NH3]=2,7 моль/л. Рассчитайте значение константы равновесия и исходные концентрации реагирующих веществ.
Плотность 15%-ного (по массе) раствора серной кислоты равна 1.105 г/см3. Вычислить нормальность и молярность раствора.
Закончите молекулярные и составьте ионно-молекулярные уравнения процессов, проходящих по схемам: 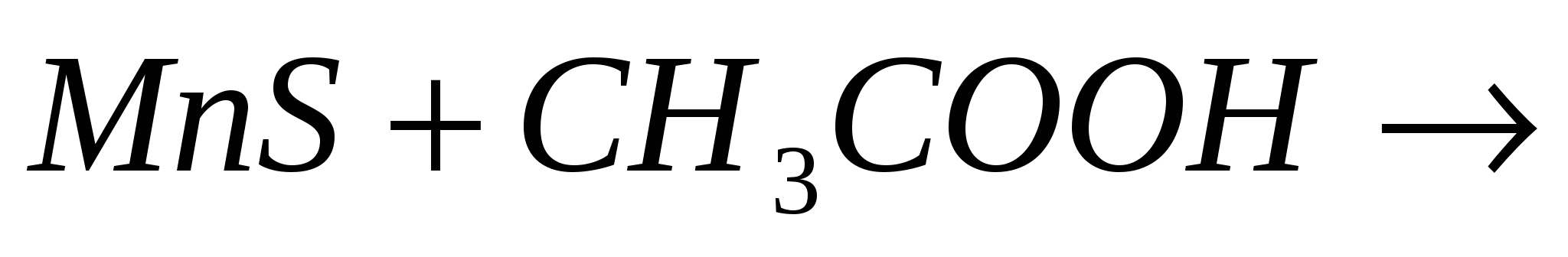 …; …;  …. ….
Раствор, содержащий 2,24 г некоторого вещества в 250 г воды, кристаллизуется при – 0,281ºС. Вычислите мольную массу растворенного вещества, зная, что криоскопическая константа воды равна 1,86º.
Приведите по три примера электролитической диссоциации средних, кислых и основных солей.
Почему при смешивании растворов сульфата алюминия и сульфида натрия образуется осадок гидроксида алюминия? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения гидролиза.
Вариант 22.
Теплота образования этилового спирта составляет –1409 кДж/моль. Вычислите  реакции реакции 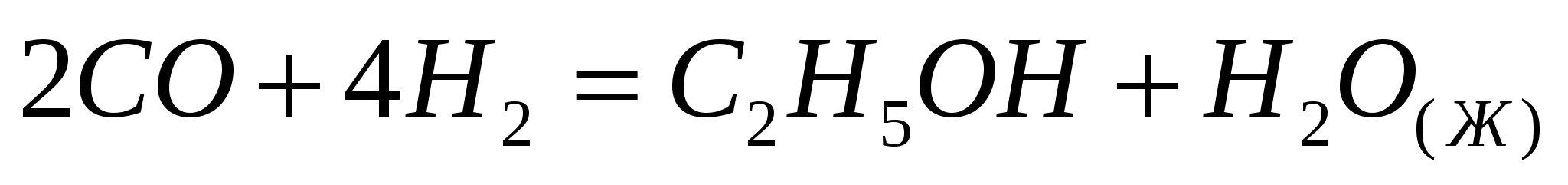 . .
Вычислите температуру, при которой система находится в равновесии, считая, что 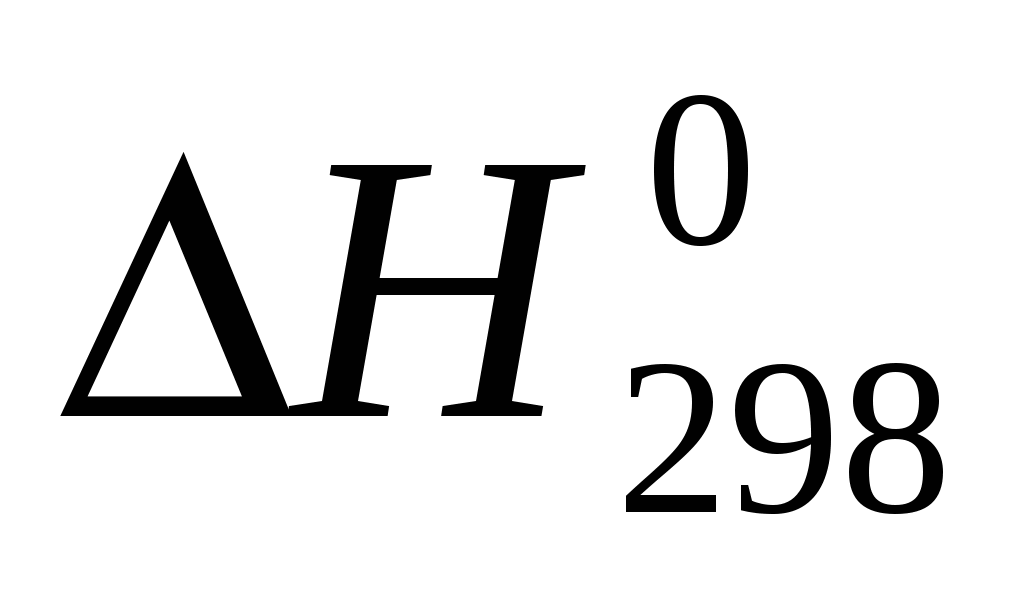 и и 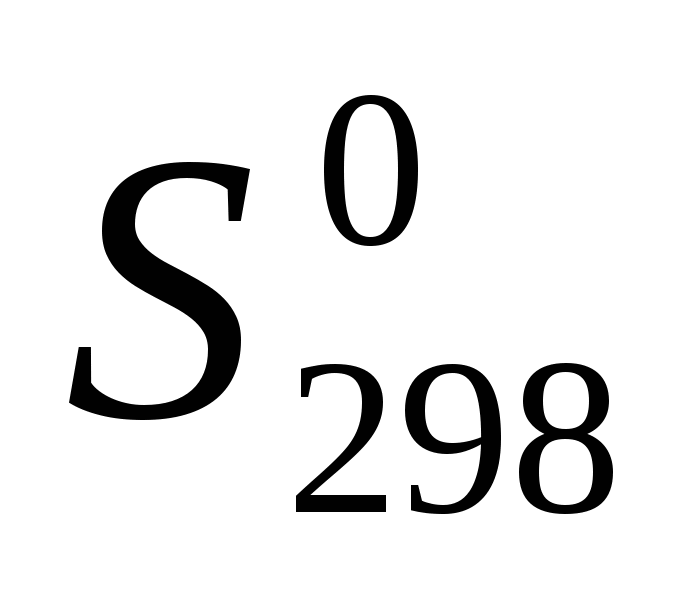 не зависят от температуры: не зависят от температуры:
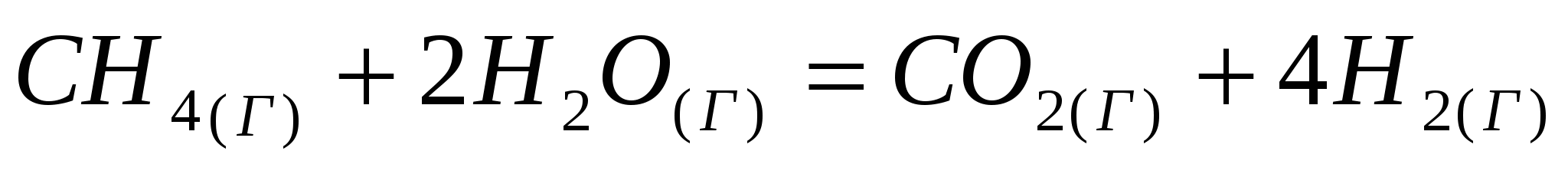 . .
По какому веществу и во сколько раз скорость реакции 2А+3В=С будет меньше, если концентрация вещества А уменьшилась на 0,05 моль/л? Как при этом изменилась концентрация вещества В?
Определите, в какую сторону произойдет смещение равновесия в гомогенных системах: 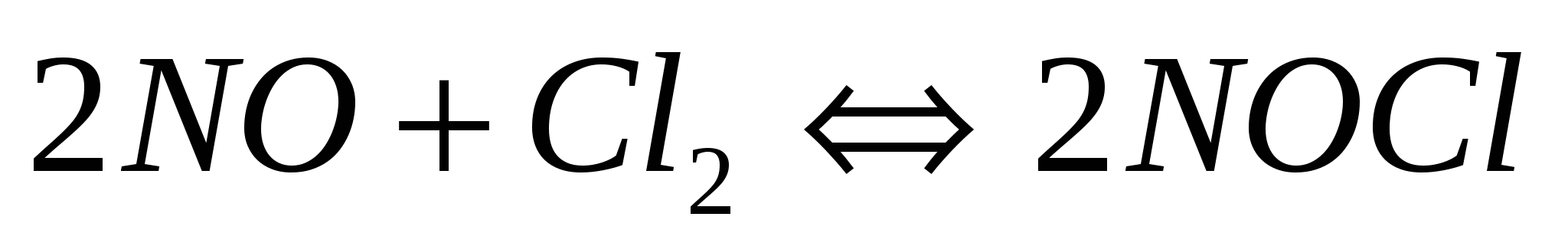 и и 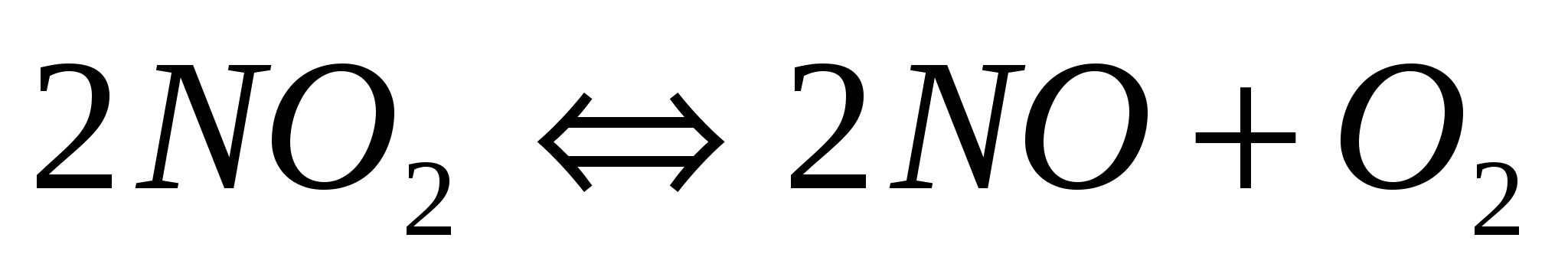
а) при охлаждении системы; б) при уменьшении давления?
Какой объем 30%-ного раствора гидроксида калия, плотность которого 1,29 г/см3, нужно взять, чтобы приготовить 3л 0,5М раствора
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: 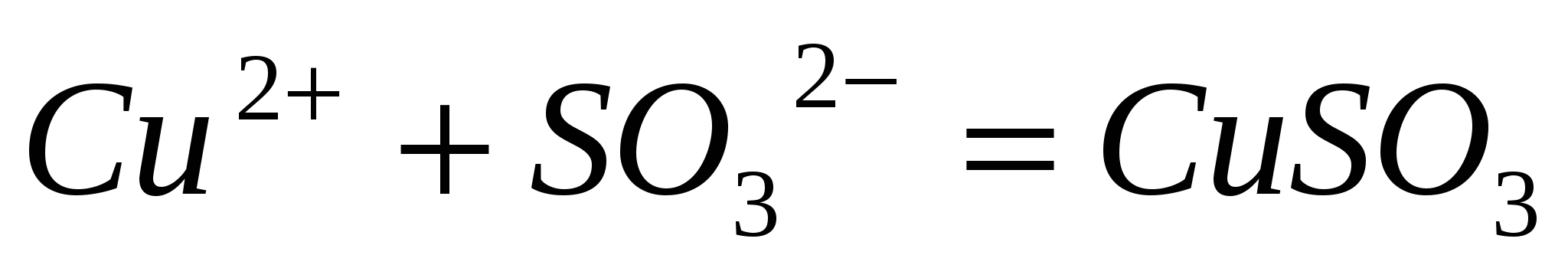 , , 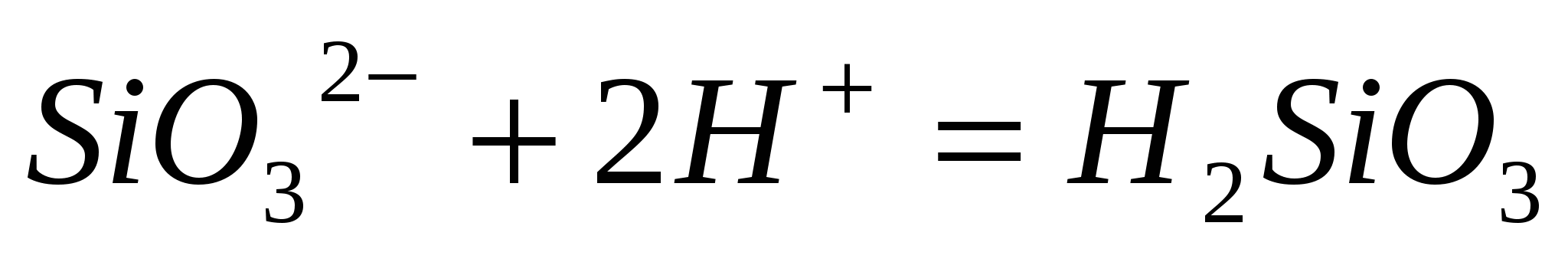 . .
В каком количестве воды следует растворить 0,35 кг глицерина 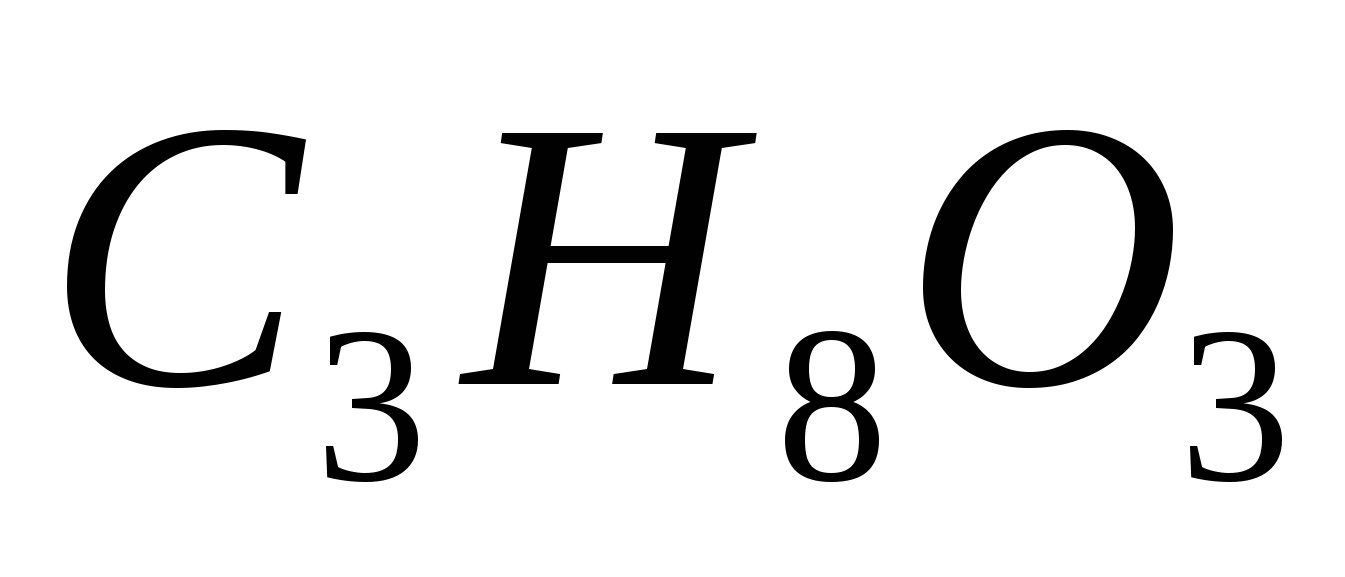 , чтобы получить раствор с температурой кристаллизации – 2,5ºС? Криоскопическая константа воды равна 1,86 0. , чтобы получить раствор с температурой кристаллизации – 2,5ºС? Криоскопическая константа воды равна 1,86 0.
Определите константу диссоциации угольной кислоты по первой ступени, если в 0,2 м растворе степень ее диссоциации равна 0,173 %.
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: 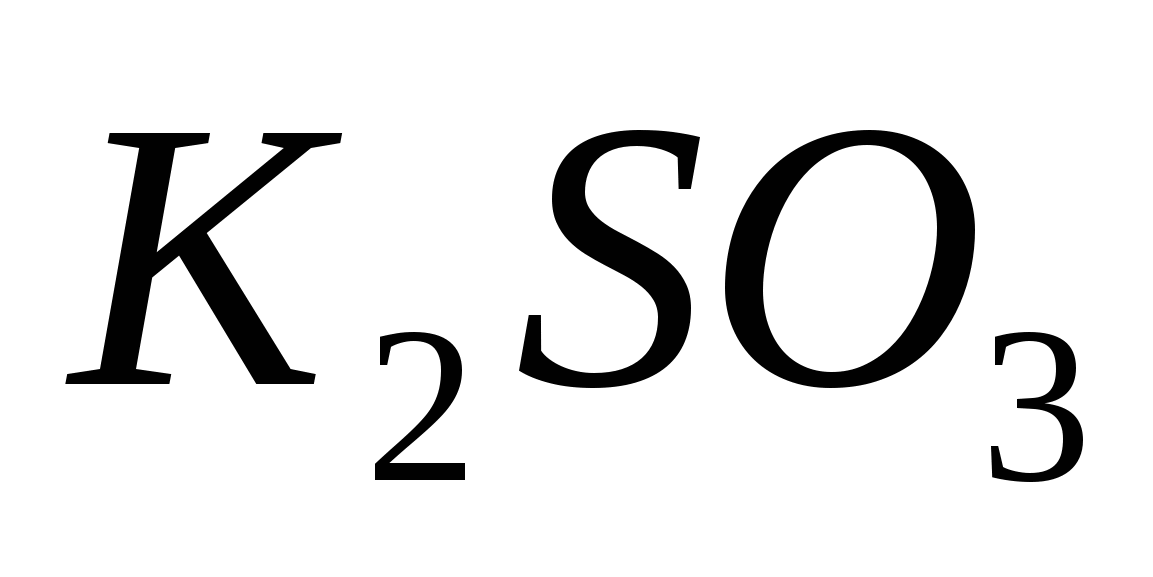 или или 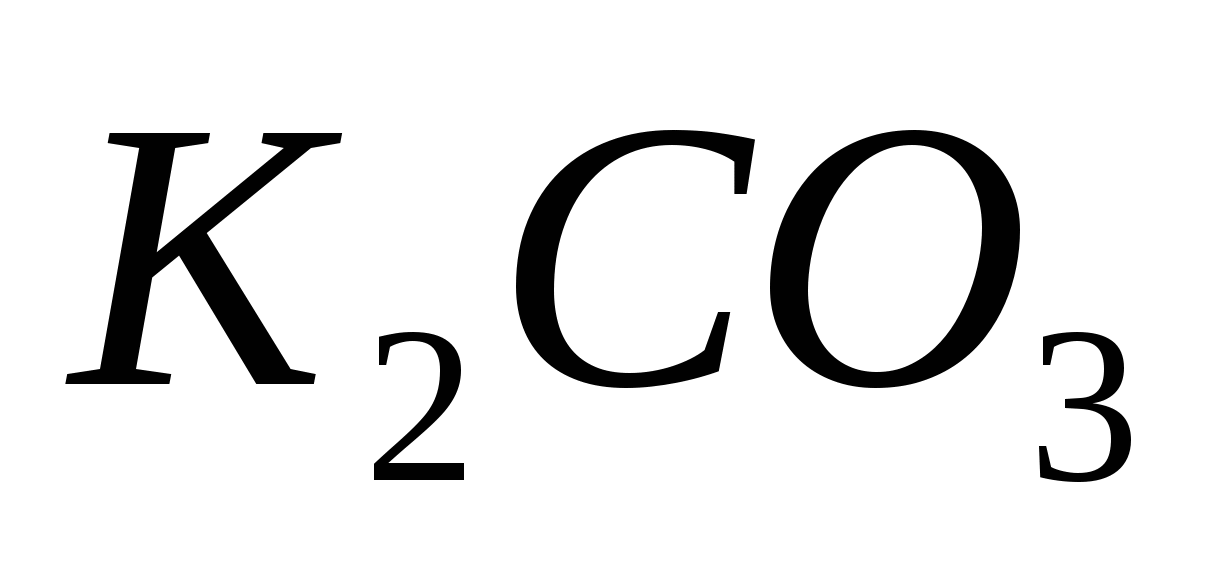 ? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. ? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Вариант 23.
Вычислите количество теплоты, выделившееся при восстановлении 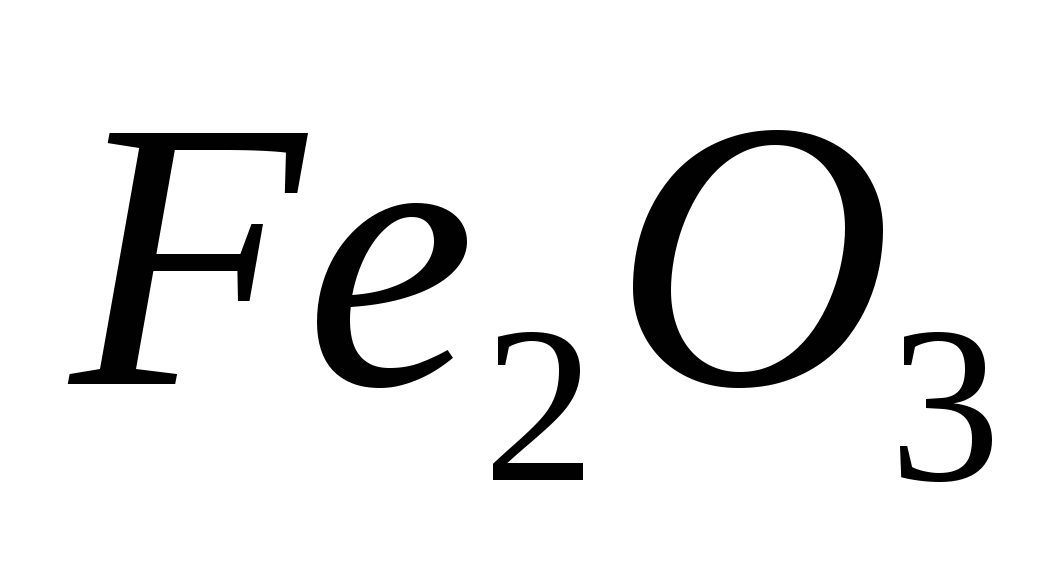 алюминием, если было получено 150 г железа. алюминием, если было получено 150 г железа.
Вычислите 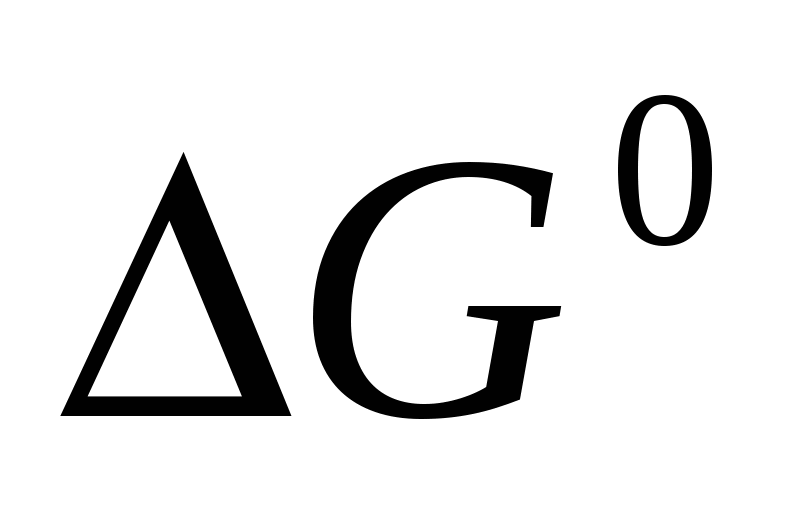 образования оксида азота, сульфида магния и хлорида натрия, исходя из значений образования оксида азота, сульфида магния и хлорида натрия, исходя из значений 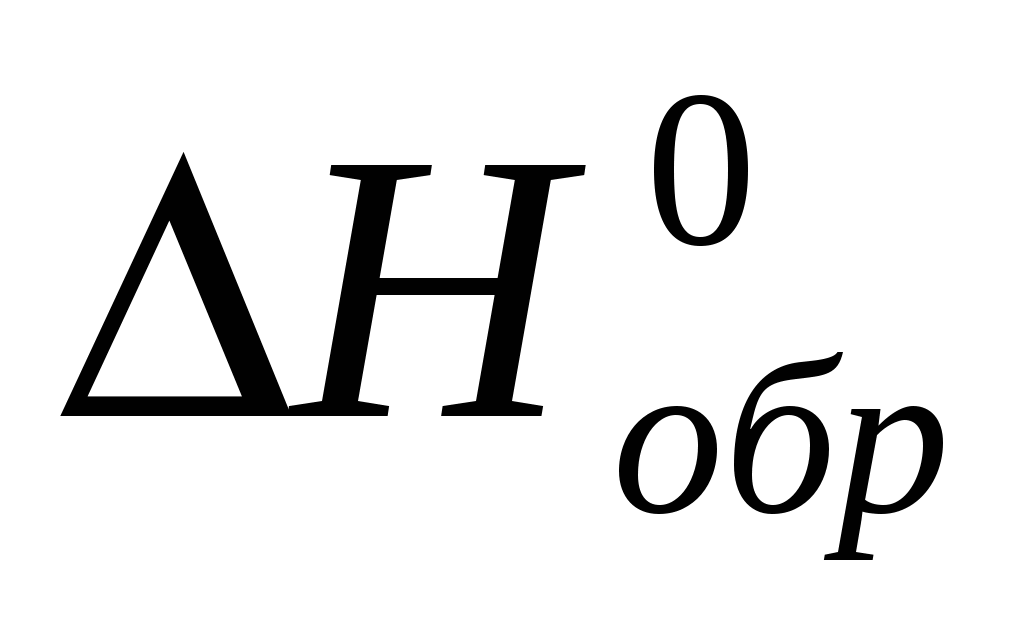 и изменения энтропии и изменения энтропии 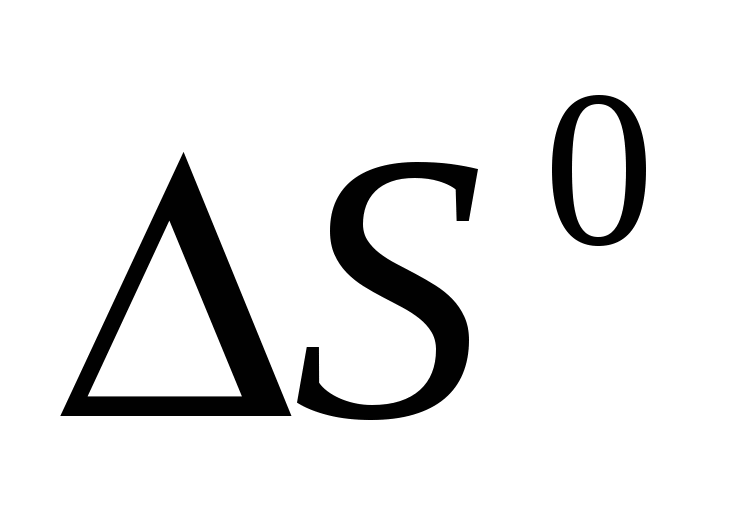 . Полученные величины сравните со справочными данными. . Полученные величины сравните со справочными данными.
Как изменится скорость прямой и обратной реакции, если давление в гомогенной системе 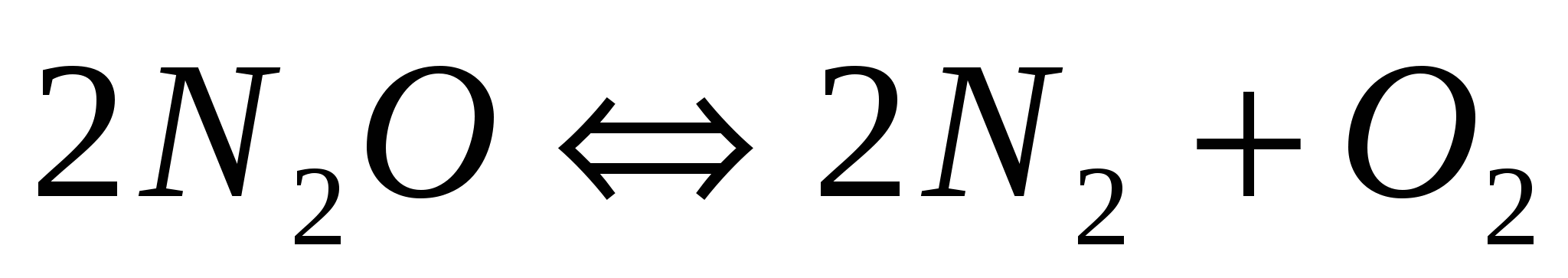 увеличить в 5 раз? увеличить в 5 раз?
Константа равновесия для реакции 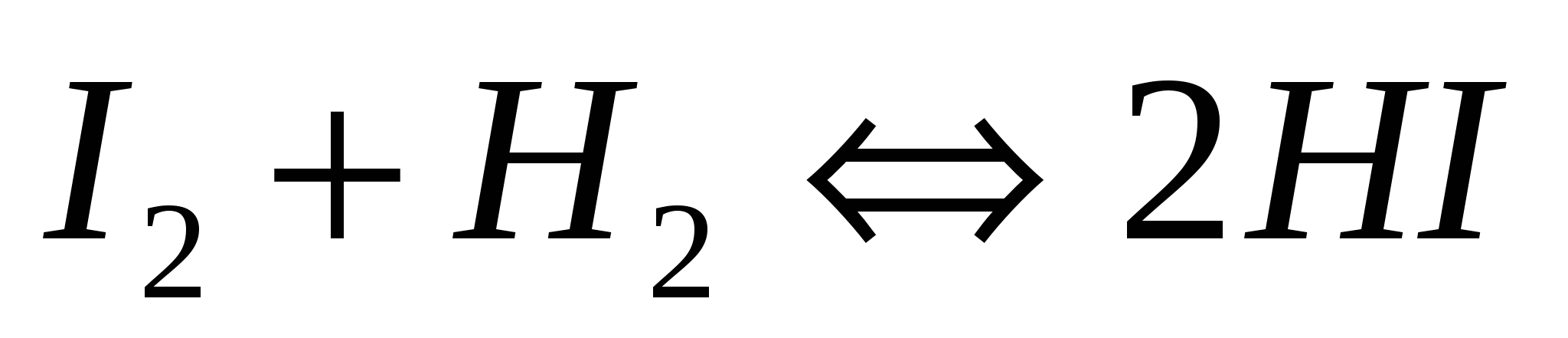 равна 25, а начальные концентрации исходных веществ составляют по 1,2 моль/л. Вычислите равновесные концентрации водорода, иода и иодоводорода. равна 25, а начальные концентрации исходных веществ составляют по 1,2 моль/л. Вычислите равновесные концентрации водорода, иода и иодоводорода.
Сколько воды нужно прибавить к 25 мл 40%-ного раствора гидрокcида калия, плотность которого составляет 1,41 г/см3, чтобы получить 2%-ный раствор?
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между растворами веществ: а)  и и  ; б) ; б) 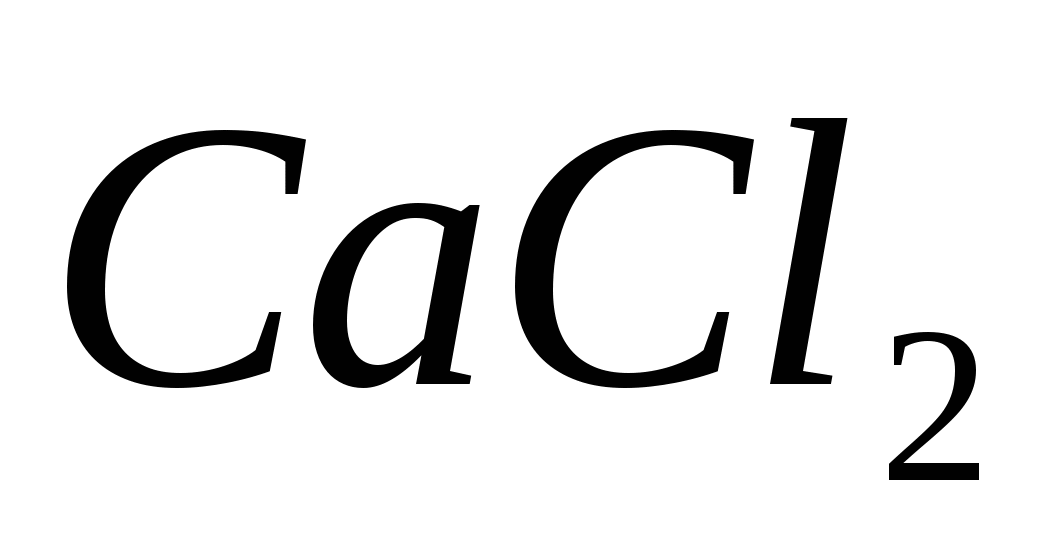 и и 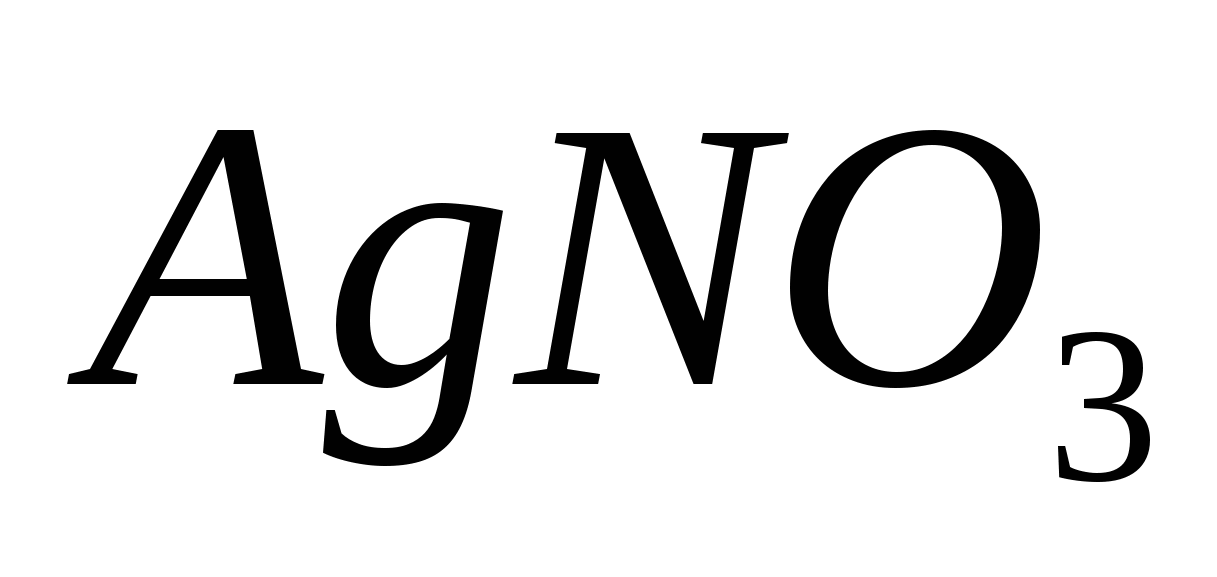 ; в) ; в) 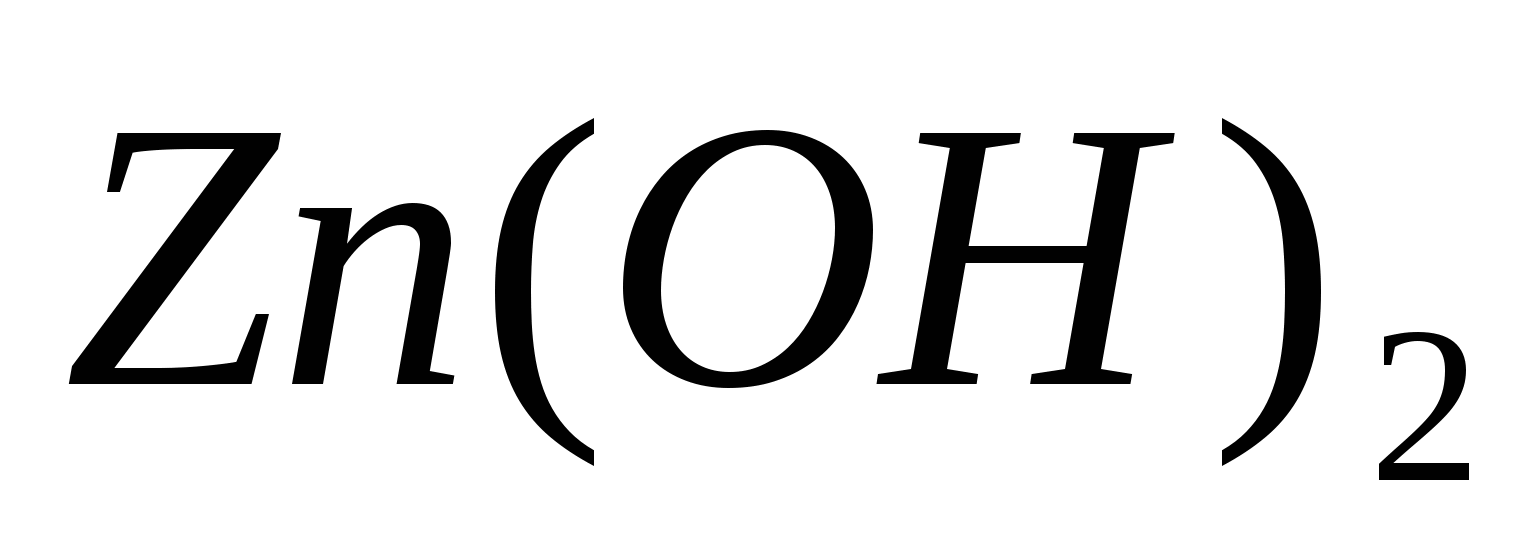 и и 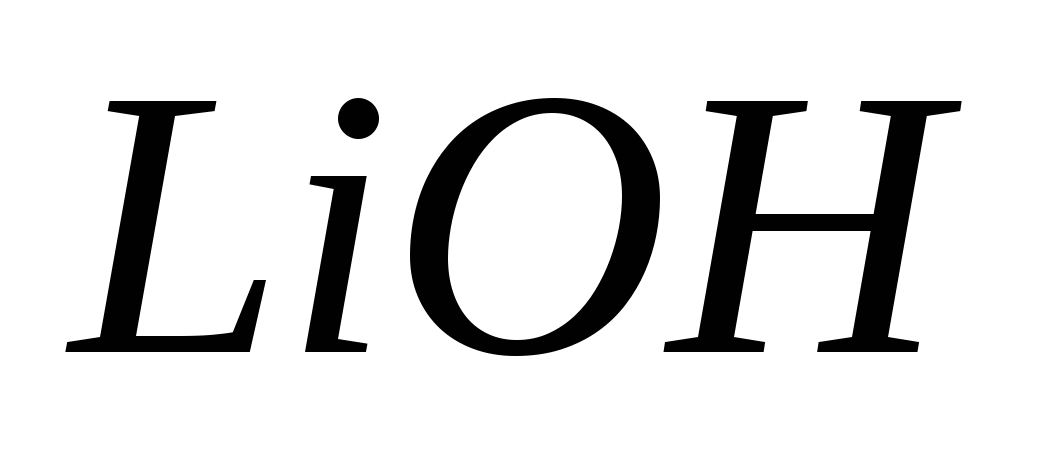 . .
Вычислите температуру кипения 17%-ного водного раствора метилового спирта, температура кристаллизации которого равна – 2,81ºС. Криоскопическая константа воды составляет 1,86º.
При какой концентрации раствора степень диссоциации азотистой кислоты будет равна 35,5 %? Константа диссоциации кислоты равна 5,1·10-4.
Почему при смешивании растворов хлорида цинка и карбоната натрия гидролиз обеих солей идет до конца? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения совместного гидролиза.
Вариант 24.
При взаимодействии газообразных оксида углерода ( ) и сероводорода образуются сероуглерод и пары воды. Вычислите тепловой эффект и запишите термохимическое уравнение этого процесса. ) и сероводорода образуются сероуглерод и пары воды. Вычислите тепловой эффект и запишите термохимическое уравнение этого процесса.
По термохимическому уравнению рассчитайте стандартную энтальпию образования диоксида кремния: 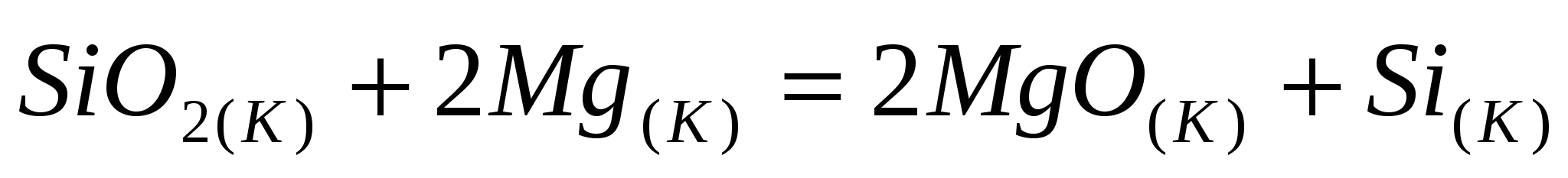 ; ; 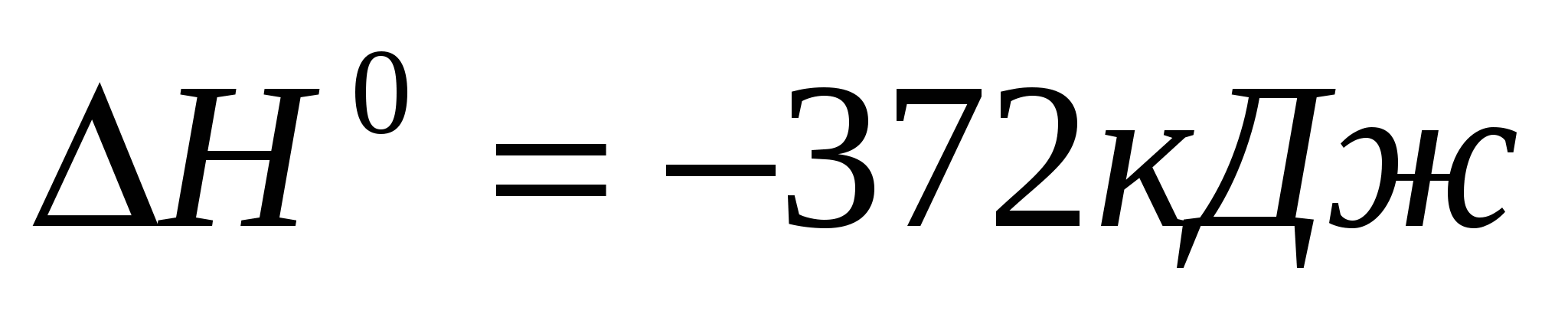 . .
Какие реакции называются обратимыми, какие необратимыми? Дать полный ответ, привести примеры.
Константа равновесия газообразной системы 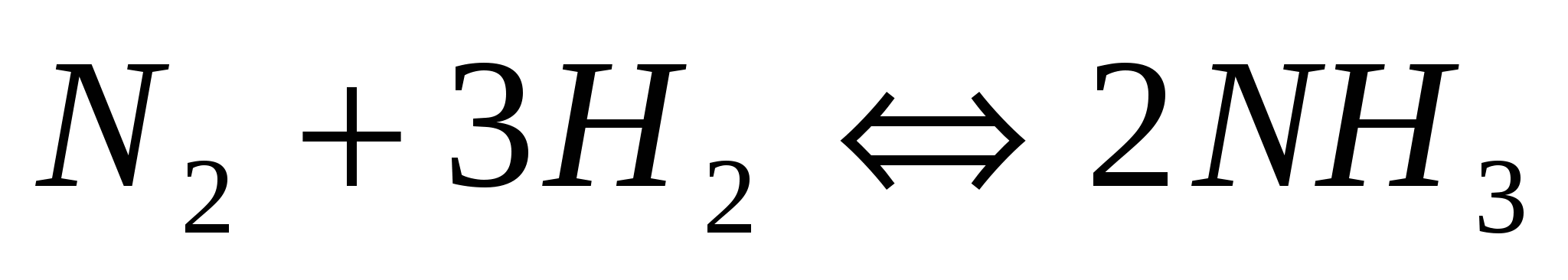 при некоторой температуре равна 0,8. Равновесные концентрации водорода и аммиака соответственно равны 0,6 и 0,2 при некоторой температуре равна 0,8. Равновесные концентрации водорода и аммиака соответственно равны 0,6 и 0,2 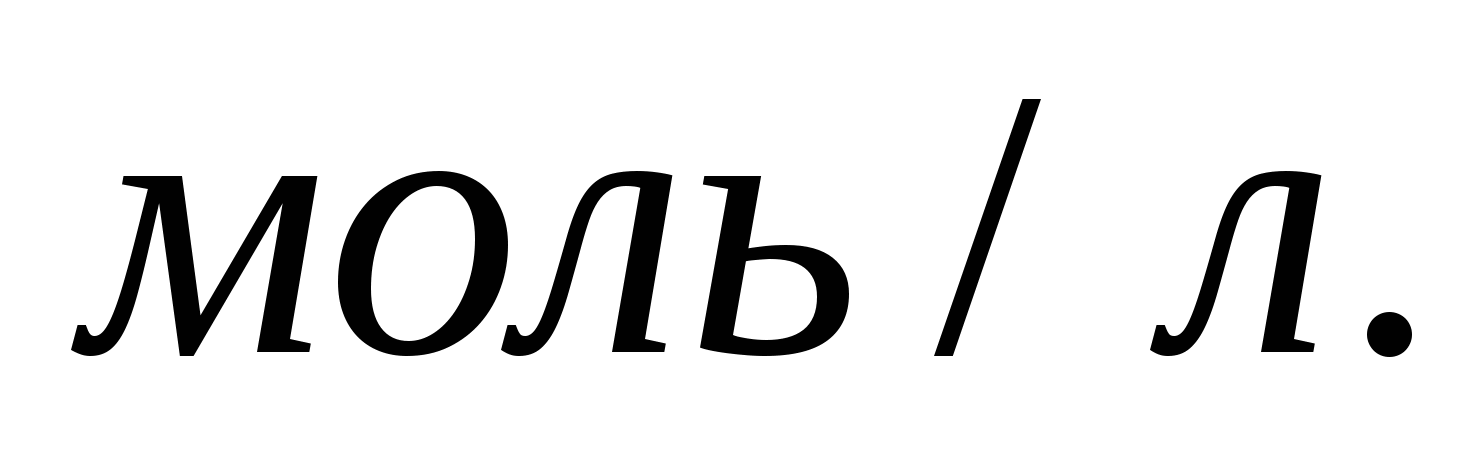 Вычислите исходную и равновесную концентрации азота. Вычислите исходную и равновесную концентрации азота.
Сколько миллилитров 10%-ного раствора карбоната натрия, плотность которого равна 1,105 г/см3, нужно прибавить к 1л 2%-ного раствора, плотность которого 1,02 г/см3, чтобы получить 3%-ный раствор?
Составьте молекулярные и ионно-молекулярные уравнения реакция взаимодействия между: а)  и и 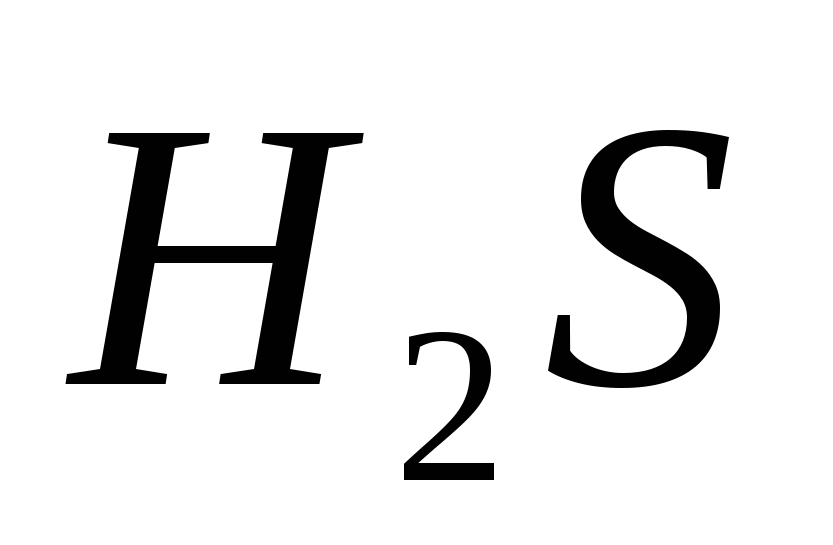 ; б) ; б) 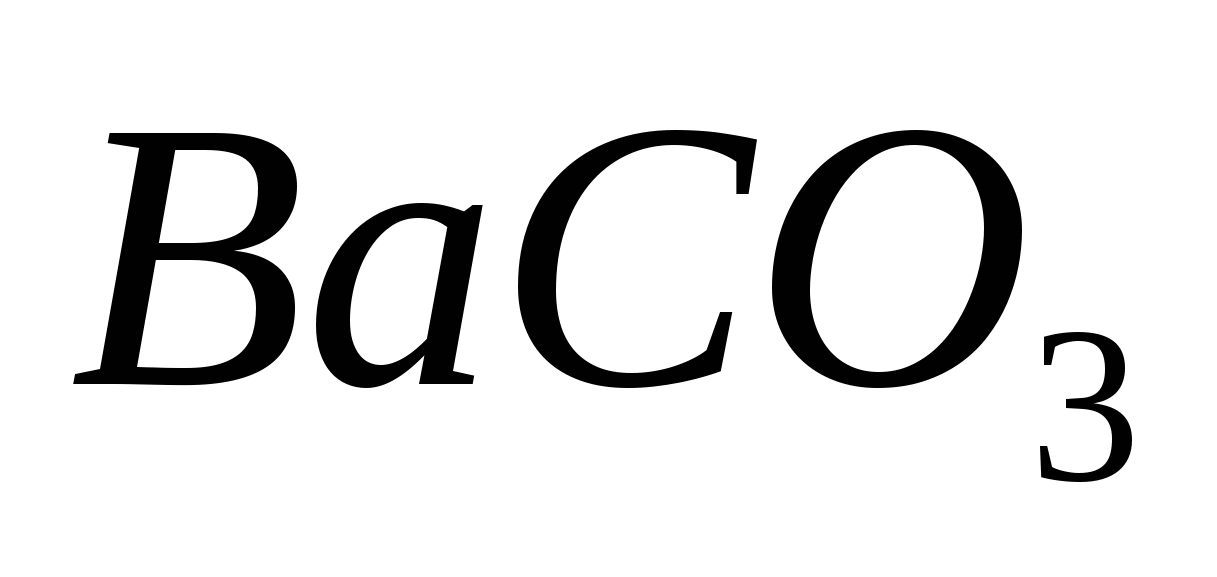 и и  ; в) ; в) 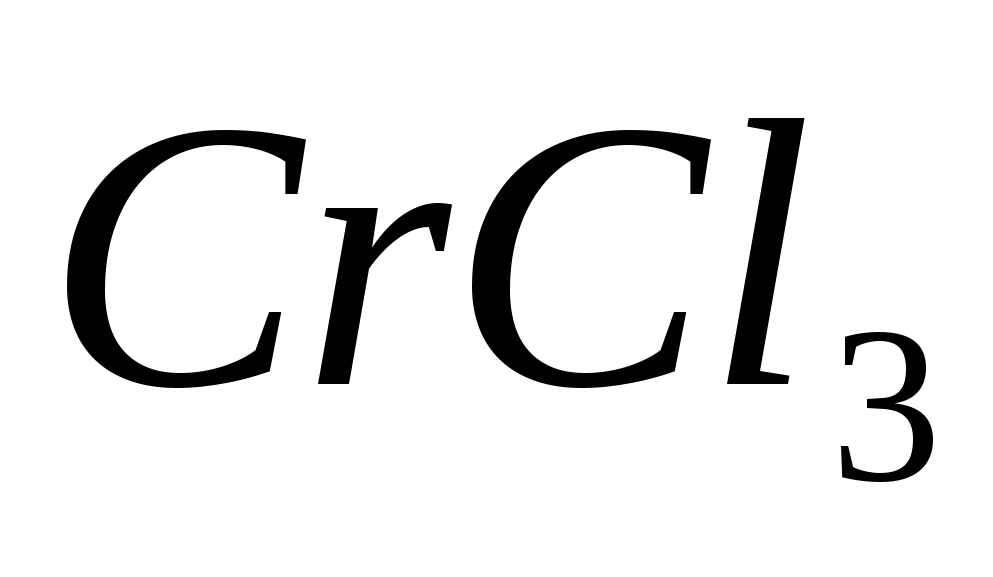 и и 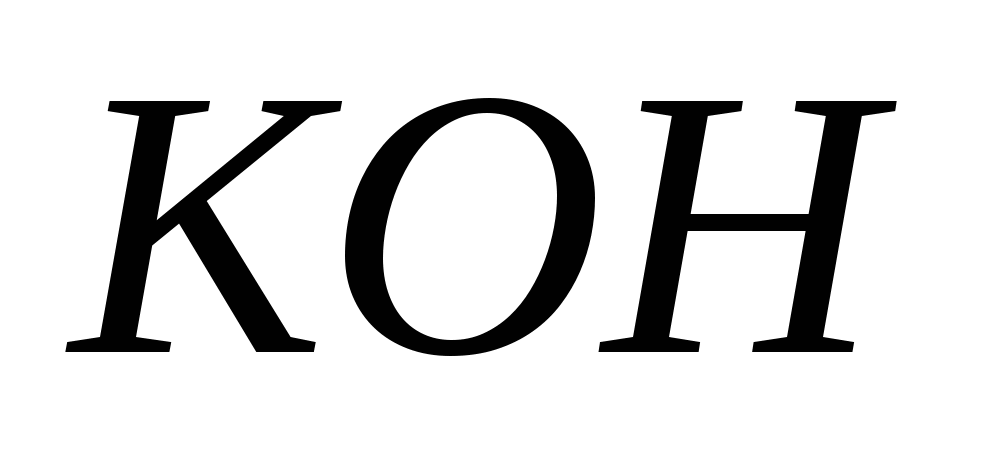 . .
Вычислите осмотическое давление 5%-ного раствора сахара в воде при 25 ºС, принимая плотность раствора за единицу.
Степень диссоциации муравьиной кислоты в 0,02 М растворе равна 3,2 %. Определите константу диссоциации этой кислоты.
Почему при смешивании растворов хлорида хрома и сульфида натрия образуется осадок гидроксида хрома? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения гидролиза.
|
 Скачать 0.72 Mb.
Скачать 0.72 Mb.