Вариант 25.
Вычислите , сколько теплоты выделится при сгорании 100 л ацетилена, если продуктами сгорания являются диоксид углерода и пары воды?
Вычислите изменение энергии Гиббса при 727ºС для реакции: 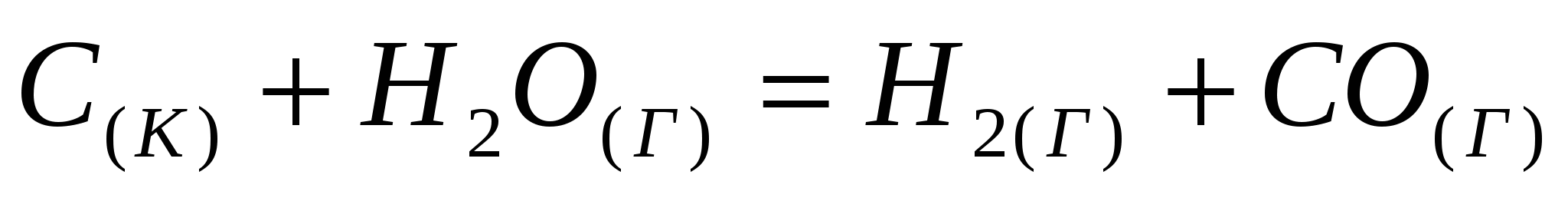 по стандартным значениям энтальпий образования и абсолютных энтропий, воспользовавшись таблицами термодинамических характеристик веществ. по стандартным значениям энтальпий образования и абсолютных энтропий, воспользовавшись таблицами термодинамических характеристик веществ.
При температуре 30 ºС химическая реакция заканчивается за 30 мин. Определите время протекания этой реакции при температуре 20, 40, 50ºС. Температурный коэффициент реакции равен 2,4.
Константа равновесия системы при постоянной температуре 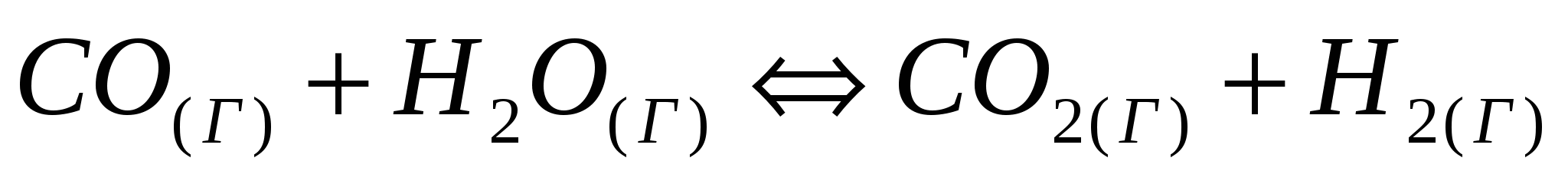 равна 3. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: равна 3. Вычислите равновесные концентрации всех реагентов, если исходные концентрации составляют: 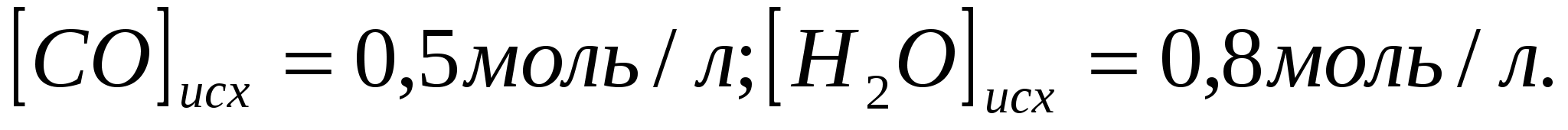
Плотность 95%-ного раствора сахарозы  равна 1,035 г/см3. Вычислите молярную концентрацию эквивалента этого раствора. равна 1,035 г/см3. Вычислите молярную концентрацию эквивалента этого раствора.
Какое из веществ: 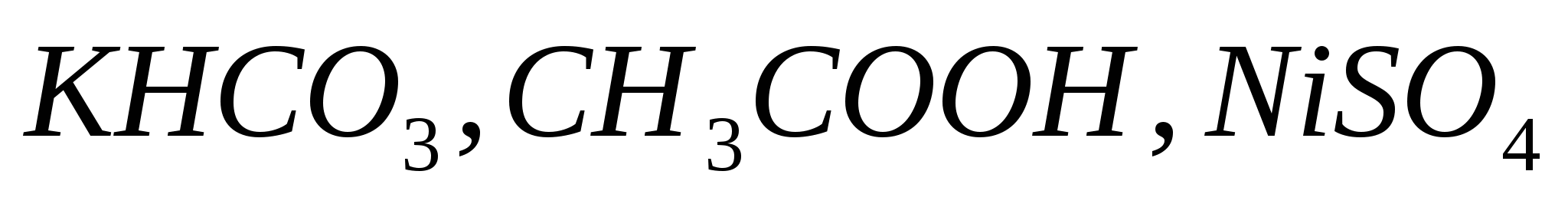 - взаимодействует с раствором серной кислоты? Составьте молекулярные и ионно-молекулярные уравнения реакций. - взаимодействует с раствором серной кислоты? Составьте молекулярные и ионно-молекулярные уравнения реакций.
Сколько граммов карбамида 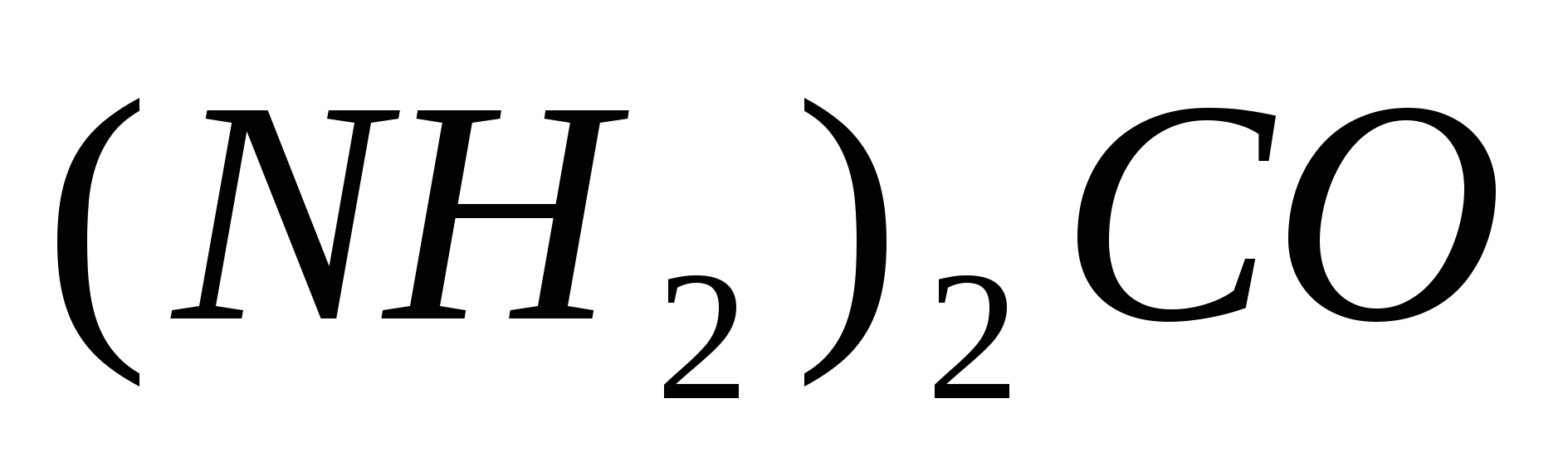 необходимо растворить в 90 г воды, чтобы температура кристаллизации понизилась на 0,395ºС? Криоскопическая константа воды равна 1,86 º. необходимо растворить в 90 г воды, чтобы температура кристаллизации понизилась на 0,395ºС? Криоскопическая константа воды равна 1,86 º.
Составьте уравнения электролитической диссоциации для электролитов: хлорида железа (III), серной кислоты, нитрата магния, гидросульфида калия, угольной кислоты, гидроксида цинка.
Какие из солей 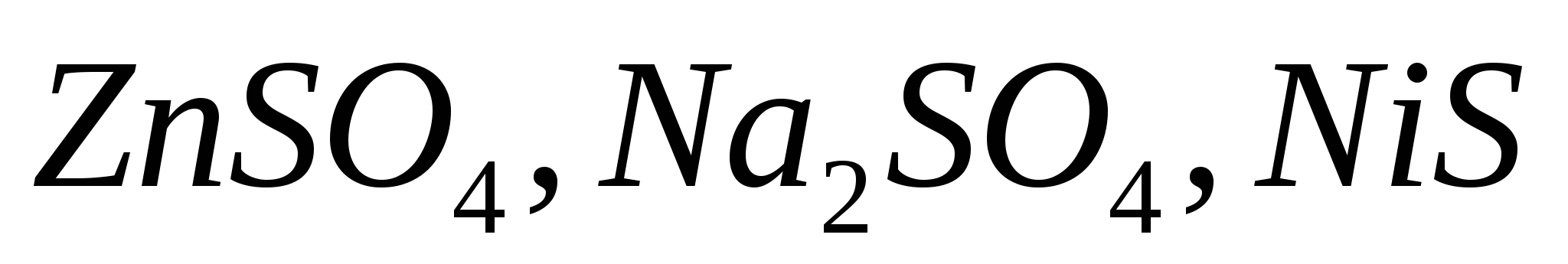 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения этих солей, укажите значения рН среды. подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения этих солей, укажите значения рН среды.
Вариант 26.
Вычислите теплоту образования сульфида железа, если при взаимодействии 6,3г железа с серой выделилось 11,3 кДж теплоты.
Рассчитайте температуру, при которой равновероятны оба направления реакции: 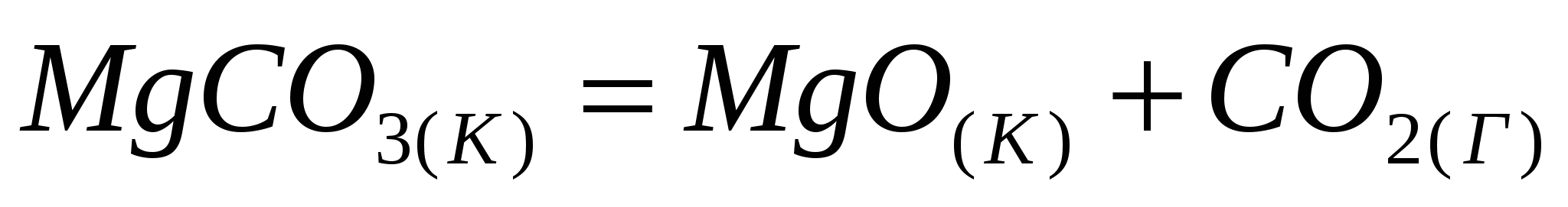 . .
Как изменится скорость прямой и обратной реакции  , если давление уменьшить в 3 раза? , если давление уменьшить в 3 раза?
Запишите выражение для константы равновесия гетерогенной системы 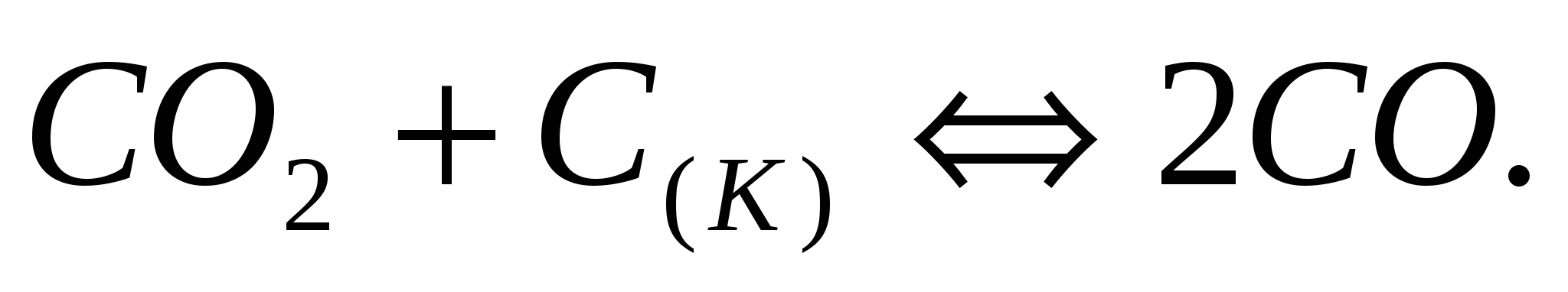 Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза? Предложите несколько вариантов ускорения прямой реакции. Как изменится скорость прямой реакции, если концентрацию диоксида углерода увеличить в 3 раза? Предложите несколько вариантов ускорения прямой реакции.
До какого объема надо разбавить 38%-ный раствор объемом 50 мл (плотность равна 1,285 г/см3), чтобы получить 0,5 молярный раствор серной кислоты?
Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: 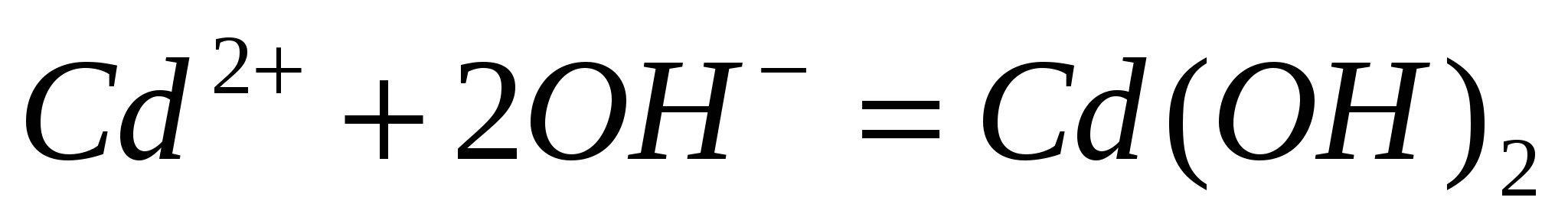 ; ; 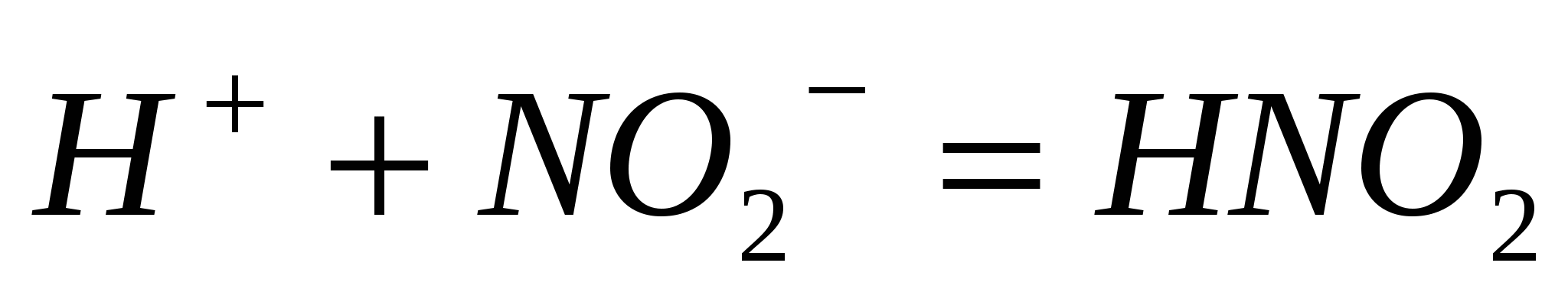 ; ; 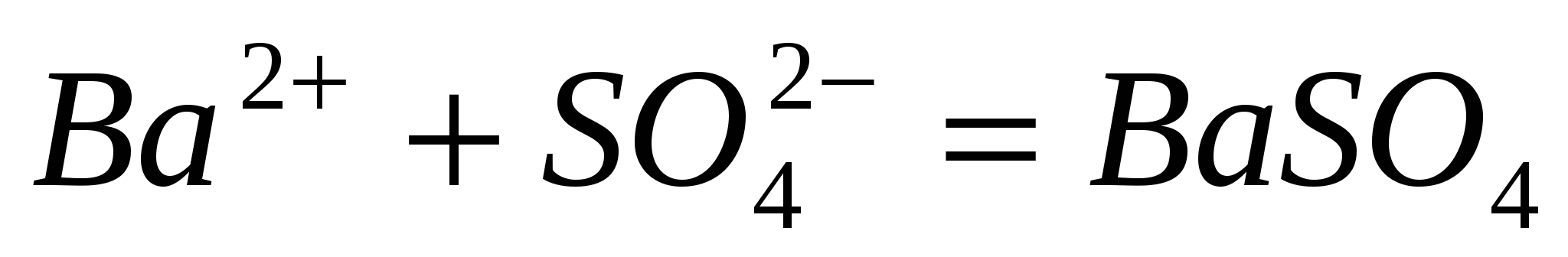 . .
Вычислите температуру кипения 10%-ного раствора нафталина 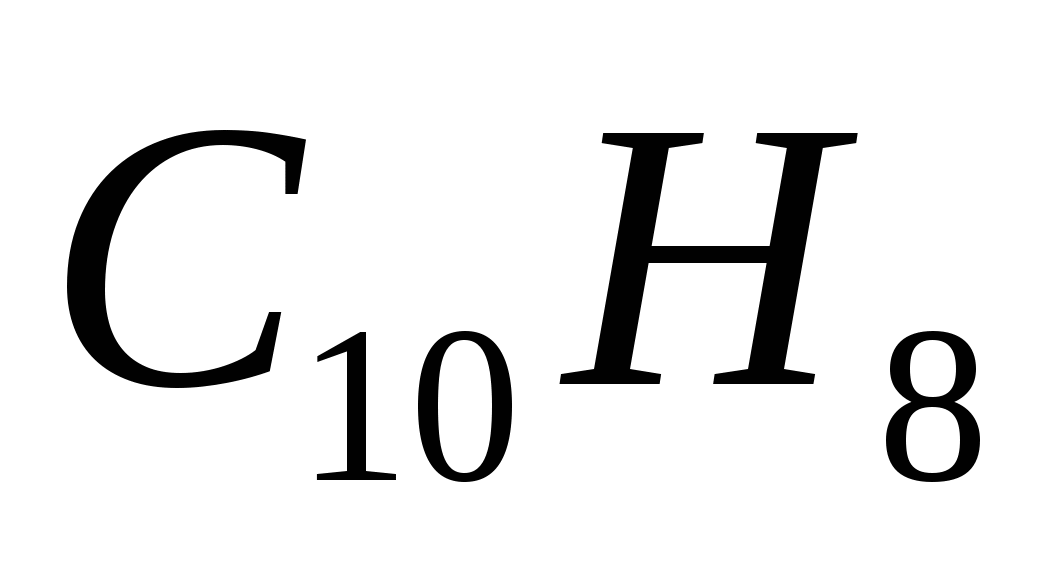 в бензоле, зная, что эбуллиоскопическая константа бензола равна 2,57º, а температура его кипения 80,2ºС. в бензоле, зная, что эбуллиоскопическая константа бензола равна 2,57º, а температура его кипения 80,2ºС.
Вычислите степень диссоциации сероводородной кислоты по первой ступени, если константа диссоциации ее в 0,1 М растворе составляет 6·10-8.
Почему при смешивании растворов нитрата хрома и сульфида калия гидролиз идет практически до конца? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения совместного гидролиза.
Вариант 27.
Запишите термохимическое уравнение реакции между оксидом углерода (II) и водородом, в результате которой образуются метан и пары воды. Сколько теплоты выделится, если в ходе процесса было получено 67 л метана ( при нормальных условиях).
Вычислите энергию Гиббса при 473К, если 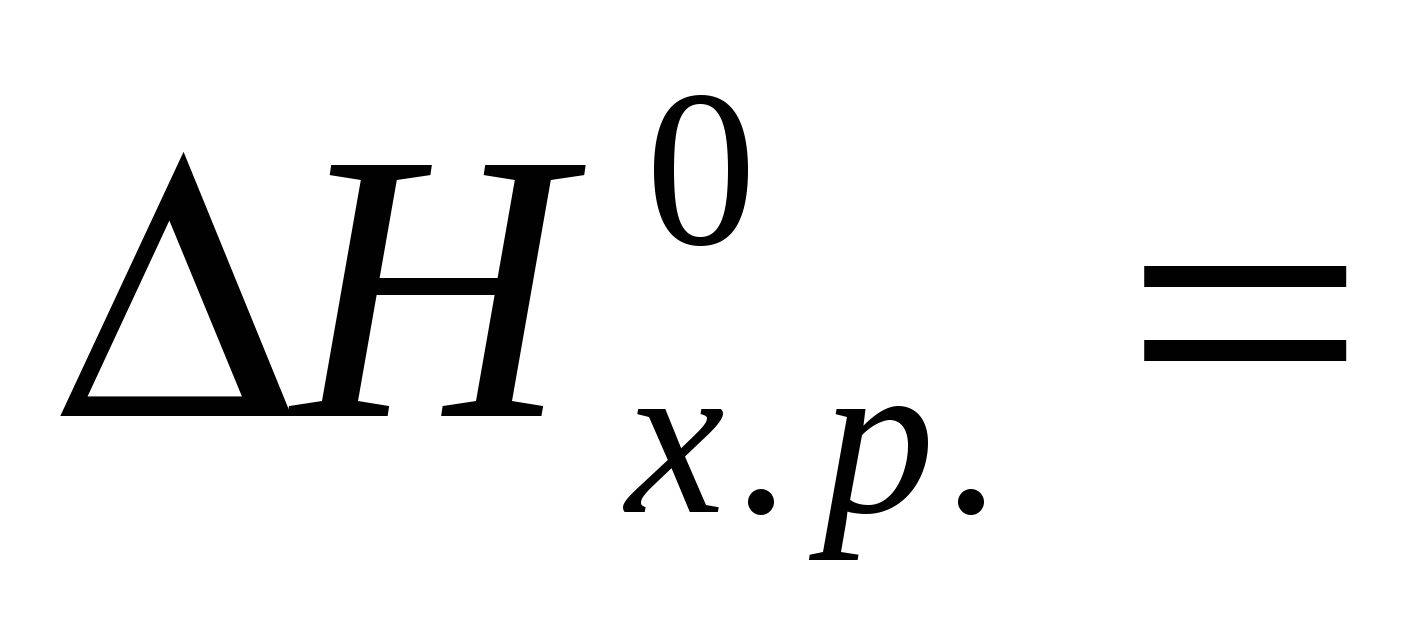 13873 Дж/моль, 13873 Дж/моль,
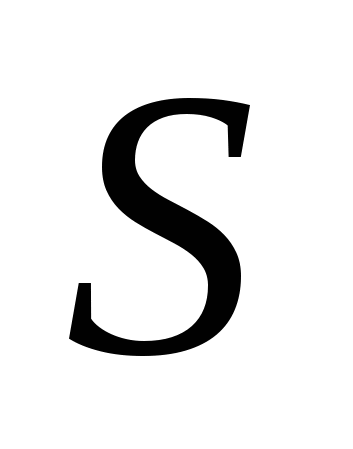 = 42,2 Дж/моль·К. = 42,2 Дж/моль·К.
Напишите скорости выражения реакций, протекающих по схеме А+В=АВ, если а) А и В – вещества, находящиеся в растворе; б) А – твердое вещество, а В – газ или вещество, находящееся в растворе.
Запишите выражения для констант равновесия следующих процессов: 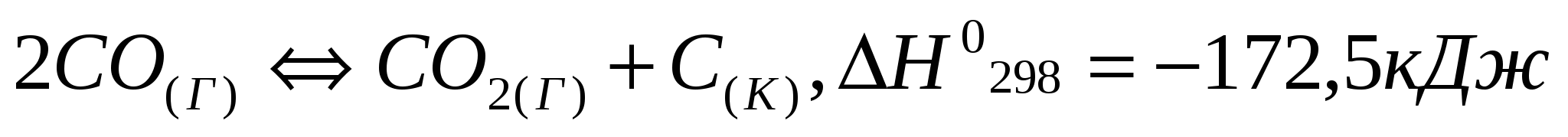
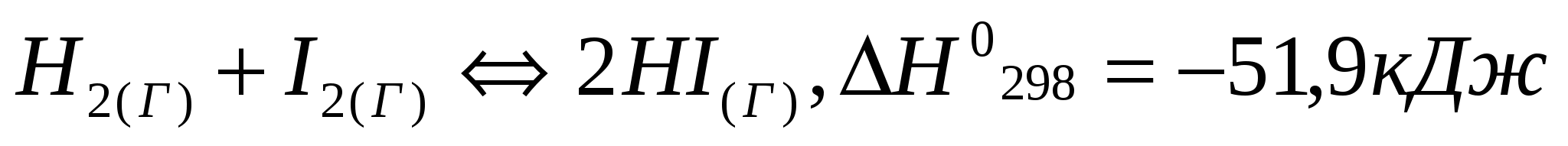
Как сместить равновесие реакций в прямом направлении?
Какой объем раствора, в котором массовая доля 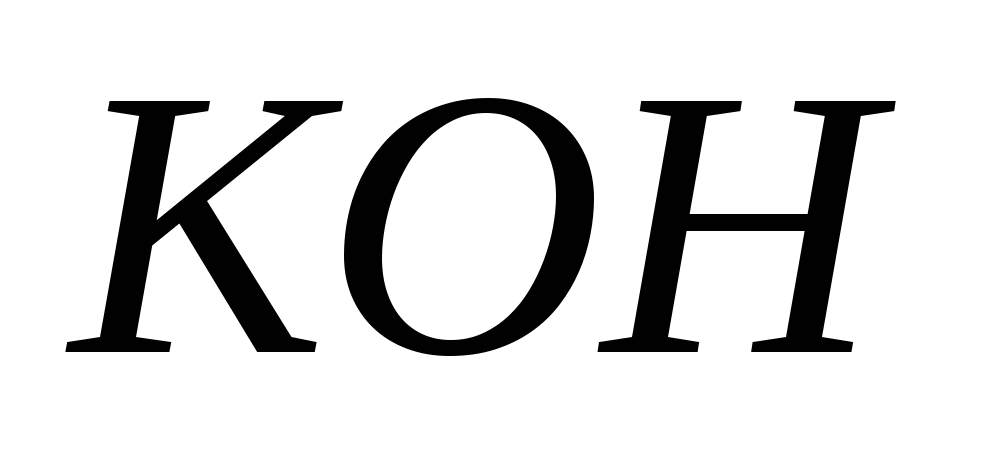 составляет 12% (плотность 1,11 г/см3), надо взять, чтобы получить раствор объемом 250 мл молярной концентрации 2,0 моль/л. составляет 12% (плотность 1,11 г/см3), надо взять, чтобы получить раствор объемом 250 мл молярной концентрации 2,0 моль/л.
Напишите ионно-молекулярные уравнения реакций:
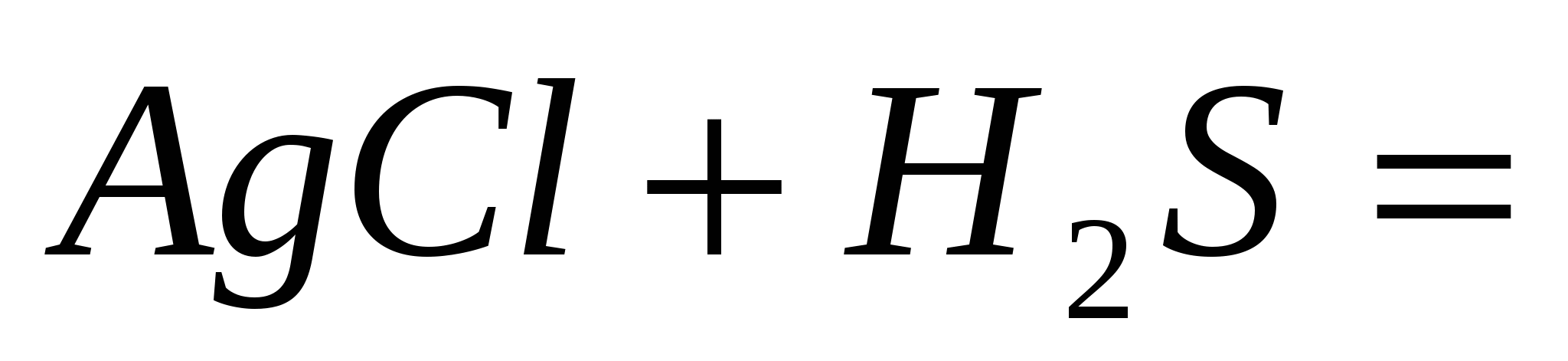 ; ; 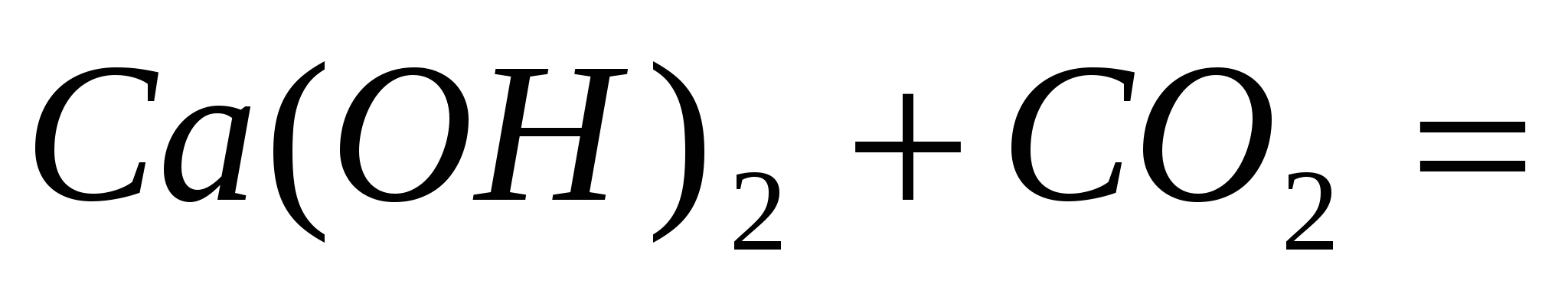 ; ; 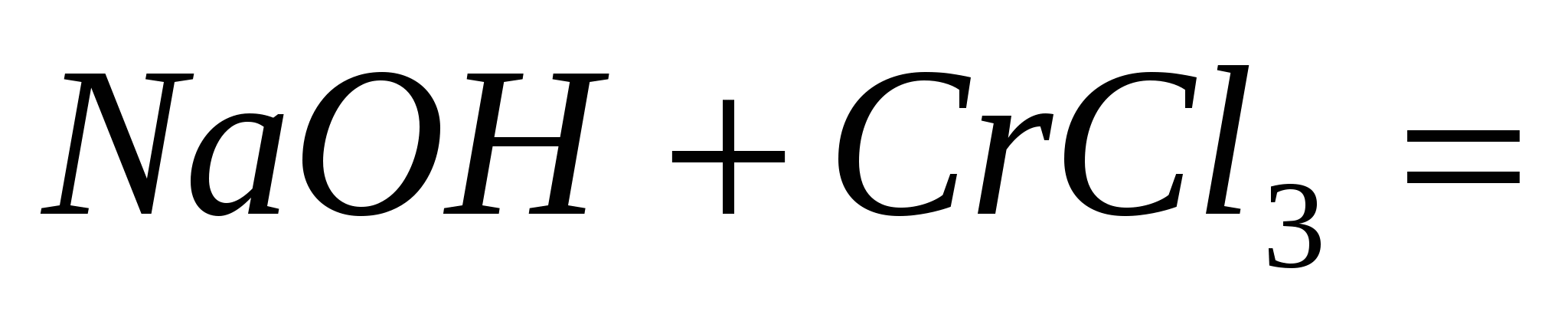 . .
Вычислите температуру кристаллизации 15%-ного раствора этилового спирта 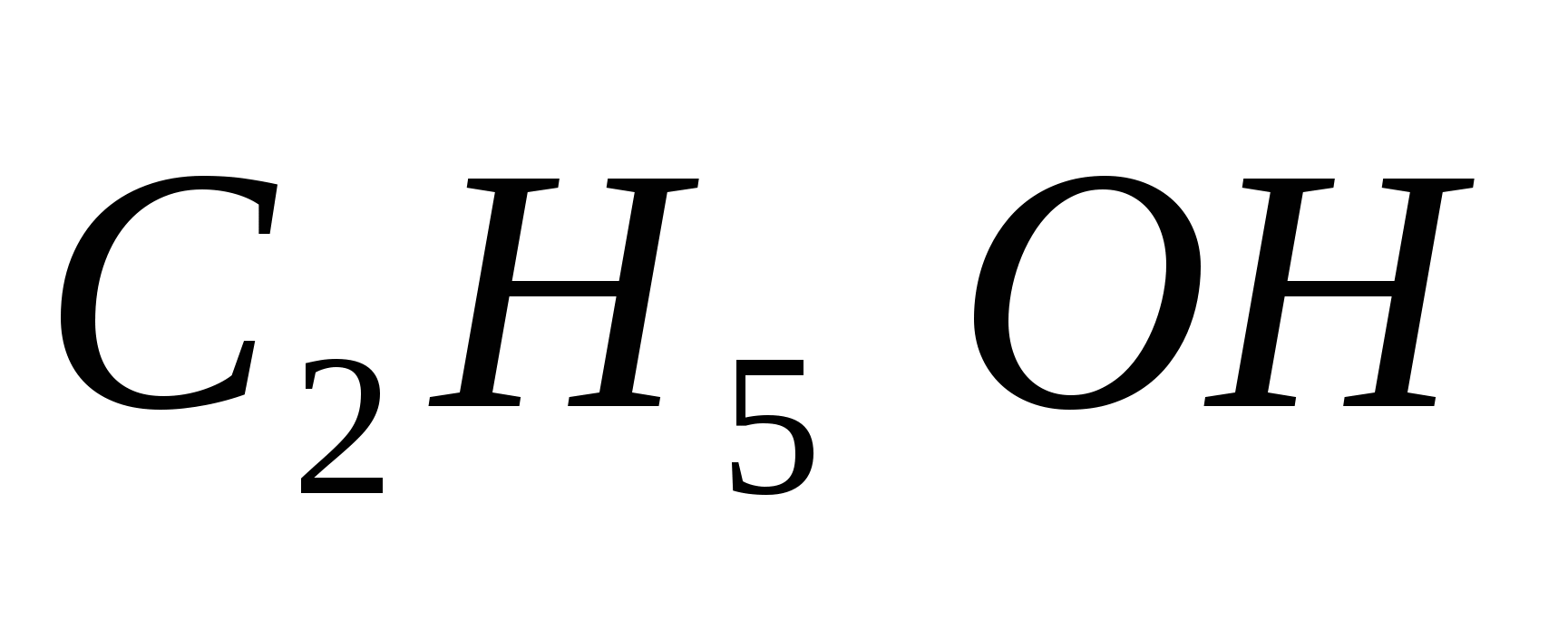 в воде. Криоскопическая константа воды равна 1,86º. в воде. Криоскопическая константа воды равна 1,86º.
Составьте уравнения электролитической диссоциации следующих электролитов: 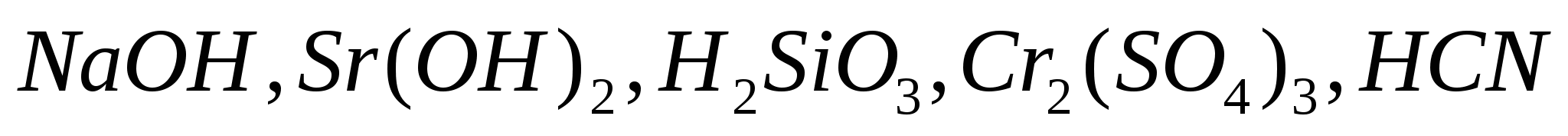 . Запишите выражения констант равновесия для слабых электролитов. . Запишите выражения констант равновесия для слабых электролитов.
Составьте ионно-молекулярные и молекулярные уравнения гидролиза следующих солей 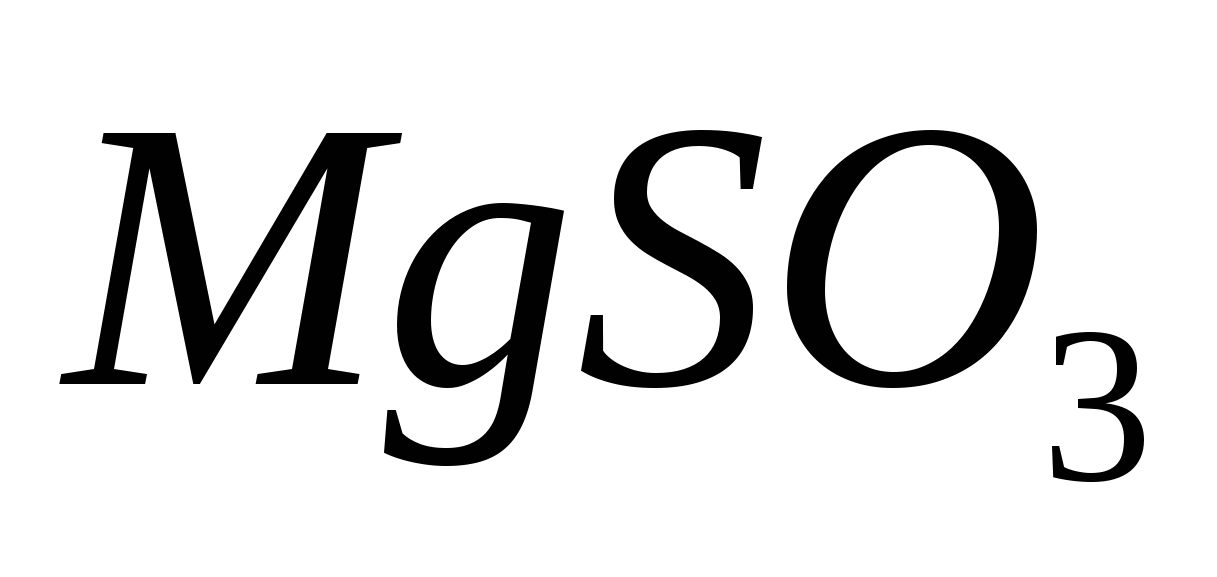 , , 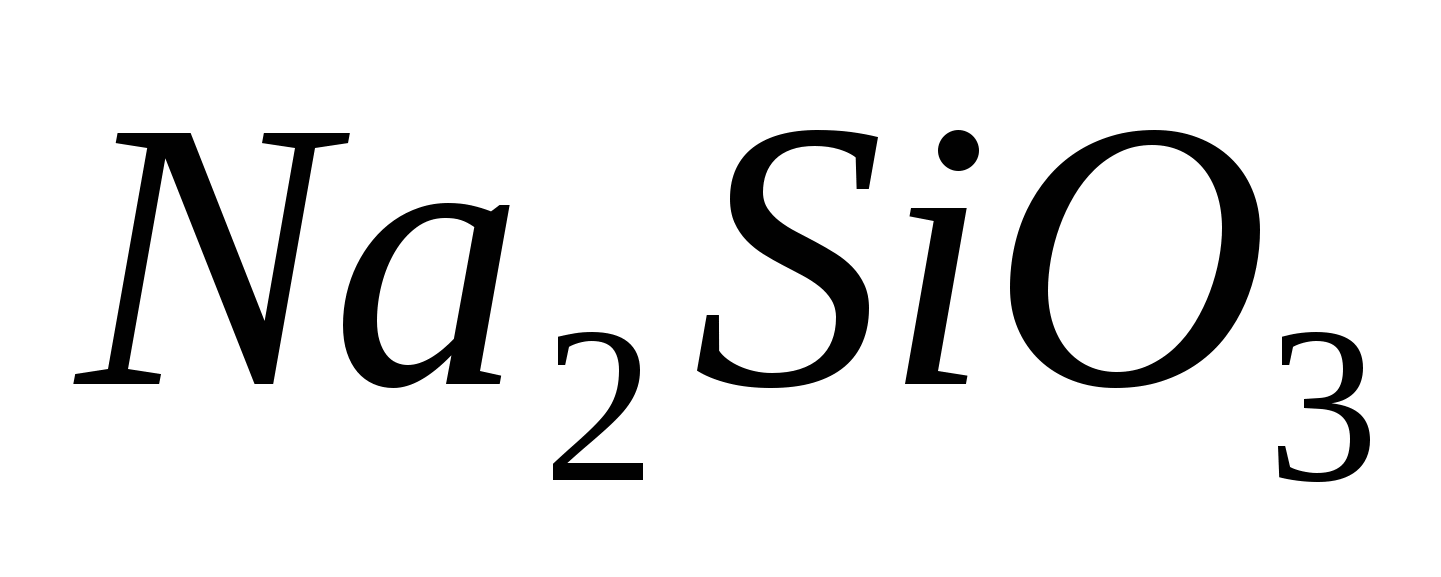 и и 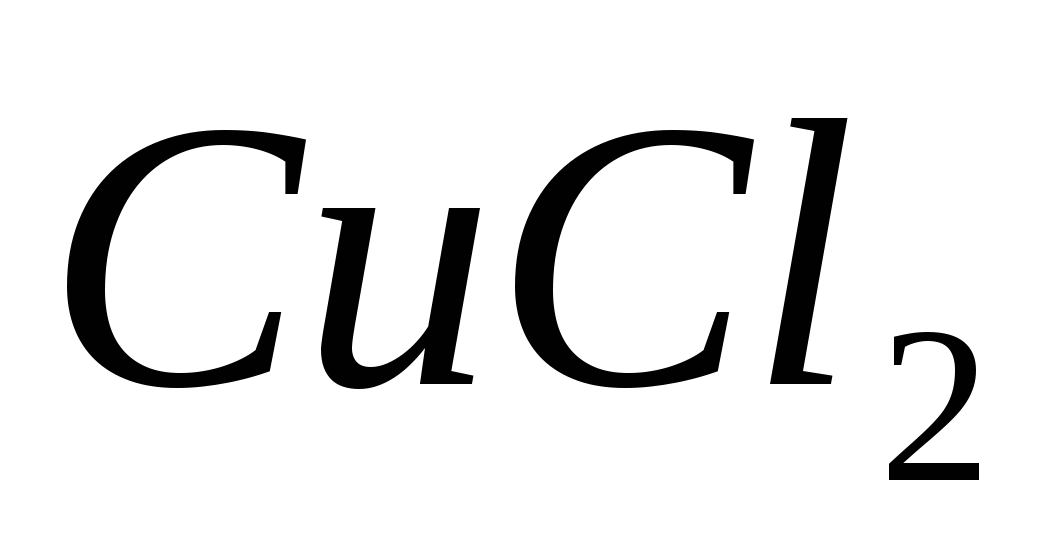 . Укажите значение рН в растворах этих солей. . Укажите значение рН в растворах этих солей.
ПРИЛОЖЕНИЕ
Термодинамические свойства некоторых соединений
Вещество
|
Состояние
|
Энтальпия,
кДж/моль
|
Энтропия,
Дж/(моль К) К)
|
Свободная энергия, кДж/моль
|
Al
|
Кристаллич.
|
0
|
28.33
|
0
|
Al2O3
|
Кристаллич.
|
-1675,7
|
50,92
|
-1582,27
|
As2O3
|
Кристаллич.
|
-666
|
117
|
-588
|
As2O5
|
Кристаллич.
|
-925
|
105
|
-782
|
B
|
Кристаллич.
|
0
|
6,5
|
0
|
B2O3
|
Кристаллич.
|
-1272,1
|
54,2
|
-1193,4
|
C( графит)
|
Кристаллич.
|
0
|
5,74
|
0
|
CO
|
Газ
|
-110,53
|
197,55
|
-137,15
|
CO2
|
Газ
|
-393,51
|
213,66
|
-394,37
|
COCl2
|
Газ
|
-219,50
|
283,64
|
-205,31
|
CS2
|
Жидкость
|
88,70
|
151,04
|
64,41
|
CaCO3
|
Кристаллич.
|
-1206,83
|
91,71
|
-1128,35
|
CaO
|
Кристаллич.
|
-635,09
|
38,07
|
-603,46
|
Ca(OH)2
|
Кристаллич.
|
-985,12
|
83,39
|
-897,52
|
Cl2
|
Газ
|
0
|
222,9
|
0
|
Cu
|
Кристаллич.
|
0
|
33,14
|
0
|
CuO
|
Кристаллич.
|
-162,00
|
42,63
|
-134,26
|
F2
|
Газ
|
0
|
20,31
|
0
|
Fe
|
Кристаллич.
|
0
|
27,15
|
0
|
FeO
|
Кристаллич.
|
-264,85
|
60,75
|
-244,30
|
FeS
|
Кристаллич.
|
-100,42
|
60,29
|
100,75
|
FeS2
|
Кристаллич.
|
-177,40
|
52,93
|
-166,05
|
Fe2O3
|
Кристаллич.
|
-822,16
|
87,45
|
-740,34
|
Fe3O4
|
Кристаллич
|
-1117,13
|
146,19
|
-1014,17
|
Н2
|
Газ
|
0
|
130,52
|
0
|
HCl
|
Газ
|
-92,31
|
186,79
|
-95,30
|
H2O
|
Газ
|
-241,8
|
188,7
|
228,6
|
H2O
|
Жидкость
|
-285,83
|
69,95
|
-237,23
|
H2O2
|
Жидкость
|
-187,9
|
109,6
|
-120,5
|
H2S
|
Газ
|
-20,60
|
205,70
|
-33,50
|
KCl
|
Кристаллич
|
-436,65
|
82,55
|
-408,93
|
KClО3
|
Кристаллич
|
-391,2
|
143,0
|
-289,9
|
Mg
|
Кристаллич
|
0
|
32,68
|
0
|
Mg CO3
|
Кристаллич
|
-1095,85
|
65,10
|
-1012,15
|
MgO
|
Кристаллич
|
-601,49
|
27,07
|
-569,27
|
Mn
|
Кристаллич
|
0
|
32,01
|
0
|
MnО2
|
Кристаллич
|
-521,4
|
53,1
|
-466,7
|
N2
|
Газ
|
0
|
191,50
|
0
|
NH3
|
Газ
|
-45,94
|
192,66
|
-16,48
|
NH4Cl
|
Кристаллич
|
-314,22
|
95,81
|
-203,22
|
NO
|
Газ
|
91,26
|
210,64
|
87,58
|
NO2
|
Газ
|
34,19
|
240,06
|
52,24
|
N2O
|
Газ
|
82,01
|
219,83
|
104,12
|
N2O5
|
Газ
|
13,30
|
355,65
|
117,14
|
Na
|
Кристаллич
|
0
|
51,21
|
0
|
NaBr
|
Кристаллич
|
-361,41
|
86,82
|
-349,34
|
NaCl
|
Кристаллич
|
-411,12
|
72,13
|
-384,13
|
NaOH
|
Кристаллич
|
-426,35
|
64,43
|
-380,29
|
О2
|
Газ
|
0
|
205,04
|
0
|
О3
|
Газ
|
143
|
239
|
163
|
Pb
|
Кристаллич
|
0
|
64,81
|
0
|
PbO2
|
Кристаллич
|
-276,56
|
71,92
|
-217,55
|
S
|
Кристаллич
|
0
|
32,55
|
0
|
SO2
|
Газ
|
-296,90
|
248,07
|
-300,21
|
SO3
|
Газ
|
-395,85
|
256,69
|
-317,17
|
Si
|
Кристаллич
|
0
|
18,83
|
0
|
SiO2
|
Кристаллич
|
-910,94
|
41,84
|
-256,67
|
Zn
|
Кристаллич
|
0
|
41,63
|
0
|
ZnO
|
Кристаллич
|
-348,11
|
43,51
|
-318,10
|
CH4
|
Газ
|
-74,85
|
186,27
|
-50,85
|
CH CH CH
|
Газ
|
206,75
|
200,82
|
209,21
|
C2H6
|
Газ
|
84,67
|
229,49
|
-32,93
|
C3H8
|
Газ
|
-103,85
|
269,91
|
-23,53
|
CH3OH
|
Жидкость
|
-238,57
|
126,78
|
-166,27
|
C2H5OH
|
Жидкость
|
-276,98
|
160,67
|
-174,15
| |
 Скачать 0.72 Mb.
Скачать 0.72 Mb.