Практичні-роботи-біонерганіка-лікувальна-справа 2. Величини, що характеризують кількісний склад розчину. Охорона праці в галузі.
 Скачать 440.81 Kb. Скачать 440.81 Kb.
|
|
Практична робота № 1 Тема: «Величини, що характеризують кількісний склад розчину. Охорона праці в галузі.» Блок інформації Важливою характеристикою розчину є його кількісний склад, тобто вміст розчиненої речовини у певній кількості розчину або розчинника. Склад розчину можна виразити як часткою розчиненої речовини так і концентрацією розчиненої речовини. Концентрацієюрозчиненої речовини (не розчину!) називають відношення кількості або маси розчиненої речовини до об’єму розчину. Концентрація – це величина, що визначає співвідношення компонентів у розчині. Способи вираження концентрації залежать від одиниць виміру кількості розчину, розчиненої речовини (В) і розчинника (А). 1.Масова частка розчиненої речовини В ( ω) – це відношення маси розчиненої речовини m( В) до загальної маси розчину m р-ну: 2.Молярна концентрація (СМ) – це відношення кількості розчиненої речовини νВ до об’єму розчину Vр-ну, вираженого у кубічних дециметрах (літрах): моль/дм3 CM = 3. Молярна концентрація еквівалента (Секв) – це відношення кількості речовини еквівалентів розчиненої речовини νекв до об’єму розчину Vр-ну , вираженого у кубічних дециметрах (літрах): моль/дм3 Секв = Молярна маса еквівалента Мекв речовини В дорівнює добутку її молярної маси МВ (г/моль) на фактор еквівалентності fекв. ^Фактор еквівалентності fекв = 1/n f(кислоти) = 1/число атомів Гідрогену в кислот f(H2SO4) = ½; Мекв = f·М = 1/2·98 = 49 г/моль f(основи) = 1/число гідроксид-іонів ОН- f(Ba(OH)2) = ½; Мекв = f·М = 1/2·171 = 85,5 г/моль f(солі) = 1/валентність Ме ·число атомів Ме f(Al(NO3)3) = 1/3·1 Мекв = f·М = 1/3·213 = 71 г/моль f(окисника) = 1/число електронів, що приєднує окисник f(відновника) = 1/число електронів, що віддає відновник Завдання для позааудиторної самостійної роботи: 1. Складіть письмові відповіді на запитання: Що таке концентрація розчину, вкажіть способи вираження кількісного складу розчинів. 2. Розв΄яжіть задачі (показати розв΄язок): 1. У воді об’ємом 170 см3 (ρ(Н2О) = 1 г/см3) розчинили купрум (ІІ) сульфат масою 30 г. Яка масова частка солі в розчині? Відповідь: 15% або 0,15 2. До розчину хлоридної кислоти масою 60 г з масовою часткою кислоти 6% долили 100 см3 води. Яка масова частка кислоти в новому розчині? Відповідь: 2,25% 3. У 500 см3 води розчинили 15,46 г натрій гідроксиду. Густина отриманого розчину 1,032 г/см3. Визначте: а) масову частку натрій гідроксиду в розчині, що отримали; б) молярну концентрацію натрій гідроксиду в розчині, що отримали. Відповідь: 3%; 0,77 моль/дм3 4. Обчисліть молярні маси еквівалентів речовин: H3AsO3, Fe(OH)3, Al2(SO4)3 Відповідь: відповідно: 42 г/моль; 36 г/моль; 57 г/моль 3. Дати письмові відповіді на тестові завдання «Вчення про розчини» Еталони розв΄язування задач Приклад 1: Обчислити масову частку цукру в розчині, приготовленому при розчиненні 20 г цукру в 180 г води.
Приклад 2. Визначити масову частку кухонної солі в розчині, одержаному при додаванні 25 г натрій хлориду до 200 г розчину з масовою часткою солі 0,25.
Приклад 3.У воді розчинили 8 г натрій гідроксиду. Об’єм розчину довели до 500 см3. Знайти молярну концентрацію NaOH у розчині. Дано: m(NaOH) = 8 г Яка молярна концентрація NaOH? V(р –ну) = 500 см3 = 0,5дм3 CM = Знайти: СМ(NaOH) -? Відповідь: См = 0,4 М або 0,4 моль/дм3 Приклад 4.Знайти молярну концентрацію сульфатної кислоти в розчині масою 150 г, з масовою часткою H2SO4 20% і густиною 1,139 г/см3 Дано: m(р –ну) = 150 г 1. Скільки грамів H2SO4 міститься у розчин 2. Який об’єм займе розчин? V = 3. Яка молярна концентрація розчину? M(H2SO4) = 98 г/моль CM = Відповідь: СМ розчину дорівнює 2,325 М. Приклад 5.Обчислити молярну концентрацію еквівалента 500 г 10 % розчину натрій карбонату. Густина розчину 1,115 г/см3. Дано: m(р –ну) = 500 г 1. Знаходимо молярну масу еквіваленту Na2CO3: W(Na2CO3) = 10% Мекв = Знайти: mp.p.= Секв(Na2CO3) - ? 3. Який об’єм займе розчин? V = Секв = Відповідь: Секв(Na2CO3) = 2,1 моль/дм3 Зміст і методика проведення аудиторного заняття План проведення заняття. 1.Теніка безпеки при роботі в хімічній лабораторії та міри надання першої медичної допомоги у разі нещасних випадків (інструкція). 2. Дати відповіді на питання вихідного рівня знань. 3. Тестові завдання з теми «Вчення про розчини» 4. Самостійна робота «Розв′язування задач» Питання та завдання для вихідного рівня знань: 1. Дайте визначення розчинам, концентрації розчинів. 2. Вкажіть способи вираження концентрації розчинів – масової частки розчиненої речовини. Зробіть розрахунки : а) Яка масова частка утвориться, якщо змішати 4 г NaOH і 300 см3 води? б) Розрахуйте маси солі та води для виготовлення розчину масою 200 г із w( солі) = 0,1; в) До розчину хлоридної кислоти об΄ємом 80 см3 (ρ = 1,02 г/см3) з масовою часткою розчиненої речовини 12% долили 18,4 г води. Яка масова частка кислоти в новому розчині? Відповідь: 9,8%) 3. Дайте визначення молярної концентрації, вкажіть одиниці виміру. Зробіть обчислення: У невеликому об’ємі води розчинили калій гідроксид масою 11,2 г і об’єм розчину довели до 200 см3. Обчисліть молярну концентрацію одержаного розчину. Відповідь: 1 моль/дм34.Дайте визначення молярної концентрації еквіваленту, вкажіть одиниці виміру . Вкажіть фактор еквівалентності для розрахунку молярної маси еквіваленту: Pb(NO3)2, H2Cr2O7, Ca(OH)2, KMnO4. Багатоваріантна самостійна робота: І рівень: 1. У воді масою 80 г розчинили натрій гідроксид масою 10 г. Яка масова частка речовини в розчині? 2. Яка маса цинк хлориду в розчині масою 70 г з масовою часткою солі 15%? 3. У воді масою 160 г розчинили купрум (ІІ) сульфат масою 40 г. Яка масова частка солі в розчині? 4. Яка маса калій гідроксиду в розчині масою 150 г з масовою часткою речовини 20%? 5. У воді масою 175 г розчинили плюмбум (ІІ) нітрат масою 25 г. Яка масова частка солі в розчині? 6. Яку масу кальцій хлориду треба взяти, щоб приготувати розчин масою 80 г з масовою часткою речовини 8%? ІІ рівень 1. До розчину магній сульфату масою 300 г з масовою часткою солі 15% долили 200 см3 води. Яка масова частка речовини в новому розчині? (9%) 2. До розчину купрум (ІІ) нітрату масою 130 г з масовою часткою солі 40% долили 70 г води. Яка масова частка солі в новому розчині? (26%) 3. Яка маса кальцій гідроксиду міститься в розчині об’ємом 600 см3 з масовою часткою речовини 20%, якщо густина його 1,1 г/см3? (132 г) 4. Яку масу магній хлориду та води слід взяти, щоб приготувати розчин масою 120 г з масовою часткою речовини 8%? (9,6 г; 110,4 г) 5. Розчин цукру масою 500 г з масовою часткою речовини 30% випарили. Маса розчину, що залишився – 300 г. Яка масова частка речовини в новому розчині? (50%) 6. У медицині часто використовують 0,9%-й розчин натрій хлориду (фізіологічний розчин). Обчисліть: а) яка маса води і солі потрібна для виготовлення 2 кг фізіологічного розчину; б) яка маса солі уводиться до крові при ін’єкції 200 г такого розчину. (18г,1982; 1,8 г) 7. До 1000 г розчину 80% оцтової кислоти добавили 3 дм3 води. Знайти масову частку речовини нового розчину. (20%) 8. До розчину масою 250 г з масовою часткою розчиненої речовини 10% долили 150 см3 води. Яка масова частка розчиненої речовини в отриманому розчині? (7%) 9. Випарили 100 г води з 400 г розчину солі з масовою часткою 50%. Визначте масову частку солі в розчині після випарювання. (0,66 або 66%) 10. До розчину соди (маса розчину – 200 г, масова частка соди – 10%) додали 5 г соди. Визначити масову частку солі у розчині, що отримали. (12%) 11. Молярна концентрація нітратної кислоти 0,2 моль /дм3. Розрахувати масу речовини якщо об’єм розчину 300см3. (3,78 г) 12. 50 г KCl міститься в 400 см3 розчину, розрахувати молярну концентрацію розчину. (2,5 моль/дм3) ІІІ рівень 1. Визначити молярну концентрацію розчину, отриманого при розчиненні натрій сульфату масою 42,60 г у воді масою 300 г, якщо густина одержаного розчину дорівнює 1,12 г/см3. ( 0,98 моль/дм3) 2. Обчисліть масову частку (%) глюкози в розчині, отриманому змішуванням 200 г розчину з масовою часткою глюкози 40% і 600 г з масовою часткою глюкози 5%. (13,75) 3. В 200 см3 розчину міститься 4,9 г сульфатної кислоти. Обчисліть: а) молярну концентрацію сульфатної кислоти; б) молярну концентрацію еквівалента сульфатної кислоти. (0,25 моль/дм3; 0,5 моль/дм3) 4. Є розчин натрій гідроксиду об’ємом 200 см3 з масовою часткою речовини 5%. Яку масу води треба долити, щоб добути розчин з масовою часткою 2%? (316,2 г) 5. Розрахуйте, який об’єм 96%-го розчину сульфатної кислоти (густина розчину 1,836 г/см3) треба взяти для того, щоб приготувати 0,5 дм3 розчину, молярна концентрація кислоти в якому 0,2 моль/дм3. (5,56 см3) Практична робота № 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||

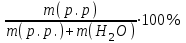 2. Підставляємо значення:
2. Підставляємо значення: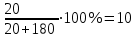
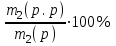
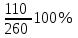 =
=