контрольная работа по микробиологии. Ветеринарная микробиология и микология
 Скачать 111 Kb. Скачать 111 Kb.
|
|
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение Высшего профессионального образования «Якутская государственная сельскохозяйственная академия» Факультет ветеринарной медицины Кафедра паразитологии и эпизоотологии животных Контрольная работа по дисциплине: «Ветеринарная микробиология и микология» Выполнил: студент 3 курса гр. Вет 15(z) Ногнорутова Екатерина Панипатьевна Проверил: к.в.н. профессор Протодьяконова Галина Петровна Якутск 2017 Содержание 1). Строение риккетсий и хламидий……………………………………………3 2). Определение чувствительности антибиотиков…………………………….6 3). Факторы естественной резистентности…………………………………….10 4). Иммунологическая толерантность………………………………………….12 5). Возбудитель паратуберкулеза……………………………………………….15 1). Строение риккетсии и хламидий. Риккетсии и хламидии — это микроорганизмы, занимающие промежуточное положение между бактериями и вирусами. Как и вирусы, они являются облигатными внутриклеточными паразитами и могут размножаться только в клетке-хозяине. Однако, по своему строению являются мелкими грамотрицательными бактериями. Риккетсии Риккетсии — мелкие, грамотрицательные полиморфные бактерии (0,3-2,0 мкм), облигатные внутриклеточные паразиты. Капсул и спор не образуют. Жизненный цикл риккетсий включает две стадии — вегетативную (внутриклеточную) и покоящуюся. Вегетативные формы активно размножаются бинарным делением в цитоплазме, а некоторые — в ядре инфицированных клеток, используя энергетические системы клетки-хозяина, поскольку не способны синтезировать кофермент НАД и др. метаболиты. Покоящаяся форма обладает повышенной резистентностью с утолщенной клеточной стенкой и уплотненной цитоплазмой. Обитают в организме членистоногих (вшей, блох, клещей), которые являются их хозяевами или переносчиками. Форма и размер риккетсий могут меняться (клетки неправильной формы, нитевидные, кокковидные, бациллярные) в зависимости от условий роста. В мазках и тканях их окрашивают по Романовскому-Гимзе, по Здродовскому или по Маккиавелло (риккетсии красного цвета, а инфицированные клетки — синего). Таксономия риккетсийосновывается на сравнении фенотипических, в том числе антигенных характеристик, клинико-эпидемиологических особенностях болезней, а также молекулярно-генетических данных, присущих отдельным представителям риккетсий. До недавнего времени семейство риккетсии включало роды Rickettsia, Orientia, Ehrlichia и Coxiella. По современной классификации (Е. П. Лукин, А. А. Воробьев, А. С. Быков, 2001), семейство Rickettsiaceae относится к классу Alphaproteobacteria (альфа-1 протеобактерии) и включает три рода: Rickettsia, Orientia, и Ehrlichia. Род Coxiella исключен из семейства Rickettsiaceae и отнесен к гамма-протеобактериям (близкое родство к легионеллам). Патогенные для человека риккетсии вызывают риккетсиозы; среди них выделяют группы сыпных тифов (R.prowazekii, R.typhi) и пятнистых лихорадок (R.ricketsii, R.conorii), Ку-лихорадку (C.burnetii) и др. Хламидии Хламидии относятся к облигатным внутриклеточным кокковидным грамотрицательным (иногда грамвариабельным) бактериям. Они размножаются только в живых клетках. Вне клеток хламидии имеют сферическую форму (0,3 мкм), метаболически неактивны и называются элементарными тельцами. В клеточной стенке элементарных телец имеется главный белок наружной мембраны и белок, содержащий большое количество цистеина. Элементарные тельца попадают в эпителиальную клетку путем эндоцитоза с формированием внутриклеточной вакуоли. Внутри клеток они увеличиваются и превращаются в делящиеся ретикулярные тельца, образуя скопления в вакуолях (включения). Из ретикулярных телец образуются элементарные тельца, которые выходят из клеток путем экзоцитоза или лизиса клетки. Вышедшие из клетки элементарные тельца вступают в новый цикл, инфицируя другие клетки. Согласно последним данным семейство Chlamydiaceae включает два рода: собственно Chlamydia и новый род Chlamydophila; в последний входят виды C.pecorum, C.pneumonia и C.psittaci. Род Chlamydia включает, кроме C.trachomatis, два новых вида: C.muridarum и C.suis, выделенных соответственно от мышей, золотистых хомячков и от свиней. Изучают хламидии в живом состоянии с использованием фазово-контрастной микроскопии и окрашивают по методу Романовского-Гимзы (элементарные тельца окрашиваются в розовый, ретикулярные — в сине-голубой цвет), а также в реакции иммунофлюоресценции (РИФ) и с помощью генетических методов (ПЦР). У человека вызывают хламидиозы: C.trachomatis (возбудитель трахомы, урогенитальных инфекций), C.psittaci (орнитоз), C.pneumoniae (различные формы респираторных инфекций).  2). Определение чувствительности антибиотиков. Методы определения чувствительности к антибиотикам Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения. Определение чувствительности бактерий к антибиотикам: диффузионные методы с использованием дисков с антибиотиками с помощью Е-тестов методы разведения разведение в жидкой питательной среде (бульоне) разведение в агаре При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35о-37оС в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1).  Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом. Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК). 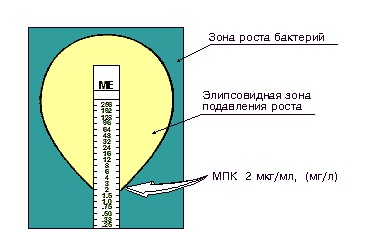 Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов. Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод. Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35о-37оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3). Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий  Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде. Интерпретация результатов определения чувствительности На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).  Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК. Пограничные концентрации не являются неизменными величинами. Они могут пересматриваться, в зависимости от изменения чувствительности популяции микроорганизмов. Разработкой и пересмотром критериев интерпретации занимаются ведущие специалисты (химиотерапевты и микробиологи), входящие в специальные комитеты. Одним из них является Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards - NCCLS). В настоящее время стандарты NCCLS признаны в мире и используются как международные для оценки результатов определения чувствительности бактерий при многоцентровых микробиологических и клинических исследованиях. Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии. 3). Факторы естественной резистентности. Естественную резистентность (устойчивость) организма к огромному множеству окружающих его инфекционных гентов обеспечивает также целый ряд специфических факторов защиты, которые не распознают попадающие в организм различными путями вещества как снетически чужеродный материал, но в '-элыиинстве случаев действуют не менее эффективно, чем факторы приобретенного иммунитета, способствуя их удалению. Среди факторов естественной резистентности принято выделять: 1) естественные барьеры (кожа и слизистые оболочки - поверхности, которые первыми вступают в контакт с возбудителями инфекций); 2) систему фагоцитов, включающую -нейтрофилы и макрофаги; 3) систему комплементов (совокупность сывороточных белков), тесно взаимодействующую с фагоцитами; 4) интерфероны; 5) различные вещества, в основном белковой природы, участвующие прежде - сего в реакциях воспаления; некоторые из них (лизоцим) обладают прямым бактерицидным действием. Аллергия - патологически повышенная специфическая чувствительность организма к веществам с антигенными свойствами (аллергенам). Аллергены делятся на экзогенные, попадающие в организм из внешней среды, и эндогенные, имеющиеся или образующиеся в самом организме. Гаптены - низкомолекулярные вещества небелкового происхождения, которые приобретают антигенные аллергенные свойства только после соединения с белками организма. Все аллергические реакции делятся на две группы: немедленного и замедленного типа. Анафилаксия - опасная для жизни общая аллергическая реакция немедленного типа. Самой частой причиной анафилактического шока у человека являются антибиотики. Физические аллергии - аллергические реакции, вызываемые физическими факторами, включая физические нагрузки. Предвестниками полномасштабной анафилаксии на физические усилия, как правило, являются ощущение жара, покраснение, крапивница с диаметром пятен от 10 до 15 мм. При малейших проявлениях данной патологии следует прекратить физическую нагрузку и немедленно ввести подкожно адреналин. 4). Иммунологическая толерантность. Иммунологическая толерантность — явление, противоположное иммунному ответу и иммунологической памяти. Проявляется она отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания. Иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену. Открытию иммунологической толерантности предшествовали работы Р. Оуэна (1945), который обследовал разнояйцовых телят-близнецов. Ученый установил, что такие животные в эмбриональном периоде обмениваются через плаценту кровяными ростками и после рождения обладают одновременно двумя типами эритроцитов — своими и чужими. Наличие чужеродных эритроцитов не вызывало иммунную реакцию и не приводило к внутрисосудистому гемолизу. Явление было названо эритроцитарной мозаикой. Однако Оуэн не смог дать ему объяснение. Собственно феномен иммунологической толерантности был открыт в 1953 г. независимо чешским ученым М. Гашеком и группой английских исследователей во главе с П. Медаваром. Гашек в опытах на куриных эмбрионах, а Медавар — на новорожденных мышатах показали, что организм становится нечувствительным к антигену при его введении в эмбриональном или раннем постнатальном периоде. Иммунологическую толерантность вызывают антигены, которые получили название толерогены. Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды. Иммунологическая толерантность бывает врожденной и приобретенной. Примером врожденной толерантности является отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума. Приобретенная толерантность может быть активной и пассивной. Активная толерантность создается путем введения в организм толерогена, который формирует специфическую толерантность. Пассивную толерантность можно вызвать веществами, тормозящими биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.). Иммунологическая толерантность отличается специфичностью — она направлена к строго определенным антигенам. По степени распространенности различают поливалентную и расщепленную толерантность. Поливалентная толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант. Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизма и толерогена. Так, на проявление толерантности влияет возраст и состояние иммунореактивности организма. Иммунологическуютолерантность легче индуцировать в эмбриональном периоде развития и в первые дни после рождения, лучше всего она проявляется у животных со сниженной иммунореактивностью и с определенным генотипом. Наибольшей толерогенностью обладают наименее чужеродные по отношению к организму антигены, имеющие малую молекулярную массу и высокую гомогенность. Легче всего формируется толерантность на тимуснезависимые антигены, например, бактериальные полисахариды. Важное значение в индукции иммунологической толерантности имеют доза антигена и продолжительность его воздействия. Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств высококонцентрированного антигена. При этом наблюдается прямая зависимость между дозой вещества и производимым им эффектом. Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена. Соотношение «доза-эффект» в этом случае имеет обратную зависимость. В эксперименте толерантность возникает через несколько дней, а иногда часов после введения толерогена и, как правило, проявляется в течение всего времени, пока он циркулирует в организме. Эффект ослабевает или прекращается с удалением из организма толерогена. Обычно иммунологическая толерантность наблюдается непродолжительный срок — всего несколько дней. Для ее пролонгирования необходимы повторные инъекции препарата. Паратуберкулез'>5). Возбудитель паратуберкулеза. Паратуберкулез (Paratuberculosis), паратуберкулёзный энтерит, болезнь Ионе, хроническая инфекционная болезнь жвачных, протекающая в основном латентно и характеризующаяся при клинических проявлениях прогрессирующим истощением, периодической диареей и летальным исходом. Паратуберкулез распространён во многих странах Европы, Америки, в Австралии и ряде стран Юго-Восточной Азии. Этиология. Возбудитель болезни - Mycobacterium paratuberculosis, или Mycobacterium johnei - тонкая короткая полиморфная палочка с округлыми краями величиной 0,5-1,5 X 0,2-0,5 мкм, не образует спор, неподвижна, грамположительна, кислото-спирто-антиформинустойчива, красится по Цилю - Нельсену. Возбудитель паратуберкулеза - облигатный паразит, который не размножается вне животного организма; очень плохо растет на искусственных питательных средах. Обладает значительной устойчивостью к воздействию факторов окружающей среды и различных дезинфицирующих средств. Эпизоотология. К микобактериям паратуберкулеза восприимчивы крупный рогатый скот, овцы, козы, верблюды, северные олени и др. домашние и дикие жвачные. Основной источник возбудителя - клинически и латентно больные животные. У них поражения локализуются в кишечнике, откуда возбудитель в огромном количестве выделяется с фекалиями во внешнюю среду. Выделяемые микобактерии в значительной степени инфицируют кожу и шерсть животных, пастбища, водоисточники, помещения, фураж и др. Самым опасным является то, что латентно больные животные, почти не отличаясь по внешнему виду от здоровых, остаются постоянными источниками возбудителя инфекции. В естественных условиях заражение жвачных происходит главным образом через загрязнённые, инфицированные фекалиями корм и воду. Течение и симптомы. Различают бессимптомное, или латентное, и клиническое течение П. Латентно больные животные отстают в росте, теряют упитанность, никогда её не восстанавливая. У животных с хорошей сопротивляемостью организма, при нормальных условиях кормления и содержания может наступать выздоровление. Скрытое течение переходит в клинически проявляющуюся болезнь вследствие различных причин, снижающих резистентность организма. Клинические симптомы проявляются чаще у коров 3-5 летнего возраста после 1 го или 2 го отёла. Первые признаки болезни: снижение молочной продуктивности, появление отёков в подчелюстном пространстве и в области подгрудка. Больные животные заметно худеют. Появляется диарея, вначале перемежающаяся, а затем приобретающая все более стойкий характер. Фекалии жидкие, распространяющие неприятный запах, содержат комочки слизи, иногда следы крови и пузырьки газа. Обычно при диарее нет повышения температуры тела и болей, аппетит и жвачка сохраняются, из-за обезвоживания организма усиливается жажда. Животные всё больше худеют, особенно резко уменьшаются мышцы крупа и задних конечностей. Быстро развивающееся истощение приводит к потере экономической ценности животного. От начала появления клинических признаков до смерти животного проходит 2-4 мес. Патологоанатомические изменения чаще обнаруживают в заднем отрезке тонких кишок. Характерно утолщение слизистой оболочки поражённых участков кишечника в 5-10, а иногда в 20 раз. При поперечном разрезе просвет кишки сильно сужен. При продольном разрезе выступает резко выраженная продольная и поперечная складчатость слизистой оболочки. Складки при растягивании не расправляются. Брыжеечные и илеоцекальные лимфатические узлы увеличенные, набухшие, упругие, на разрезе влажные. Поверхность разреза мозговидная или серо-жёлтая. У отдельных животных наблюдается отёк серозной оболочки кишечника и брыжейки, а лимфатические сосуды выступают в виде упругих тяжей. Кишечные ворсинки увеличены, имеют вид колбообразных вздутий или сливаются, а рядом расположенные ворсинки сдавлены и атрофированы. Диагноз ставят на основании эпизоотологических и клинических данных, аллергической пробы, лабораторных исследований (бактериологических и серологических). Для подтверждения диагноза у животных с клиническим течением проводят бактериоскопию фекалий на наличие возбудителя. Только положительные результаты исследования фекалий подтверждают диагноз на паратуберкулез, отрицательные данные не дают основания снимать подозрение на паратуберкулез. Для аллергической диагностики используют туберкулин для птиц. Для серологического диагноза применяют РСК. При клиническом течении паратуберкулеза РСК - наиболее точный метод диагностики. Паратуберкулез дифференцируют от алиментарных поносов, кокцидиоза, стронгилоидоза и туберкулёза. [Лечение неэффективно]. Профилактика и методы борьбы. В неблагополучном по паратуберкулезу крупного рогатого скота хозяйстве всех животных периодически подвергают клиническому осмотру. Животных, имеющих симптомы болезни, сдают на убой. У остальных животных (старше 18 мес) исследуют кровь на РСК. Животных с положительными показаниями РСК через 2-3 нед исследуют с помощью РСК повторно и одновременно проверяют аллергической пробой. Животных с положительными показаниями РСК и аллергической пробы сдают на убой, остальных оставляют в стаде. В дальнейшем животных исследуют таким же методом 2 раза в год. Молодняк до 18 месячного возраста исследуют аллергической пробой. Положительно и сомнительно реагирующих изолируют и исследуют ещё раз через 30-45 сут. Животных, давших после повторного исследования положительные реакции, сдают на убой, остальных возвращают в стадо. В хозяйстве, неблагополучном по паратуберкулезу, телят выращивают изолированно. |
