Анциферов_автореферат (Final). Выделение из кислых шахтных отходов и культивирование сульфатредуцирующих бактерий, перспективных для образования сульфидов металлов
 Скачать 1.83 Mb. Скачать 1.83 Mb.
|
|
Устойчивость к металлам. Предельные концентрации Ni(II), Co(II), Cu(II) и Cd(II), позволяющие рост, были определены для всех штаммов (таблица 4). Наибольшая устойчивость к кобальту (II) была зафиксирована для штамма Desulfovibrio sp. VK. Присутствие металлов в среде способствовало удлинению лаг-фазы всех исследуемых штаммов. Таблица 4. Предельные концентрации металлов, позволяющие рост штаммов СРБ, определенные при оптимальных значениях рН
Образование сульфидов Co(II) при периодическом культивировании. Кристаллические сульфиды кобальта, джайпурит (CoS) и кобальтпентландит (Co9S8), были получены при культивировании Desulfosporosinus sp. NP, Desulfovibrio sp. VK, Desulfovibrio sp. ED и Desulfovibrio sp. DV (рис. 9). В химических контролях без клеток сульфиды кобальта отсутствовали, что свидетельствует о важной роли клеточных структур при нуклеации кристаллов. Элементные карты на ультратонких срезах клеток подтвердили обогащение клеточной стенки бактерий S и Co. Культивирование СРБ в непрерывном режиме. Попытки культивирования ацидофильных штаммов из коллекции лаборатории, Desulfosporosinus sp. I2 и Desulfosporosinus sp. BG, в режиме рН-стата в биореакторе не дали положительных результатов. В культуре Desulfosporosinus sp. I2 лизис происходил после 70 часов культивирования, в то время как Desulfosporosinus sp. BG оставались интактными в биореакторе в течение более 300 часов, однако деления клеток и увеличения биомассы не происходило. Попытки выращивания чистой культуры Desulfosporosinus sp. NP в протоке, как в режиме рН-стата, так и в отсутствие контроля рН, не были успешными. Проблема введения ацидофильных Desulfosporosinus sp. NP была решена путем создания бинарной культуры, состоящей из Desulfosporosinus sp. NP и Desulfvibrio sp. VK. Культура была успешно культивирована в биореакторе с использованием смеси субстратов (3 мМ лактат + 2.5 мМ фруктоза) при начальном рН 4.5. Существенные различия в морфологии культур позволили учитывать численность клеток двух штаммов без применения молекулярных зондов. На поздних этапах культивирования (после 756 часов) путем создания селективных условий по питательному субстрату (5 мМ фруктоза) удалось добиться стабильного доминирования клеток Desulfosporosinus. Далее культивирование продолжили при рН 5.4 с постоянной скоростью подачи среды 13 мл/ч для исследования осаждения металлов и образования сульфидов. 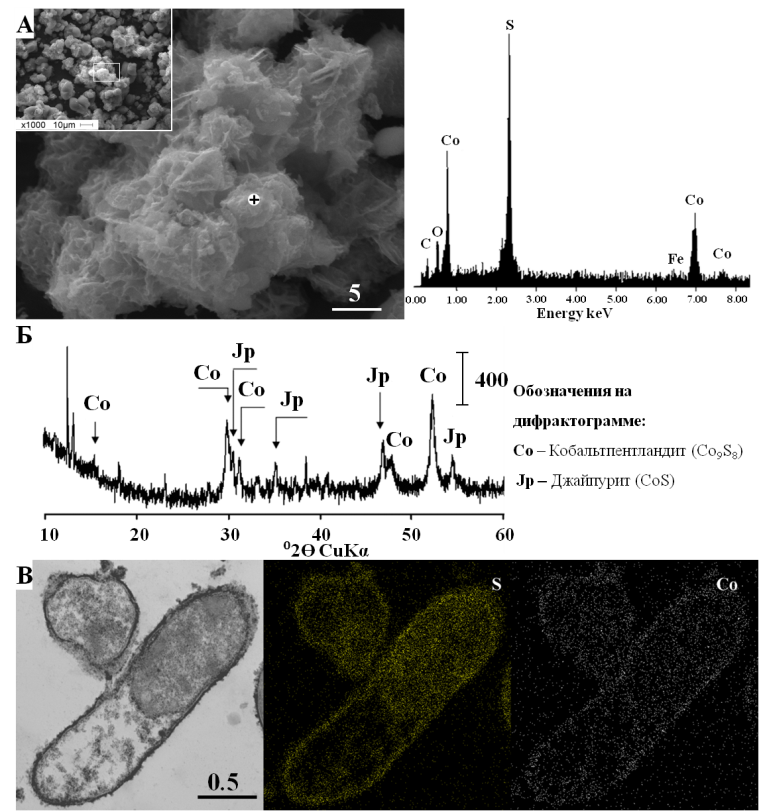 Рис. 9. Образование кристаллических сульфидов кобальта Desulfovibrio sp. DV в периодической культуре на среде с лактатом в присутствии 1000 мг/л Co(II) в течение 28 суток: (А) SEM осадка и соответствующий ЭДС-спектр; (Б) XRD анализ кристаллических фаз (В) ТЕМ ультратонких срезов клеток и элементарные карты, показывающие связь S и Co с клеточной стенкой. Размер линейки в мкм. Получение сульфидов Co(II) и Cu(II) в биореакторе с проточным режимом культивирования. Для изучения осаждения металлов под действием бинарной культуры СРБ, начиная с точки 1761 час, в биореактор начали подавать питательную среду с ионами меди (II) в концентрации 50 мг/л (рис. 10 А). Начальную концентрацию ионов меди постепенно повышали до 100, 150 и 200 мг/л, при этом концентрация металла в пробах культуральной жидкости из биореактора находилась в диапазоне 0.4 – 4.5 мг/л. Таким образом, осаждение меди составило более 95%. После 3156 часов культивирования по той же схеме в среду добавляли ионы кобальта (II) (рис. 10 Б). Увеличение концентрации ионов Co(II) в протоке до 200 мг/л вызвало лизис клеток (рис. 10 Б). Осадки, образованные бинарной культурой в протоке в присутствии ионов меди и кобальта, были собраны в нескольких временных точках для проведения физико-химического анализа. SEM-EDS анализ показал присутствие меди, серы и железа во всех исследованных осадках. Образование кристаллических сульфидов меди – халькопирита (CuFeS2), кубанита (CuFe2S3), орикита ((CuFeS2)xH2O) наблюдали после 265 часов от начала подачи питательной среды, содержащей медь в концентрации 50 мг/л (2026 часов от начала культивирования) (таблица 5). Повышение концентрации меди в питательной среде приводило к образованию сульфидов меди, дефицитных по железу, ярровита (Cu9S8) и халькоцита (Cu2S) (таблица 5). При увеличении концентрации Cu(II) в подаваемой среде до 200 мг/л происходила смена кристаллических фаз, и формировались другие кристаллические сульфиды меди - халькопирит (CuFeS2) и ковеллит (CuS) (таблица 5). Вероятно, концентрация Cu(II) в среде служит фактором, определяющим кристаллическую форму образуемых сульфидов. Через 3150 часов от начала культивирования в биореакторе ионы меди в подаваемой питательной среде были заменены на Сo(II). Рентгенофазовый анализ осадков, образованных культурой в условиях подачи Co(II), показал отсутствие кристаллических сульфидов кобальта после 120 часов культивирования. Единственными кристаллическими сульфидами были сульфиды меди, ковеллит (CuS) и халькопирит (CuFeS2), и сульфид железа, марказит (FeS2) (таблица 5). Кристаллическую фазу, соответствующую сульфиду кобальта, линнеиту (Co3S4), обнаружили только через 292 часа после начала подачи питательной среды, содержащей Co(II) (3448 часов после начала культивирования) (таблица 5). В составе осадка, собранного в точке 3448 часов, также присутствовали кристаллические сульфиды железа и меди, пирротин (Fe7S8), халькопирит (CuFeS2) и халькоцит (Cu2S) (таблица 5). В сульфидных отложениях, обнаруженных на внутренних поверхностях биореактора после завершения эксперимента, рентгенофазовый анализ выявил кристаллические фазы халькопирита (CuFeS2), джайпурита (CoS) и гидрата сульфита кобальта (CoSO3×2.5H2O). 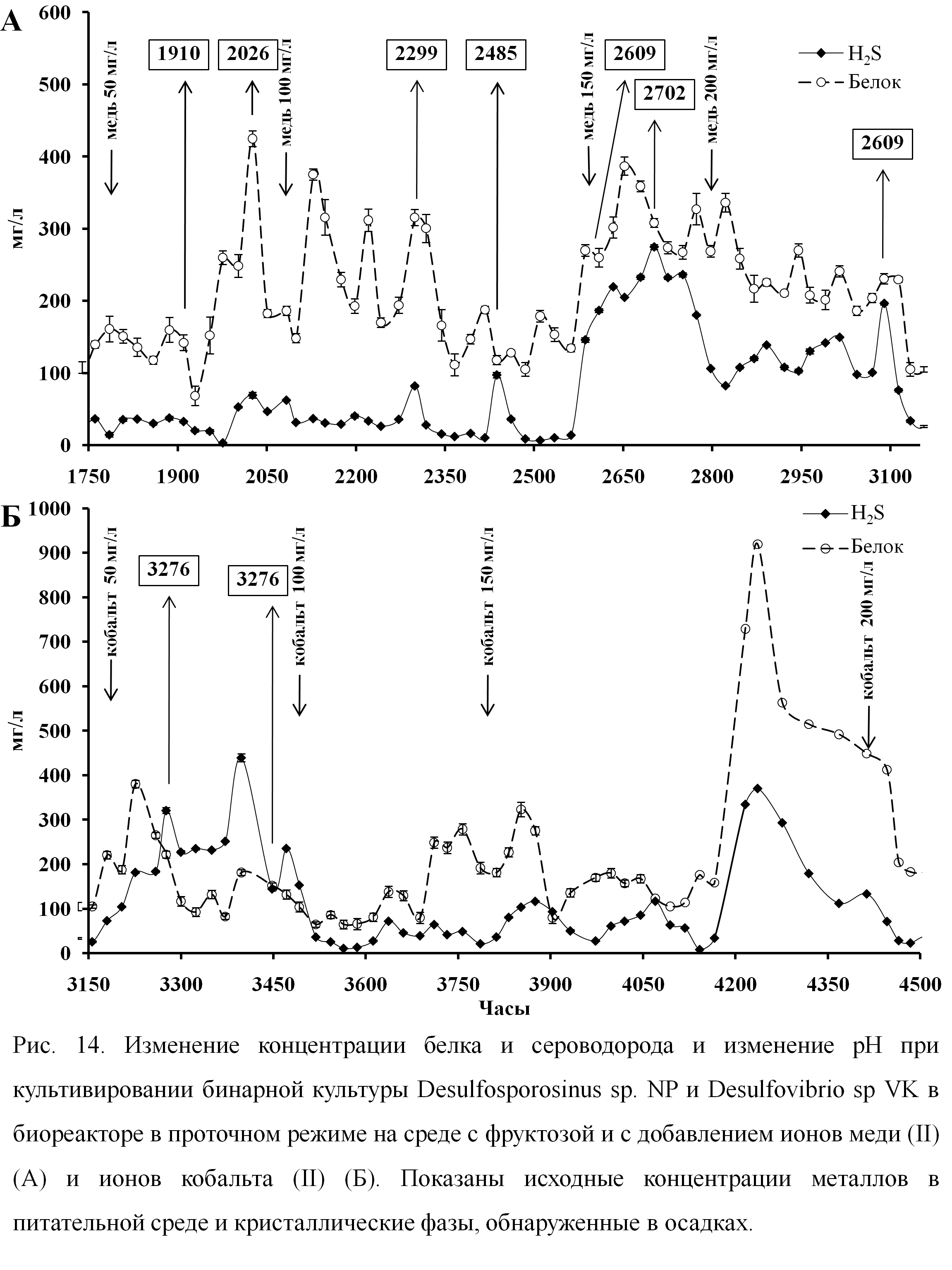 Рис. 10. Изменение концентрации белка и сероводорода и изменение рН при культивировании бинарной культуры Desulfosporosinus sp. NP и Desulfovibrio sp. VK в биореакторе с добавлением ионов меди (II) (А) и ионов кобальта (II) (Б). Показаны исходные концентрации металлов в питательной среде и временные точки (часы), в которых определяли кристаллические фазы (n=3). Таблица 5. Кристаллические фазы, образованные в биореакторе при непрерывном культивировании бинарной культуры Desulfosporosinus sp. NP и Desulfovibrio sp. VK, в присутствии ионов меди и кобальта
ЗАКЛЮЧЕНИЕ Новый подход к культивированию и использование временного градиента рН в биореакторе позволили получить ацидофильные/ацидотолерантные СРБ, относящиеся к роду Desulfovibrio. Ранее все попытки выделения чистых культур этого рода оставались безуспешными, хотя присутствие молекулярных подписей было обнаружено в различных кислых шахтных дренажах. Однако, представители рода Desulfosporosinus способны расти при более низких значениях рН. В частности, выделенный нами из отходов добычи полиметаллических руд в Забайкалье Desulfosporosinussp. NP, мог расти в пределах pH от 1.3 до 6.7. В то время как ни один из выделенных Desulfovibrio не выдерживал рН ниже 2.8. В связи с возможным использованием новых ацидо- и метал- толерантных СРБ в качестве штаммов-продуцентов в биотехнологических схемах, исследовали устойчивость изолятов Desulfovibrio к кислороду и определяли наличие механизмов защиты от окислительного стресса. Устойчивость к кислороду у исследованных штаммов была ниже по сравнению с модельным СРБ Desulfovibriovulgaris Hildeborough, однако в клетках новых штаммов Desulfovibrio обнаружено присутствие цитохрома bd, одного из возможных механизмов защиты от токсического действия кислорода. Все новые штаммы Desulfovibrio способны восстанавливать кислород, используя лактат в качестве донора электронов, что может обеспечивать защиту от О2. Для штамма ED также показано восстановление кислорода в присутствии других органических доноров электронов: этанола, пептона и глицерола. С точки зрения возможного использования ацидофильных СРБ в технологиях осаждения/получения сульфидов металлов и культивирования Desulfosporosinus в условиях непрерывной культуры может быть перспективным разработанный нами подход создания бинарных культур с Desulfovibrio. Изменение условий культивирования в биореакторе позволяло получать различные кристаллические сульфиды меди и кобальта. Образование твердых фаз сульфидов меди в отличие от сульфидов кобальта происходило эффективно в условиях непрерывного культивирования. При этом эффективность удаления ионов меди из раствора достигала 95%. Для биоминерализации Co, в том числе для получения микрокристаллов, перспективных для использования в качестве современных катализаторов, предпочтительными были условия периодической культуры. ВЫВОДЫ Выделены в чистую культуру и охарактеризованы новые ацидофильные сульфатредуцирующие бактерии Desulfosporosinus sp. NP, способный к росту от 1.3 до 6.7, и Desulfovibrio sp. DV (оптимальный рН 5.5), перспективные для получения сульфидов металлов. Путем создания градиента pH в биореакторе обогащены и выделены в чистые культуры ацидофильный Desulfovibrio sp. VK и ацидотолерантный Desulfovibrio sp. ED, устойчивые к ионам кобальта в концентрации 3.5 г/л и 2.0 г/л, соответственно. Определена последовательность генома (драфт) ацидофильного устойчивого к металлам Desulfovibrio sp. DV. Обнаружены транспортеры калия (Kdp ATPаза) и натрия (Na+/протон антипортер), которые могут обеспечивать устойчивость к низким рН, а также потребляющие протоны декарбоксилазы аминокислот. Устойчивость к Co(II) могут обеспечивать транспортеры CorA-ZntB и RND-транспортер Czc. При непрерывном культивировании в биореакторе Desulfosporosinus sp. NP и Desulfovibrio sp. VK получены кристаллические сульфиды меди: ярровит (Cu9S8), халькоцит (Cu2S) и ковеллит (CuS), достигнуто осаждение меди из среды до 95%. Показана способность к образованию макро- и микрокристаллов сульфида кобальта, джайпурита (CoS) и кобальтпентландита (Co9S8), чистыми культурамиDesulfosporosinus sp. NP, Desulfovibrio sp. ED, Desulfovibrio sp. DV и Desulfovibrio sp. VK при периодическом культивировании. СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ Экспериментальные статьи 1. Antsiferov D.V., Fyodorova T.S., Kovalyova A.A., Lukina A., Frank Y.A., Avakyan M.R., Banks D., Tuovinen O.H., Karnachuk O.V. (2017) Selection for novel, acid-tolerant Desulfovibrio spp. from a closed Transbaikal mine site in a temporal pH-gradient bioreactor. Antonie van Leeuwenhoek. doi:10.1007/s10482-017-0917-4. 2. Kovaliova A.A., Kadnikov V.V., Antsiferov D.V., Beletsky A.V., Danilova E.V., Avakyan M.R., Mardanov A.V., Karnachuk O.V. (2017) Genome sequence of the acid-tolerant Desulfovibrio sp. DV isolated from the sediments of a Pb-Zn mine tailings dam in the Chita region, Russia. Genomics Data. V. 11. P. 125–127. 3. Mardanov A.V., Panova I.A., Beletsky A.V., Avakyan M.R., Kadnikov V.V., Antsiferov D.V., Banks D., Frank Y.A., Pimenov N.V., Ravin N.V., Karnachuk O.V. (2016) Genomic insights into a new acidophilic, copper-resistant Desulfosporosinus isolate from the oxidized tailings area of an abandoned gold mine. FEMS Microbiology Ecology. V. 9 (8)2. fiw111. 4. Frank Y.A., Banks D., Avakyan M.R., Antsiferov D.V., Kadychagov P.B. and Karnachuk O.V. (2016) Firmicutes is an important component of microbial communities in water-injected and pristine oil reservoirs; Western Siberia, Russia. Geomicrobiology J. V. 33(5). P. 387-400. Тезисы конференций 1. Karnachuk O., Ikkert O., Antsiferov D., Fyodorova T., Panova I., Kovalyova A., Bushuieva M., Zakharova A., Ravin N., Tuovinen O.H. Novel acidophilic, metal-tolerant sulfate-reducing bacteria can produce nano-size transition metal sulfides. Extremophiles 2016. Book of Abstracts. 11th International Congress on Extremophiles. September 12-16, Kyoto, Japan. Р. 330. 2. Анциферов Д.В., Федорова Т.С., Латыголец Е.А., Герасимчук А.Л., Ковалева А.А., Ивасенко Д.А., Карначук О.В. Выделение ацидотолерантных Desulfovibrio с помощью культивирования в биореакторе. Материалы Х молодежной школы-конференции с международным участием «Актуальные аспекты современной микробиологии». М., 2015. С.11-13. 3. Латыголец Е.А., Анциферов Д.В., Ивасенко Д.А., Федорова Т.С., Карначук О.В. Культивирование бинарной культуры сульфатредуцирующих бактерий в биореакторе. Биотехнология, биоинформатика и геномика растений и микроорганизмов. Материалы Всероссийской молодежной научной конференции с международным участием. 26-28 апреля 2016 г. Томск: Издательский дом ТГУ. с. 113-117. 4. Бухтиярова П.А., Анциферов Д.В., Брассер Г., Дола А., Карначук О.В. Устойчивость к кислороду у сульфатредуцирующих бактерий, перспективных для осаждения металлов. Научные труды V Съезда физиологов СНГ, V Съезда биохимиков России, Конференции ADFLIM. Сочи-Дагомыс 04- 09 октября 2016 г. Acta Naturae. Т. 2. C. 239. 5. Kadnikov V.V., Mardanov A.V., Beletsky A.V., Frank Y.A., Antsiferov D.V., Karnachuk O.V., Ravin N.V. Desulforudis audaxviator inhabiting the gold mine in South Africa thrives in a deep subsurface aquifer in Siberia. Thermophiles 2017. Book of Abstracts. 14th International meeting on thermophile biology. August 27 - September 1, Mpumalanga, South Africa, № OL10.3. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
