Анциферов_автореферат (Final). Выделение из кислых шахтных отходов и культивирование сульфатредуцирующих бактерий, перспективных для образования сульфидов металлов
 Скачать 1.83 Mb. Скачать 1.83 Mb.
|
|
Молекулярные методы. Тотальную ДНК из культур СРБ выделяли с использованием набора MO BIO Power Soil DNA Kit (MO BIO Laboratories, Inc., США) в соответствии с рекомендациями производителя. Амплификацию гена 16S рРНК проводили c праймерами 27F-1492R и v3f-907r, как было описано ранее (Karnachuk et al., 2009). Реакцию проводили в амплификаторе MyСycler (BioRad). Для контроля доминирующих филотипов в накопительных культурах и для проверки чистоты полученных изолятов СРБ применяли денатурирующий градиентный гель-электрофорез (ПЦР-ДГГЭ). Процесс разделения ДНК проводили на системе DСode System (BioRad laboratories, Hercules, США). Реамплифицированные последовательности были секвенированы в ЗАО «Синтол», Москва. Последовательности анализировали с использованием программного пакета BioEdit и инструмента BLAST GenBank (http://www.ncbi.nlm.nih.gov/) (Altschul et al., 1997). Филогенетические анализы проводили с использованием программного обеспечения ARB (Ludwig et al., 2004). Чтобы определить порядок ветвления, бутстреп-анализ был выполнен с использованием 1000 альтернативных деревьев. Статистическая обработка данных. Статистический анализ данных был выполнен с помощью пакетов программного обеспечения MS Excel 2007 и OriginPro 2015. Результаты работы и их обсуждение Физико-химическая характеристика проб отходов добычи металлов. Физико-химические характеристики проб воды и матов представлены в таблице 1. Присутствие растворенных сульфатов в пробах свидетельствуют о развитых процессах окисления сульфидных минералов, генерирующих протоны. Несмотря на развитые процессы окисления, рН воды в пробе ShG14-5 был близким к нейтральному, что связано с присутствием карбонатов во вмещающих породах, нейтрализующих протоны, образующиеся при окислении сульфидов (Banks et al., 2014). Вероятно, более развитые процессы окисления в осадках ShG14-4 ответственны за слабокислый рН, в то время как рН воды из шурфа на месторождении Шерловая гора составлял 2.58. Активное окисление остаточных сульфидов и низкий рН являются причиной высоких концентраций металлов в воде пробы ShG14-1. Получение накопительных и выделение чистых культур ацидофильных СРБ. Из всех трех отобранных проб были получены накопительные культуры с признаками сульфидогенеза, которые обозначили в соответствии с названием проб: ShG-14-1, ShG-14-4 и ShG-14-5. Определение доминирующих филотипов методом ПЦР-ДГГЭ показало присутствие Desulfosporosinus и Desulfovibrio в сульфидогенных накопительных культурах (таблица 2). Прогрев накопительной культуры ShG-14-1 при 85 °С в течение 30 минут и последующая серия разведений на среде с фруктозой позволили выделить морфологически однородный изолят, обозначенный «штамм NP». Штамм NP представлен подвижными, слегка изогнутыми палочками с округлыми концами, размером 2.5-4 х 1 мкм, образующими паратерминальные споры (рис. 1А, Б). Таблица 1. Физико-химические характеристики мест отбора проб, использованных для выделения СРБ
Таблица 2. Доминирующие филотипы, выявленные в полученных накопительных культурах методом ПЦР-ДГГЭ
*ближайший валидно описанный родственник, % сходства частичной последовательности (595 п.о.) гена 16S рРНК. **Полужирным шрифтом выделены организмы с известной способностью к диссимиляционной сульфатредукции. Филогенетический анализ последовательности гена 16S рРНК, близкой к полной (1446 п.о.), поместил штамм NP в семейство Peptococcaceae, род Desulfosporosinus (рис. 2). Последовательность имела сходство 97 % с четырьмя валидно описанными видами рода Desulfosporosinus – Desulfosporosinus meridiei, Desulfosporosinus orientis, Desulfosporosinus auripigmenti и Desulfosporosinus acidiphilus. 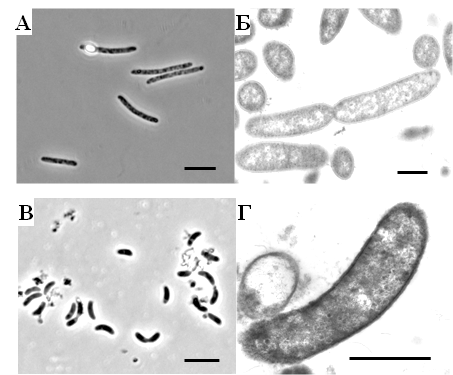 Рис. 1. Микрофотографии Desulfosporosinus sp. NP, фазовый контраст, линейка 5 мкм (А), TEM, ультратонкий срез, линейка 1 мкм (Б) и Desulfovibrio sp. DV, фазовый контраст, линейка 5 мкм (В) и TEM, ультратонкий срез, линейка 1 мкм (Г). 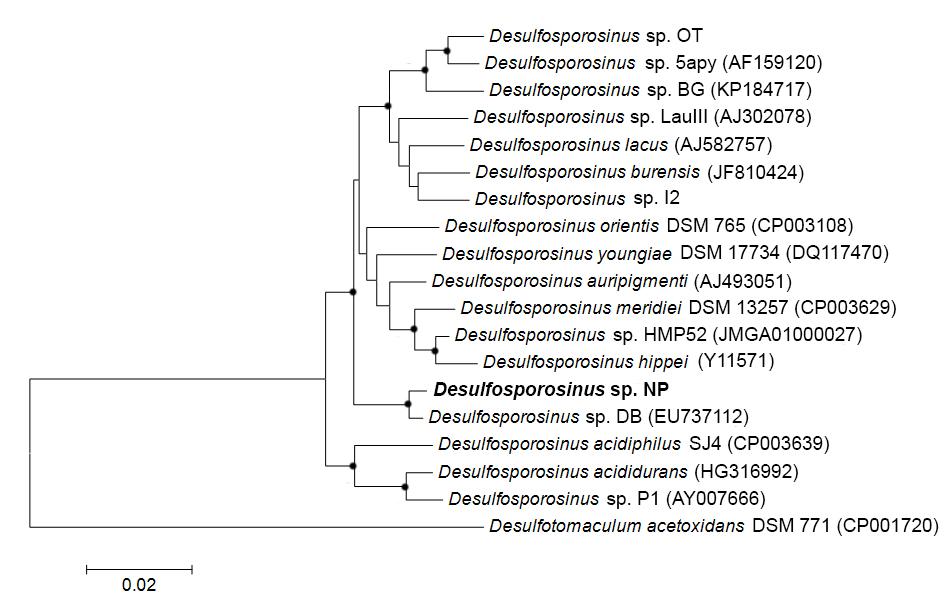 Рис. 2. Филогенетическое дерево по гену 16S рРНК, построенное методом ближайшего соседа (neighbor-joining) и показывающее положение штамма Desulfosporosinus sp NP. Узлы дерева, обозначенные кружками, характеризуются значениями бутстреппинга выше 70 %. Накопительная культура ShG-14-4 была получена на среде с этанолом при рН 5.0. ПЦР-ДГГЭ анализ определил один доминирующий СРБ-филотип, родственный Desulfovibrio mexicanus (Таблица 2). Из накопительной культуры ShG-14-4 был получен чистый изолят путем посева на твёрдую среду с последующим выделением колоний. Полученная морфологически однородная культура была обозначена «штамм DV». Изолят представлен подвижными вибрионами, размером 2.5-3 х 1 мкм (рис. 1 В, Г). Филогенетический анализ близкой к полной последовательности гена 16S рРНК (1428 п.о.) показал, что штамм DV относится к классу Deltaproteobacteria, семейству Desulfovibrionaceae, роду Desulfovibrio, а его ближайшим родственником является Desulfovibrio magneticus RS-1 со сходством последовательностей 98.5% (рис. 6). Получение чистых культур путем создания градиента рН биореакторе. В качестве инокулята для биореактора использовали накопительную культуру ShG-14-5. В биореакторе создавали градиент рН от нейтрального к кислому (рис. 3), что приводило к доминированию определенных филотипов. Отбор проб из биреактора, сопровождаемый серией разведений на среде с кислым рН, позволил выделить доминирующие организмы в чистой культуре. Параллельно проводили определение доминирующих филотипов методом ПЦР-ДГГЭ (рис. 4). 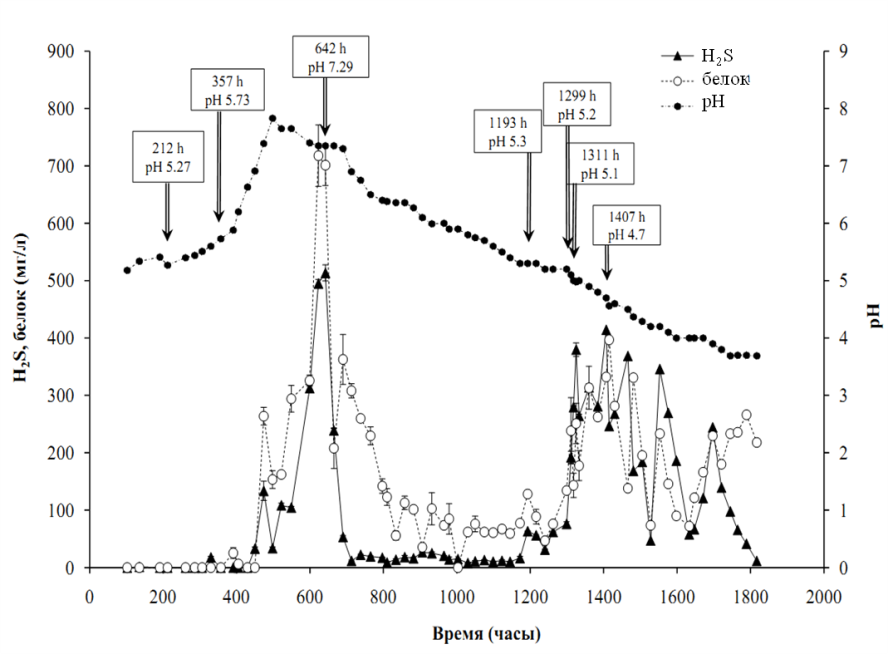 Рис. 3. Изменение рН, концентрации белка и H2S в биореакторе в процессе культивирования. Точки отбора проб и соответствующие значения рН показаны стрелками. Вертикальные линии показывают стандартное отклонение (n=3). Все обнаруженные нами филотипы, для которых известна способность к сульфатредукции, относились к роду Desulfovibrio. СРБ-филотипы относились к двум группам: Desulfovibrio aerotolerans – Desulfovibrio carbinophilus – Desulfovibrio magneticus и Desulfovibrio idahonensis – Desulfovibrio mexicanus (рис. 4). Чистая культура, обозначенная «штамм VK», была представлена подвижными вибрионами, размером 2.5-3 х 1 мкм (рис. 5 А, Б). Филогенетический анализ последовательности гена 16S рРНК штамма VK (1427 п.о.), поместил изолят в класс Deltaproteobacteria, семейство Desulfovibrionaceae, род Desulfovibrio. Ближайший родственник штамма VK - Desulfovibrio carbinoliphilus со сходством последовательности гена 16S рРНК 98.8% (рис. 6). Desulfovibrio sp. VK относится к группе Desulfovibrio aerotolerans – D. carbinophilus – D. magneticus. 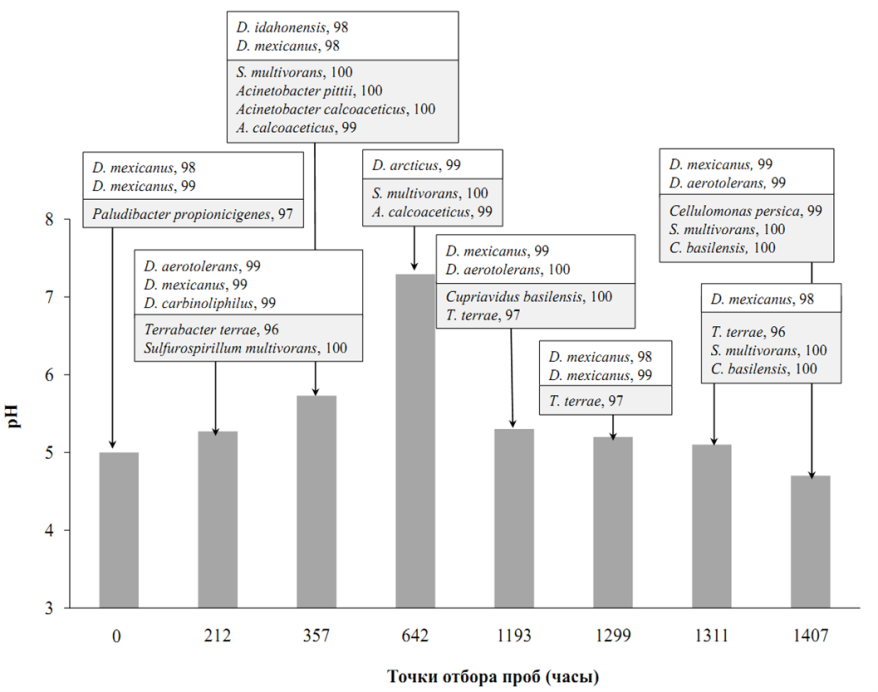 Рис. 4. Доминирующие филотипы бактерий в биореакторе и исходной накопительной культуре. Филотипы, для которых неизвестна способность к диссимиляционной сульфатредукции, выделены серым цветом. Цифрами показан процент сходства фрагмента гена 16S рРНК с ближайшим валидно описанным представителем. Чистая культура, обозначенная «штамм ED», представлена подвижными вибрионами, размером 1-1.5 х 0.3-0.5 мкм (рис. 5 В, Г). Филогенетический анализ последовательности гена 16S рРНК (1438 п.o.) помещает изолят в класс Deltaproteobacteria, семейство Desulfovibrionaceae, род Desulfovibrio. Ближайшим родственником штамма ED является Desulfovibrio idahonensis с 99.6% сходства последовательностей. Desulfovibrio sp. ED относится к группе D. idahonensis – D. mexicanus (рис. 6). 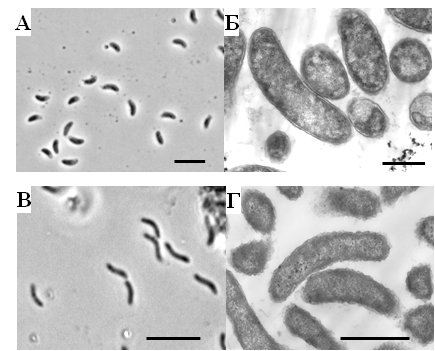 Рис. 5. Микрофотографии Desulfovibrio sp. VK, фазовый контраст, линейка 5 мкм (А), TEM, ультратонкий срез, линейка 1 мкм (Б) и Desulfovibrio sp. ED, фазовый контраст, линейка 5 мкм (В) и TEM, ультратонкий срез, линейка 1 мкм (Г). Определение предельных и оптимальных значений рН. Все выделенные штаммы Desulfosporosinus и Desulfovibrio проявляли устойчивость к низким значениям рН среды. Desulfosporosinus sp. NP рос в интервале значений рН среды от 1.3 до 6.7. Максимальную численность клеток в среде наблюдали при рН 2.0 – 2.5. Определены удельные скорости роста штаммов Desulfovibrio на среде с разными значениями рН (рис. 7). Показано, что Desulfovibrio sp. DV способен к росту при рН среды от 4.0 до 7.0. Максимальная удельная скорость роста штамма DV, 0.035 ± 0.002 ч-1, обнаружена при рН 5.5. Desulfovibrio sp. ED рос при рН среды от 3.5 до 7.8. При оптимальном рН 6.6 его удельная скорость составляла 0.07 ± 0.006 ч-1 c минимальным временем удвоения 9.9 ± 0.8 ч. Desulfovibrio sp. VK характеризовался более широким диапазоном рН для роста - от 2.8 до 7.8. Оптимальное значение рН составило 5.7. Потребление кислорода и механизмы защиты. Так как штаммы Desulfovibrio были выделены из окисленных шахтных отходов, характеризующихся положительными значениями ОВП, мы предположили наличие у них механизмов устойчивости к кислороду. В качестве референсного организма использовали Desulfovibrio vulgaris Hildenborough, имеющего защитные механизмы от токсического действия О2 (Lamrabet et al., 2011). Штаммы Desulfovibrio sp. DV, Desulfovibrio sp. VK и Desulfovibrio sp. ED не проявляли устойчивости к кислороду в концентрации 0.01%, тогда как D. vulgaris Hildenborough рос в данных условиях. 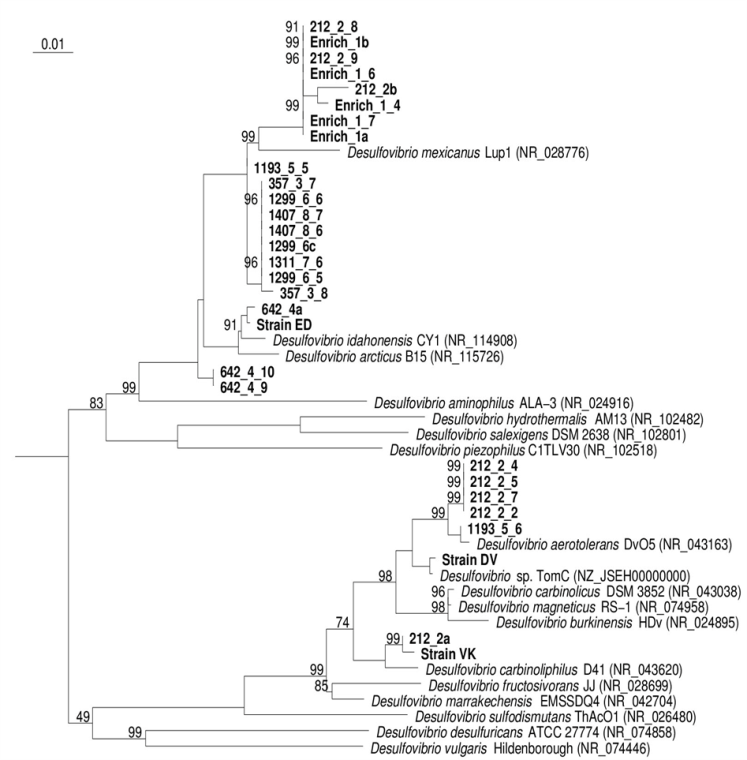 Рис. 6. Филогенетическое дерево по гену 16S рРНК, построенное методом ближайшего соседа (neighbor-joining) и показывающее положение штаммов ED, VK, DV и филотипов Desulfovibrio, определенных методом ПЦР-ДГГЭ. На спектрах поглощения клеток всех исследованных штаммов Desulfovibrio обнаружены пики, характерные для гемов цитохромоксидаз c- и d-типов (рис. 8). Это предполагает присутствие в клетках цитохромоксидаз типа с и bd, которые играют важную роль в защите анаэробных микроорганизмов от окислительного стресса в присутствии кислорода (Lamrabet et al., 2011). Количественное содержание цитохрома bd в клетках новых штаммов Desulfovibrio (0.23 – 0.24 нмоль/мг) было почти вдвое выше, чем у D. vulgaris Hildenborough. Можно предполагать, что клетки исследуемых штаммов Desulfovibrio используют защитный механизм, обеспечиваемый цитохромом bd, тогда как в защите D. vulgaris Hildenborough участвует преимущественно цитохром с. 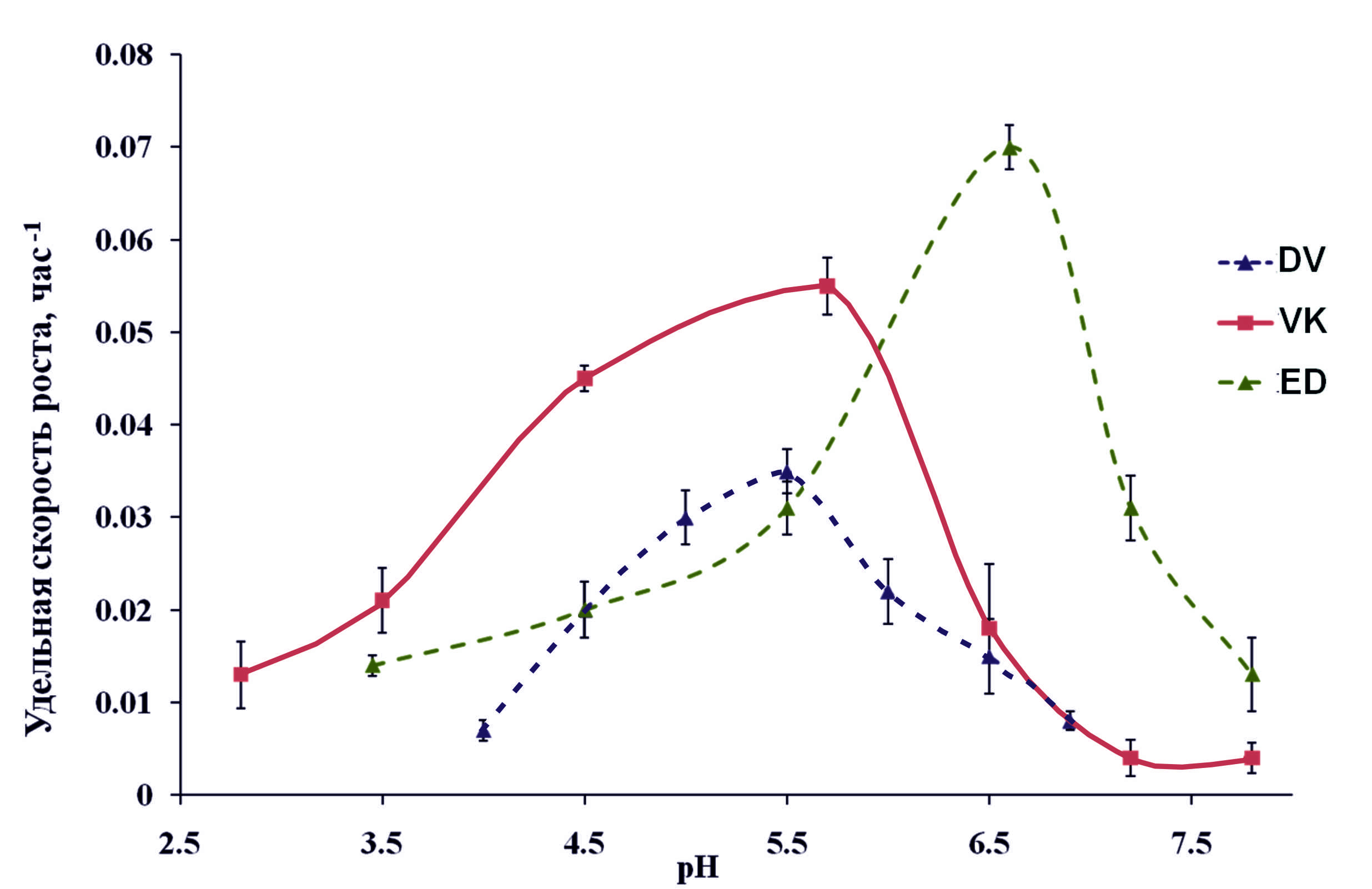 Рис. 7. Изменение удельной скорости роста Desulfovibrio sp. VК, Desulfovibrio sp. ED и Desulfovibrio sp. DV в зависимости от рН среды. Вертикальные линии показывают стандартное отклонение (n=3). 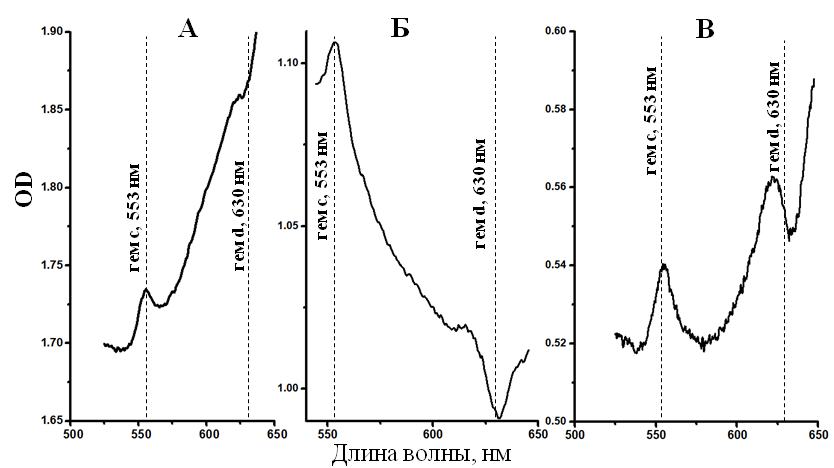 Рис. 8. Спектры поглощения клеток Desulfovibrio sp. DV (А), Desulfovibrio sp. VK (Б), Desulfovibrio sp. ED (В) в диапазоне длин волн 500 – 650 нм. Восстановление кислорода с использованием молекулярного водорода в качестве донора электронов, известное для D. vulgaris Hildenborough (Ramel et al., 2013), не было подтверждено для наших штаммов, как и способность использовать NADH с этой целью. Однако штаммы DV, ED и VK восстанавливали кислород, используя лактат в качестве донора электронов. Для штамма ED также показано восстановление кислорода в присутствии других органических доноров электронов: этанола, пептона и глицерола. Восстановление кислорода ингибировалось во всех случаях при добавлении KCN. Анализ генома Desulfovibrio sp. DV. Характеристики генома штамма Desulfovibrio sp. DV представлены в таблице 3. Таблица 3. Характеристика генома Desulfovibrio sp. DV
Одной из наиболее важных систем, участвующих в генерации внутреннего положительного потенциала на мембране клетки и защите клетки от низких рН, является Kdp-ATPаза. Гомологичная Kdp-ATРаза была найдена в геноме Desulfovibrio sp. DV. Оперон содержал регулятор транскрипции – двухкомпонентную гистидин киназу. Несколько дополнительных регулирующих гистидин киназ KdpD также присутствовало в геноме. Также в поддержании рН цитоплазмы клетки может принимать участие Na+/протон антипортер. Гомологичные транспортеры обнаружены только в единичных представителях рода Desulfovibrio. Бактерии, обитающие в кислых местообитаниях, могут использовать декарбоксилазы, потребляющие протоны, такие как аргинин декарбоксилаза. Они также найдены в геноме Desulfovibrio sp. DV. Лизин декарбоксилаза присутствовала только у членов кластера “magneticus” и отсутствовала у всех остальных Desulfovibrio. Очевидно также участие в повышении внутриклеточного рН аргинин декарбоксилазой. Штамм Desulfovibrio sp. DV был чувствителен к меди, однако мог расти при 1.7 г Co(II) на литр. Поиск в геноме показал, что три штамма из кластера “magneticus” имели одинаковые возможные транспортеры кобальта. В Desulfovibrio sp. DV это CorA_ZntB семейство транспортеров, известных для E. coli и Salmonella typhimurium. Этот белок присутствовал кроме штамма DV только в Desulfovibrio magneticus и Desulfovibrio sp. TomC. Также в геноме Desulfovibrio sp. DV присутствовали RND-транспортеры Czc, участвующие в защите от ионов кобальта, цинка и кадмия. |
