Выявление кинетики газовой коррозии бинарных сплавов
 Скачать 327.62 Kb. Скачать 327.62 Kb.
|
|
Министерство науки и высшего образования РФ федеральное государственное автономное образовательное учреждение высшего образования «Омский государственный технический университет» Факультет (институт): Машиностроительный Кафедра: Машиностроение и материаловедение секция Материаловедение и ТКМ Домашнее задание По дисциплине: Коррозия и защита материала На тему: Выявление кинетики газовой коррозии бинарных сплавов Графий-кобальт Выполнил: Шульмейстер Сергей Курс: 2, группа: М-213 Проверила: Доц., К.Н. Бургонова О.Ю. Омск 2022 год ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Решение многих задач современной техники связано с эксплуатацией материалов в условиях высоких температур. Известно, что высокие температуры вызывают значительное окисление металлов и сплавов на их основе, которое приводит к нежелательному ухудшению эксплуатационных характеристик или к разрушению. Причиной этого служит газовая коррозия. Как правило, газовая коррозия протекает по химическому механизму, т. е. металл в процессе химического взаимодействия с газом (газами) выступает в роли восстановителя, который отдает электроны и окисляется. Компонент газовой среды выступает в роли окислителя, акцептора электронов (атомы или группы атомов, принимающие электроны и образующие химическую связь). Способность материала сопротивляться газовой коррозии оценивается его жаростойкостью. На жаростойкость оказывают влияние такие факторы, как: – состав сплава и пленки; – температура; – давление и состав газа. В результате химической коррозии на поверхности материала образуется пленка из продуктов коррозии. В зависимости от свойств пленки (толщины, сплошности, эластичности, адгезии и др.) процессы коррозии могут затормозиться или ускориться. Зависимость толщины пленки от времени в общем виде определяется уравнением Эвонса 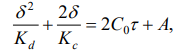 где δ – толщина пленки; τ – время ее образования; Kd – константа диффузии при данных условиях; Kс – константа скорости химической реакции 8 образования пленки; С0 – концентрация действующей среды на внешней поверхности пленки; А – постоянная интегрирования. Для очень тонких и не сплошных пленок величина 2/Kd мала по сравнению с 2/Kc и первым членом уравнения можно пренебречь. Тогда зависимость роста пленки от времени имеет вид линейного уравнения  На рис. 1 на участке AB кривая окисления близка к прямой AМ, тангенс угла наклона которой пропорционален константе скорости химической реакции. Между точками B и C идет сложная зависимость уравнения роста пленки. На участке CED имеется параболическая зависимость скорости роста пленки. Кривая ABCED – основная кривая окисления. Если после достижения величины δ’ растущая пленка становится не сплошной (например, за счет большого числа дефектов, за счет перехода в газообразное состояние или за счет высоких внутренних напряжений), то далее ее рост подчиняется линейному закону (кривая ABCEK). Иногда за счет ухудшения протекания встречной диффузии ионов металла и ионов окислителя процесс роста пленки может замедлиться или прекратиться. Этому соответствует логарифмический участок FL. Так как температура влияет на подвижность ионов, то скорость окисления (скорость роста пленки) может быть выражена уравнением 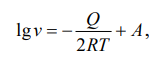 где Q – энергия активации диффузии, характеризующая изменение скорости химической коррозии с температурой; R – универсальная газовая постоянная, равная 8,3144598 Дж/(моль*К); Т – температура. Для большинства случаев основным окислителем газовой среды является кислород. Изучение взаимодействия кислорода с металлами и сплавами при различных температурах имеет большое значение в связи с их эксплуатацией в условиях высокотемпературного окисления. РАСЧЕТНАЯ ЧАСТЬ Определение законов изменения массового показателя коррозии в зависимости от температуры, химического состава и времени. 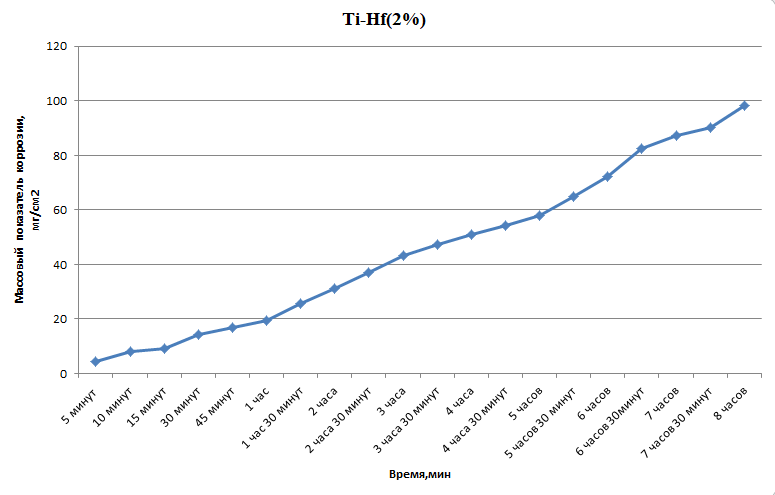 Сплав Ti-Hf(2 %) при t= 1200 °C окисляется по линейному закону. 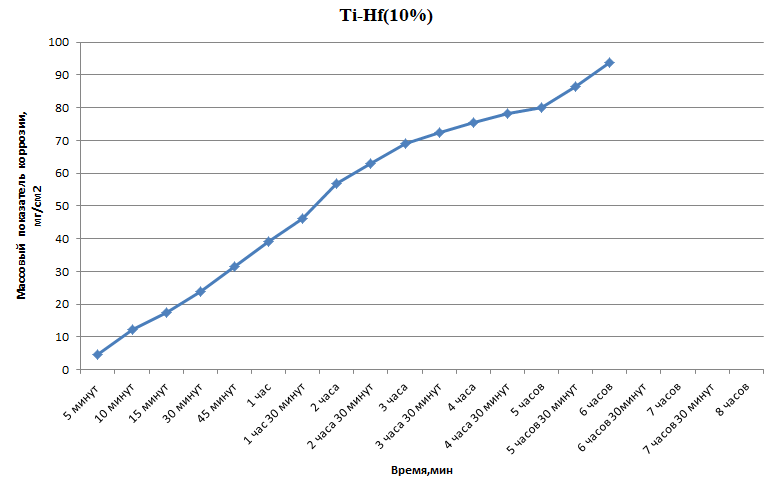 Сплав Ti-Hf (10%) при t= 1200 °C окисляется с 5 мин до 1 часа по линейному закону, после 1 часа по параболическому закону. 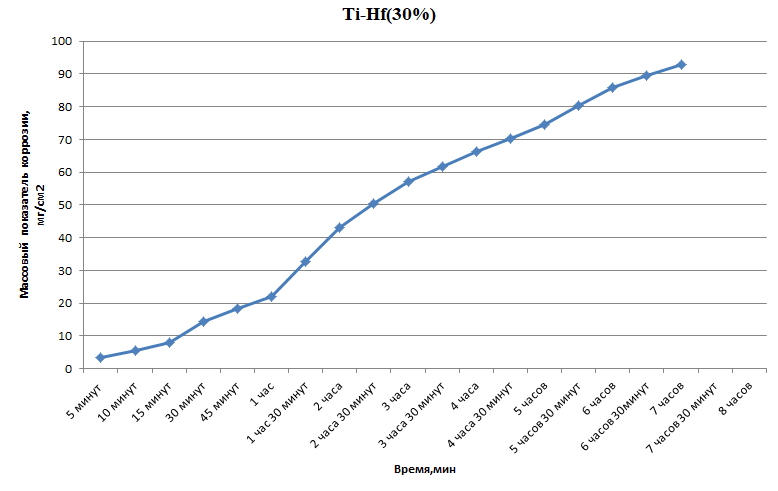 Сплав Ti-Hf (30%) при t= 1200 °C окисляется по параболическому закону. 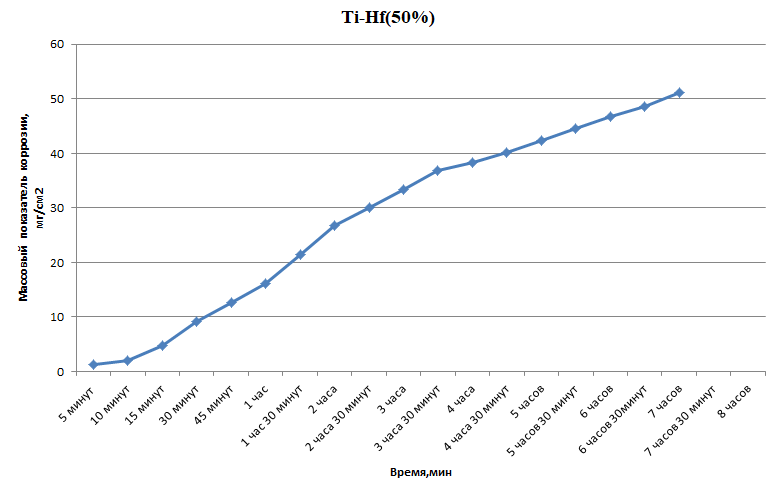 Сплав Ti-Hf (50 %) при t= 1200 °C окисляется от 5 минут до 4 часов 30 минут по параболическому закону, а после 4 часов 30 минут по линейному. 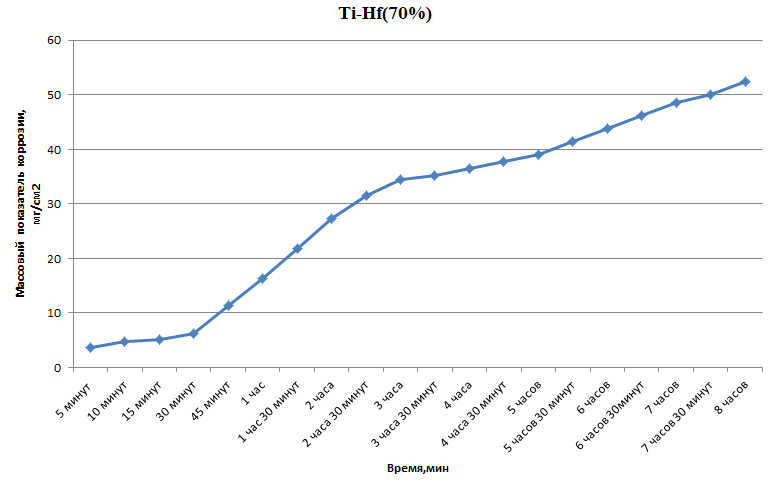 Сплав Ti-Hf (70 %) при t= 1200 °C окисляется по логарифмическому закону. 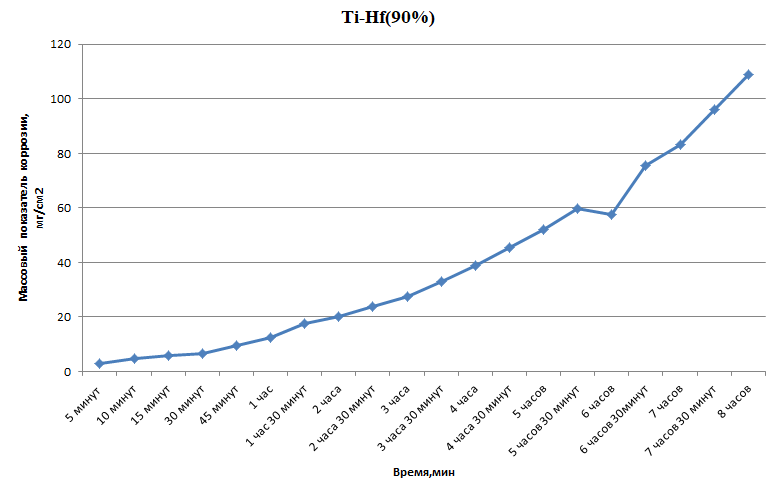 Сплав Ti-Hf (90 %) при t= 1200 °C окисляется по логарифмическому закону. 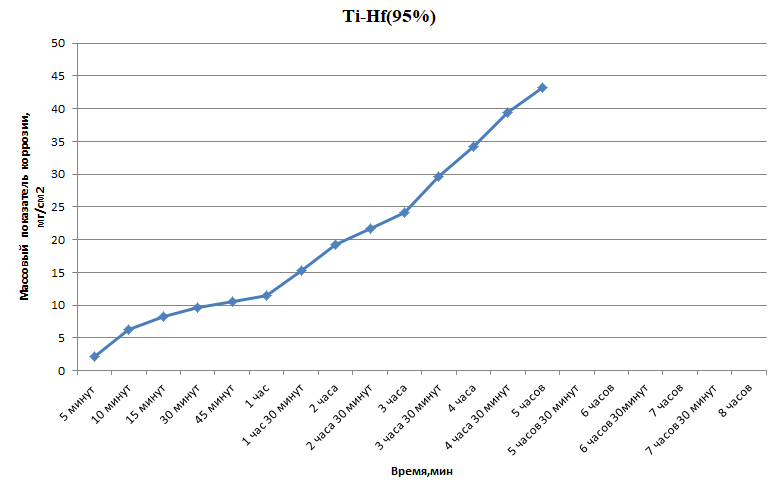 Сплав Ti-Hf (95%) при t= 1200 °C окисляется по линейному закону. 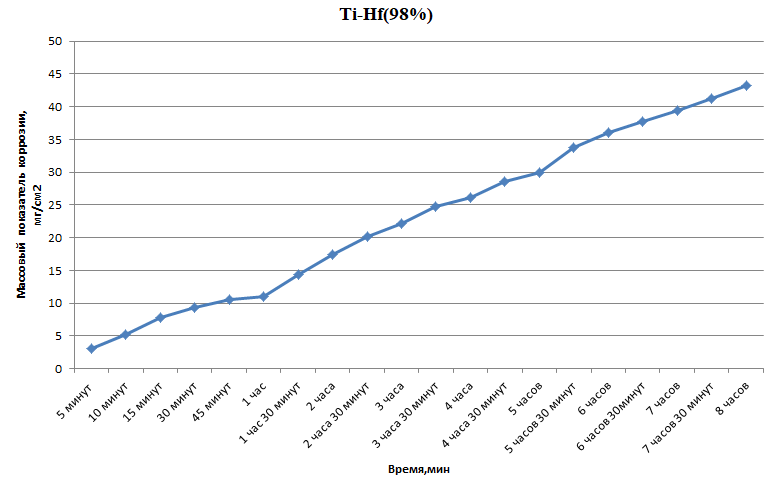 Сплав Ti-Hf (98%) при t= 1200 °C окисляется по линейному закону. Вывод: В сплавах титана – гафния с 5 мин до 4 часов 30 минут преобладает параболический закон, с после 4 часов 30 минут по линейному окисления. Повышение состава влияет по-разному на закон окисления. Определение рационального состава сплава при эксплуатации при температуре 1000 в течение 7 часов. 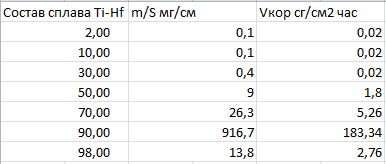 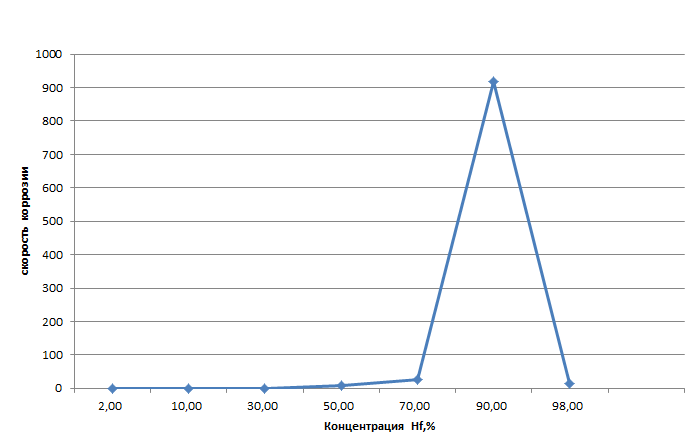 Вывод: при эксплуатации при температуре 1000 в течение 7 часов целесообразно использовать сплав состава 10% Ti 90% Fe, т. к. именно он окисляется с наименьшей скоростью. |
