Урок № 1 Строение молекулы бензола. Внимание! Данная разработка носит рекомендательный характер общего плана. Учитель может вносить любые изменения и корректировки, как в теоретическую, так и в практическую часть плана.
 Скачать 325.74 Kb. Скачать 325.74 Kb.
|
|
Разработчик Сопилиди А.Ф., учитель химии КГУ ОШ № 52 г. Алматы при поддержке ГЦМЦНТО Управления Образования города Алматы Внимание! Данная разработка носит рекомендательный характер общего плана. Учитель может вносить любые изменения и корректировки, как в теоретическую, так и в практическую часть плана. Это зависит от уровня и степени подготовки класса, технических возможностей и методической копилки самого учителя. План самостоятельной работы учащегося 11 класса по химии (опорный конспект) I четверть. Раздел долгосрочного плана: 11.1 А «Соединения ароматического ряда» (8ч). Номер урока:___1___ Тема урока: Строение молекулы бензола. (1ч.) Лабораторный опыт №1 «Составление модели молекулы бензола» Цель урока: 11.4.2.12 объяснять структуру молекулы бензола. На этом уроке ты сможешь: 1) углубить знания об углеводородах; 2) познакомиться с новым типом химической связи, характерным для данной группы соединений, на примере строения молекулы бензола; 3) узнать понятие - ароматичности; Ресурсы: 1)Учебник -Химия 11 класс ( Алматы «Мектеп» 2020г.) 2) Образовательный сайт Bilimland.kz. 3) Презентация 4) Видео. 1. Краткий конспект: Сегодня на уроке мы познакомимся с новой группой углеводородов, которые называются ароматические или Арены. Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. Позднее оказалось, что большинство веществ, которые по химическим свойствам принадлежат к той же группе, не имеют ароматного запаха. Однако исторически сложившееся общее название этих соединений осталось за ними до наших дней. Общая формула гомологического ряда Аренов- CnH2n-6. Простейший представитель ароматических углеводородов бензол. Плотность по водороду паров бензола равна 39. Легко установить его молекулярную формулу- С6Н6. Предыдущие классы углеводородов изучались на основе причинно – следственных связей: состав – строение – свойства – применение. Этот же логический принцип мы оставим и сейчас. Бензол – это тоже углеводород, но углеводород, принципиально отличающийся от тех, о которых шла речь. Что же такое бензол? Как видно из формулы, по составу это соединение непредельное, до полного насыщения всех связей атомов углерода не хватает 8 атомов водорода. В 1911 г бензол был получен из циклогексана (реакция Зелинского), что явилось доводом в пользу гипотезы о циклическом строении бензола. Позже была осуществлена обратная реакция - гидрирование бензола (реакция Сабатье). В 1865 г немецкий химик А.Кекуле предложил структурную формулу бензола: 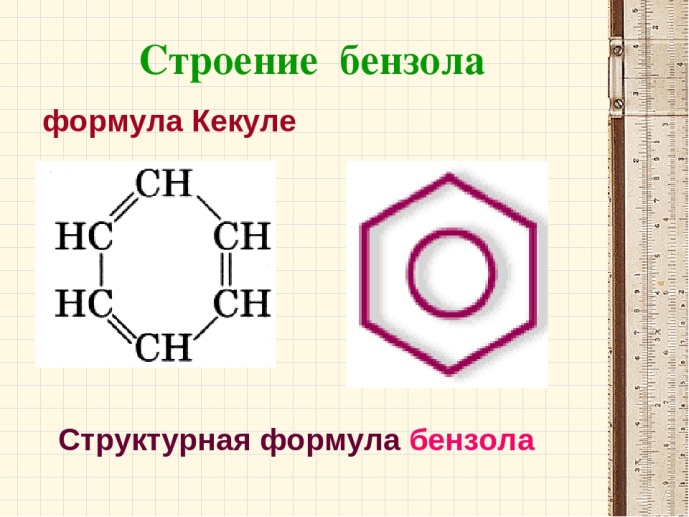 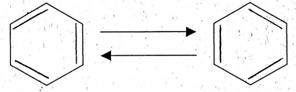 (рис.1) (рис.1)Кекуле предположил, что двойные связи не закреплены в бензоле, а все время перемещаются. Споры вокруг теории строения бензола прекратились всего несколько десятилетий назад. Каковы же современные представления об электронном строении бензола ? Немецкий химик Э.Хюккель применил к ароматическим соединениям квантово-механическую теорию. Согласно современным представлениям у бензола циклическая форма молекулы, имеет строение плоского шестиугольника с равными сторонами. Атомы углерода в бензоле находятся в состоянии sp2 -гибридизации. При этом гибридные орбитали образуют обычные 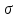 - связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных - связи, а негибридная - перекрывается с двумя другими негибридными орбиталями соседних углеродных атомов. В результате образуется единое облако делокализованных 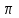 - электронов. В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. - электронов. В результате такого равномерного перекрывания 2р - орбиталей всех шести углеродных атомов происходит "выравнивание" простых и двойных связей, то есть в молекуле бензола отсутствуют классические двойные и одинарные связи. 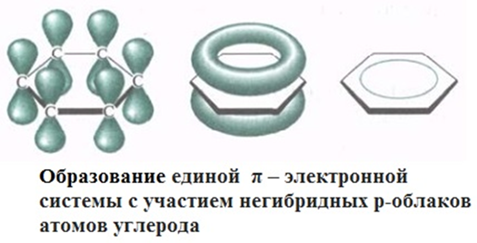 В молекуле бензола существуют кратные связи. Чтобы показать равномерность распределения π-электронной системы в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри. Фактически, эта структура молекулы бензола несет в себе черты строения и первой и второй структуры (рис.1) и представляет качественно новую систему. Но и сейчас нередко еще пользуются формулой Кекуле, учитывая при этом, что она лишь условно передает строение молекулы. СОПРЯЖЕНИЕ — это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной, но несуществующей структурой. Этот факт принято отражать следующей фоpмулой: С 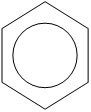 очетание шести сигма-связей с единой π-системой называется ароматической связью. (Понятие "ароматичности" не связано с запахом углеводородов, хотя многие из них обладают им. Под "ароматичностью" понимают некоторые особенности строения углеводородов, главной из которых является равномерное распределение очетание шести сигма-связей с единой π-системой называется ароматической связью. (Понятие "ароматичности" не связано с запахом углеводородов, хотя многие из них обладают им. Под "ароматичностью" понимают некоторые особенности строения углеводородов, главной из которых является равномерное распределение 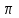 - электронной плотности в молекуле.) - электронной плотности в молекуле.) Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром. Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил. Что необходимо запомнить о строении молекулы бензола: !!! Цикл из шести атомов углерода, связанных ароматической связью, или бензольным ядром. 1) Атомы углерода находятся в состоянии sр2-гибридизации. 2) Между атомами углерода и углерода и водорода образуются сигма-связи, лежащие в одной плоскости (см. рисунок) 3) Валентный угол – 120º 4) Длина связи С-С 0,140нм 5) За счет негибридных р-электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма-связей образуется единая π-электронная система, состоящая из 6р-электронов и общая для всех атомов углерода (см. рисунок). Исходя из этого, вытекает современная структурная формула бензола. Лабораторный опыт №1 «Составление модели молекулы бензола» стр.17 (для построения модели в домашних условиях можно воспользоваться пластилином или другими подручными материалами) 2. Задание для учащихся : (устно) Какие углеводороды называют ароматическими? Какой вид гибридизации характерен для ароматического ядра ? Что собой представляет бензольное ядро? Как образуется единая П – связь? Назовите углы между направлениями связей в ароматическом ядре ? Назовите расстояние между атомами углерода? Какие связи называются ароматическими (полуторными)? 3.1. Задания для учащихся: (письменно) Тест. Общая формула ароматических углеводородов: 1) CnH2n-2 ; 2) CnH2n-6; 3) CnH2n; 4) CnH2n+2. 2.Бензолу не свойственно: 1) жидкое агрегатное состояние; 2) характерный запах; 3) температура кипения 80,1ºС; 4) хорошая растворимость в воде. 3. Расстояние между атомами углерода в бензоле сокращается за счет: 1) циклического строения молекулы; 2) расположения гибридных орбиталей в одной плоскости; 3) влияние π-электронного облака; 4) равномерного распределения электронной плотности. 4. Вещества с общей формулой CnH2n-6 относятся к классу: 1) алканов; 2) алкенов; 3) алкинов; 4) аренов. 5. В молекуле бензола шесть атомов углерода образуют: 1) правильный шестиугольник 2) неправильный шестиугольник; 3) треугольник с боковыми ответвлениями; 4) квадрат с боковыми ответвлениями. 6. Состояние гибридизации атомов углерода в молекуле бензола:1) sp; 2) sp2; 3) sp3; 4) sp и sp2. 3.2 - § 1 № 2, 4 на стр.8 задача № 1 (по учебнику) 4. Ссылки: 1. учебник - § 1 стр. 5-8 2. Интернет-ресурсы: веб – учебник : Дерябина «Органическая химия для средней школы». http://orgchem.ru/chem2/index2.html.Часть 2, Раздел 7 «Арены». Подраздел 7.1 3. Интернет-ресурсы; https://www.youtube.com/channel/UCXC-idU18buI-_kCBLU16-g/playlists?view=50&sort=dd&shelf_id=15 Посмотреть раздел - Химия-11класс с русским языком обучения, 1 четверть, Химия -11класс, ЕМН, Урок № 1 5.Обратная связь – ……….. |
