охт шпоры. Вопрос 1. Предмет и содержание охт. Задачи химической технологии как науки. Основные понятия предмета охт Технология
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
17. Управление простыми обратимыми реакциями. Получение серной кислоты. Окисление SO2 в SO3.    18 Закономерности управления сложными обратимыми реакциями. Управлять ХТП – это означает, меняя технологические параметры процесса (температуру, давление, состав сырья, катализатор, скорость перемешивания, конструкцию реактора, схему соединению реакторов и т.д.) добиваться максимальной эффективности процесса. Для этого нужно знать функциональную зависимость выбранного критерия эффективности от величины технологических параметров. Изучением этих зависимостей и занимается наука ОХТ. При изучении общих закономерностей мы используем метод декомпозиции, то есть рассмотрим особенности функционирования отдельных подсистем ХТС. Главной подсистемой ХТС является подсистема химического превращения. В подсистеме химического превращения происходит превращение исходных реагентов в продукты в специальных аппаратах, которые называют реакторами. При этом протекают следующие процессы: 1) химические - разрушение связей и образование новых; 2) массообменные (диффузионные) – движение молекул внутри фаз и через границу раздела фаз; 3) гидродинамические – перемещение потоков внутри реактора; 4) тепловые – теплообмен между отдельными частями реакционной смеси или между реакционной смесью и окружающей средой. Три последние группы процессов являются физическими, они сопровождают химический процесс, оказывая в той или иной степени влияние на эффективность протекания всего ХТП в целом. Упрощая задачу, рассмотрим сначала только химические процессы, то есть непосредственно химические реакции, лежащие в основе ХТП, и найдем закономерности управления ими. В основе ХТП могут лежать разные реакции. Используем метод моделирования и сведем все многообразие химических реакций к нескольким достаточно простым моделям и для каждой модели определим критерий эффективности протекания этой реакции и зависимость этого критерия от технологических параметров. Селективность. селективность – это качество защитной системы отличать неисправности электрических сетей или установок, выявлять их и отключать от работающих в нормальном режиме. Современные системы электрической защиты могут иметь селективность: Абсолютную. Относительную. В первом случае защита действует только в своей зоне. Во втором случае не только в собственной зоне, но и в соседней. При этом относительная селективность обеспечивается дополнительными приборами с разными функциями. К примеру, с определенной выдержкой времени, при котором он будет срабатывать. Пиролиз нефтяного и газового сырья. Пиролизом называется наиболее жесткая форма термического крекинга нефтяного и газового сырья, осуществляемая при температурах от 670 до 1200° С с целью получения углеводородного газа с высоким содержанием непредельных. Режим пиролиза может быть направлен на максимум выхода этилена, пропилена, бутадиена и ацетилена. Наряду с газом пиролиза образуется некоторое количество жидкого продукта — смолы, содержащей значительные количества ароматических углеводородов: моноциклических (бензола, толуола, ксилолов) и поли циклических (нафталина, антрацена и др.). Долгое время, пока не был разработан процесс каталитического риформинга, пиролиз являлся практически единственным промышленным методом получения ароматических углеводородов из нефти. В настоящее время, как было упомянуто выше, целевым продуктом пиролиза является газ, богатый непредельными, из которых основная роль принадлежит этилену. Сырье для пиролиза весьма разнообразно. Пиролизу подвергают газообразные углеводороды — этан, пропан, бутан и их смеси; низкооктановые бензины; керосино-газойлевые фракции; нефтяные остатки. Выбор сырья определяется в первую очередь целевым продуктом пиролиза. Так, для производства этиленсодержащего газа пригоден любой из перечисленных выше видов сырья. Для получения газа с высокой концентрацией пропилена пиролиз этана непригоден, так как этан почти нацело дегидрируется с образованием этилена и водорода. При пиролизе газообразного сырья (этана, пропана и др.) получаются более высокие выходы этилена, чем при пиролизе жидкого, ко переработка его связана с более высоким температурным режимом. В качестве газообразного сырья пиролиза могут служить природные и попутные газы, особенно последние, так как большая часть природных газов состоит в основном из метана; общее содержание этана и более тяжелых компонентов в них не превышает 5—6 объемн. %. Повышение требований к моторным качествам бензинов дало возможность использовать как сырье пиролиза газовый бензин и низкооктановые бензины прямой перегонки. Керосино-газойлевые фракции прямой перегонки применяются как дизельное топливо, и в настоящее время они достаточно дефицитны. Можно подвергать пиролизу низкокачественные газойли вторичного происхождения (термического крекинга, коксования). Практикуется применение в качестве сырья пиролиза нефтяных остатков, но широкое использование их для этой цели ограничено большими коксоотложениями, которые свойственны глубокому превращению смолистых веществ нефти. Пиролизу присущи реакции глубокого преобразования исходного сырья, приводящие к возникновению легких газообразных углеводородов, ароматических моно- и полициклических углеводородов, а также продуктов глубокого уплотнения — кокса и сажи . Реактор Реактор — устройство, действующее на основе различных типов реакций (физических, химических, биологических и т. п.) Виды реакторов: Биореактор — прибор, осуществляющий перемешивание культуральной среды в процессе микробиологического синтеза. Дугогасящий реактор — электрический аппарат с изменяемой индуктивностью, служащий для уменьшения токов однофазных замыканий на землю в электрических сетях с изолированной нейтралью. Сингулярный реактор — гипотетическое устройство, теоретически позволяющее осуществлять и забирать энергию чёрной дыры в процессе её излучения и/или взрыва Сглаживающий реактор — электрический аппарат для уменьшения пульсации выпрямленного тока. Термоядерный реактор — устройство, в котором осуществляется управляемая цепная термоядерная реакция, сопровождающаяся выделением энергии. Токоограничивающий реактор — электрический аппарат, предназначенный для ограничения ударного тока короткого замыкания. Химический реактор — устройство, в котором осуществляется химическая реакция. Ядерный реактор — устройство, в котором осуществляется управляемая цепная ядерная реакция, сопровождающаяся выделением энергии. 19 Управление реакциями с неблагоприятным положением равновесия Положение равновесия всегда зависит от внешних условий, а так как внешние условия не могут сохраняться неизменными, то равновесие рано или поздно нарушается (смещается). Влияние изменения внешних условий на положение равновесия - принцип смещения равновесия, или принцип Ле – Шателье: если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то система отреагирует на это воздействие так чтобы уменьшить его. Влияние давления. Характер влияния давления на равновесие химических реакций определяется знаком разности числа молей газообразных участников реакции Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т. е. Влияние инертного газа. Введение инертного газа в систему при р =const подобно эффекту уменьшения общего давления. Если реакция протекает с уменьшением числа молей Влияние концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо вещества вызывает смещение равновесия в том направлении, при котором концентрация этого вещества уменьшается. Поэтому введение избытка исходных веществ смещает равновесие вправо; введение избытка продукта вызовет смещение равновесия влево. Увеличивая концентрацию одного из реагентов (создавая его избыток), можно повысить степень превращения другого. Этим широко пользуются в химической технологии, добиваясь полного превращения дорогостоящего компонента сырья. Во многих случаях смещение равновесия процесса вправо можно осуществить и выводом продуктов из реакционной зоны — уменьшением концентрации продукта. Влияние температуры. Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции. Повышение температуры всегда благоприятствует накоплению веществ, образующихся в данной реакции с поглощением теплоты, т. е усиливает эндотермическое направление процесса. Понижение температуры действует в противоположную сторону, т. е. усиливает экзотермическое направление. Следует отметить, что при изменении температуры равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция. Итак, применяя принцип Ле Шателье, можно, не производя термодинамических расчетов, предсказать направление химических реакций, т. е. качественно судить о состоянии их равновесия. Синтез аммиака Осознание содержания этого пункта позволяет: объяснять химико-технологическую схему синтеза аммиака, строение и работу колонны синтеза; составлять уравнения синтеза аммиака; характеризовать технологическую схему производства; обосновывать оптимальные условия синтеза; описывать становление производства синтетического аммиака в Украине. При каких условиях осуществляется этот синтез, можно узнать по уравнению реакции. 0днак для производства этого мало, потому что основной задачей является не просто добыча аммиака, а добыча наиболее экономичным способом. Для этого необходимо выяснить оптимальные условия синтеза, то есть как достичь наибольшего выхода аммиака, а процесс — ускорить. Обратимся к уравнению реакции. Что из него видно? 1. Эта реакция является обратимой, следовательно, до конца не происходит, в процессе реакции устанавливается химическое равновесие. 2. Реакция происходит между газами с уменьшением объема. 3. Реакция экзотермическая, ее течение сопровождается выделением теплоты. Как именно управлять такой реакцией, помня, что производство аммиака должно быть экономически выгодным? Вспомним теорию, а именно — принцип Ле Шателье: если система находится в состоянии равновесия, то в процессе действия на нее сил, вызывающих смещение равновесия, система переходит в такое состояние, в котором эффект этого воздействия ослабляется. Поэтому рассуждаем: если реакция экзотермическая, то нужно снизить температуру, чтобы аммиак не разлагался. Oно с понижением температуры скорость реакции замедляется, поэтому целесообразно использовать катализатор. Однако известно, что катализатор начинает активно действовать только при нагревании до определенной температуры. Oтак, понятно снижать температуру можно, но до определенного предела. Далее обращаем внимание на то, что реакция между газами происходит с уменьшением объема. Это означает, что равновесие будет смещаться в сторону образования аммиака при условии повышенного давления. Однако даже за очень высокого давления связать весь азот и водород невозможно, а применение высоких давлений скажется на стоимости оборудования и затратах энергии при сжатии газовой смеси. Исходя из условий процесса, делаем вывод, что для синтеза аммиака необходимо: а) применить небольшое давление (30 МПа), что позволяет сместить равновесие в сторону образования аммиака; б) использовать катализатор (губчатое железо с примесями Al2O3 и К2Щ); в) повысить температуру (до 450 — 550 °С). Такие условия являются оптимальными для экономически выгодного синтеза аммиака. Реакция происходит в колонне синтеза (рис. 135). Она состоит из теплообменника (нижняя часть) и катализаторнои коробки (верхняя часть), диаметр которой несколько меньше, чем внутренний диаметр корпуса колонны. 0тже, между каталізаторною коробкой и корпусом образуется щель. Холодная смесь азота с водородом поступает в колонну сквозь эту щель и предотвращает перегрев корпуса. Газовая смесь идет вниз, проходит между горячими трубками теплообменника, нагревается и попадает в коробки катализатора. Именно здесь, на катализаторе, происходит синтез аммиака. При этом выделяется много теплоты. Горячая смесь аммиака, азота и водорода поступает в трубки теплообменника, нагревая их. Происходит теплообмен, теплота реакции утилизируется — это один из важных принципов современного производства. Газ, выходящий из колонны синтеза, содержащую 12-15 % аммиака. Тогда непонятно, почему синтез считается экономически выгодным. Дело в том, что в дальнейшем в процессе производства используют принцип циркуляции, по которым азот и водород, что не прореагировали, отделяются от сжиженного аммиака и снова возвращаются в колонну синтеза. Благодаря принципу циркуляции на современных заводах выход аммиака составляет 96 — 98 %. Коротко о главном Сырьем для синтеза аммиака являются азот и водород, их взаимодействие происходит в колонне синтеза. Оптимальные условия синтеза — давление 30 МПа, наличие катализатора, температура 450 — 550 °С. Среди основных научных принципов, на которых основывается промышленный синтез аммиака, — непрерывность процесса, циркуляция, теплообмен и прочее. 20. Химико-технологическая система (ХТС). Модели ХТС Основные элементы ХТС. Системой называют упорядоченную совокупность материальных объектов, соединенных каких-либо связями, предназначенных для достижения определенной цели наилучшим образом. ХТС – совокупность взаимосвязанных процессов и аппаратов (операторов), функционирующих как единое целое с целью превращения сырья в качественный продукт с минимальными затратами ресурсов и сохранением качества окружающей среды. (ХТС) многоассортиментного производства – это упорядоченная последовательность технологических процессов производства одного или нескольких целевых или промежуточных продуктов и множество технологических аппаратов с системой материальных и энергетических связей между ними, необходимое и достаточное для производства этого продукта. Классификация моделей хтс:  В зависимости от способа описания ХТС модели разделяют на три вида: - описательные; - графические; - математические. Обобщенные: 1.Операц.-описат. модели – словесное описание процесса функционирования системы, где иллюстрируются основные химические реакции, даётся описание процессов, происходящих в аппаратах системы, приводятся сведения о составе сырья. .Иконографич. модели– графич. изображ-е, чертеж. Функциональная (принципиальная) схема - дает общее представление о функционировании ХТС (аппаратурное оформление и детальная разработка ХТС) 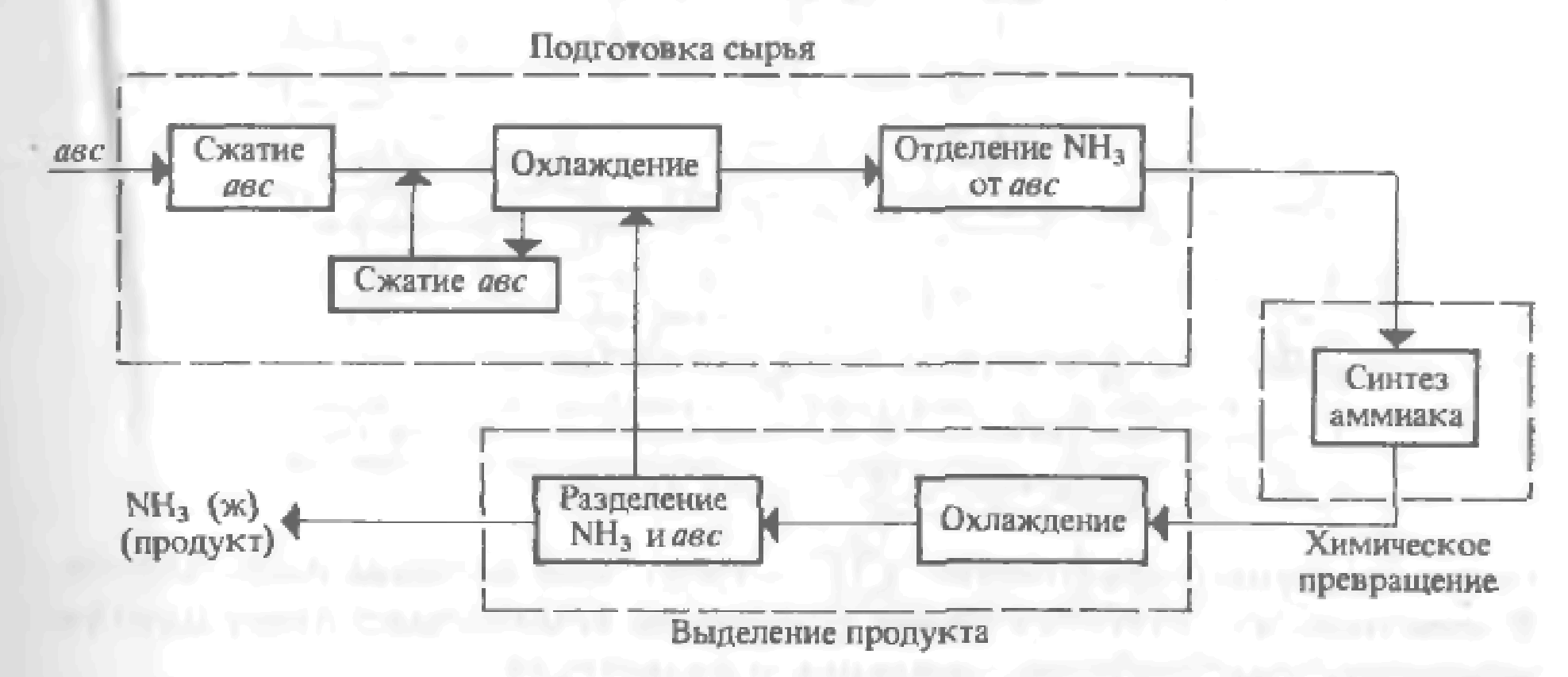 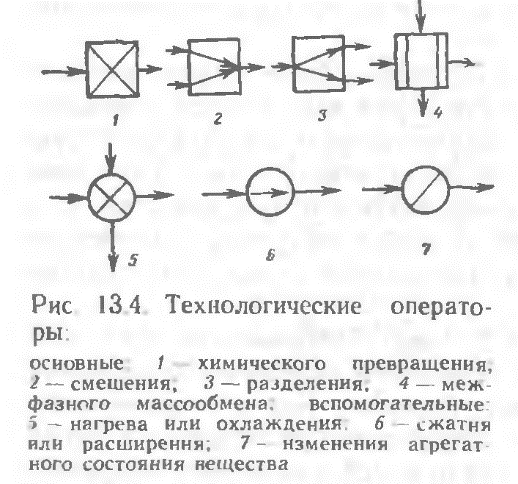 Технологическая схема показывает элементы системы, порядок их соединения и последовательность технологических операций. кратко могут быть приведены данные о параметрах процесса. Технологическая схема показывает элементы системы, порядок их соединения и последовательность технологических операций. кратко могут быть приведены данные о параметрах процесса.Операторная схема даёт наглядное представление о физико-химической сущности технологических процессов системы. Структурная схема ХТС дает изображение всех элементов в виде блоков с указанием и обозначением всех входных и выходных потоков и технологических связей между блоками (элементами ХТС). Структурные схемы используются для анализа и последующего расчета материальных и энергетических балансов ХТС. М 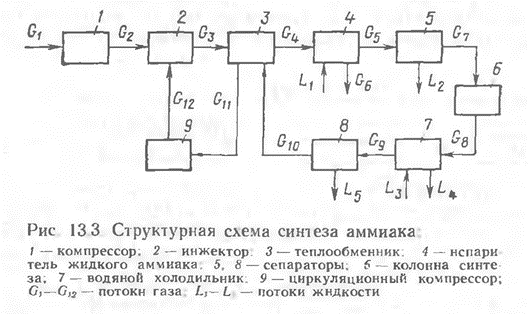 атематические: 1.Символ.-ая модель – совокуп-ть матем. формул, уравнений, нерав-в, позволяющих определить физические параметры состояния технологических потоков на выходе системы в зависимости от факторов, воздействующих на систему: параметров входных технологических потоков (Х), параметров окружающей среды (V), технологических (D), и конструкционных (К) параметров элементов системы атематические: 1.Символ.-ая модель – совокуп-ть матем. формул, уравнений, нерав-в, позволяющих определить физические параметры состояния технологических потоков на выходе системы в зависимости от факторов, воздействующих на систему: параметров входных технологических потоков (Х), параметров окружающей среды (V), технологических (D), и конструкционных (К) параметров элементов системы2. Иконографические математические модели – наглядное графическое отображение свойств технологической структуры ХТС, по которым можно определить количественные характеристики системы. Топологические модели представляют в виде графов. Граф – этофигура или конфигурация, образованная совокупностью некоторых точек (вершин или узлов), соединенных отрезками прямых, ломаных или кривых линий. Линии могут иметь направление (тогда они называются дугами) или не иметь его (рёбра). |
