охт шпоры. Вопрос 1. Предмет и содержание охт. Задачи химической технологии как науки. Основные понятия предмета охт Технология
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
8. Области протекания гетерогенных процессов, влияние технологических параметров в каждой из областей. Переход из одной области в другую. О 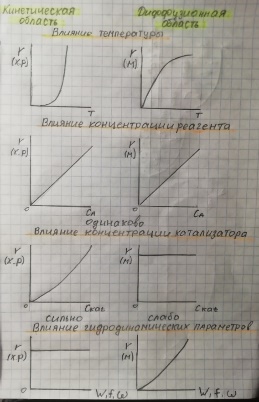 бласти протекания гетерогенного процесса: см. вопрос 5 бласти протекания гетерогенного процесса: см. вопрос 5Переход из одной области в другую: 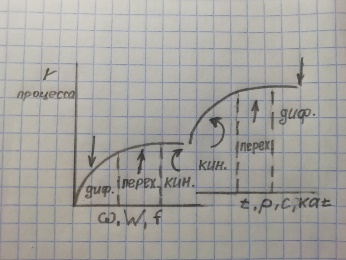 Если изобразить на графике зависимость скорости процесса от гидродинамических факторов, то та область, где скорость сильно возрастает при увеличении ω, W, f, является диффузионной. При дальнейшем увеличении этих величин зависимость становится менее выраженной – это переходная область. В кинетической области гидродинамические факторы перестают оказывать влияние на скорость процесса. Увеличение скорости в этой области требует использования кинетических факторов управления процессом (t, p, C, kat). Однако и здесь постепенно степень влияния выбранных инструментов управления снижается, процесс переходит опять в диффузионную область. Влияние технологических параметров: (рисунок справа) 9 Катализ в химической технологии. Типы промышленных катализаторов. Требования, предъявляемые к промышленным катализаторам. Катализ – процесс изменения скорости химической реакции под воздействием малых кол-в в-в, катализаторов, которые участвуют в процессе и восстанавливают свою структуру в конце каталитического цикла. A+kat=Akat* Akat*+B= ABkat* ABkat*=C+D+kat Катализ бывает положительный (ускорение реакции катализатором) и отрицательный (замедление реакции ингибитором) Катализатор снижает энергию активации Катализатор не смещает равновесие Катализатор целесообразно использовать если энергия гиббса равна 0-40 кДж/моль, больше 40 – нет смысла. Классификация катализаторов По механизму действия: Ионные (кислотно-основный механизм) -протонные и апротонные -природные и синтетические алюмосиликаты -нейтральные и кислые соли -оксиды металлов (al2o3,w2o3…) *Учавствуют в процессах гидротации,алкилирования, изомеризации и др Электронные -металлы -оксиды металлов(MgO,ZnO,Fe2O3…) *Участвуют в процессах гидрирования, дегидрирования, синтезе серной кислоты и аммиака, оксида этилена Бифункциональныее - Pt на Al2O3 -cмесь znO? Al2O3 b MgO И др По составу -смешанные -модифицированные( с добавками) -на инертных носителях По методу приготовления -природные( силикаты, аллюминаты) -контактные массы(механически смешанные компоненты) -осажденные (осаждение катализатора в виде геля из водного раствора с последующей сушкой и прокаливанием) -катализаторы на носителях( пропитка носителя катализатором) -плавленные(сетки, спирали) -скелетные (изготавливаются путем выщелачивания сплавов) http://www.xumuk.ru/bse/1232.html типы промышленных не нашла другое Требования к промышленным катализаторам: Высокая каталитическая активность Высокая селективность Простота получения и хорошая воспроизводимость свойств Высокая механическая прочность Термическая стабильность Большой срок службы и легкая регенерация Гетерогенный процесс включает следующие стадии( по стрелкам, 7 шт) 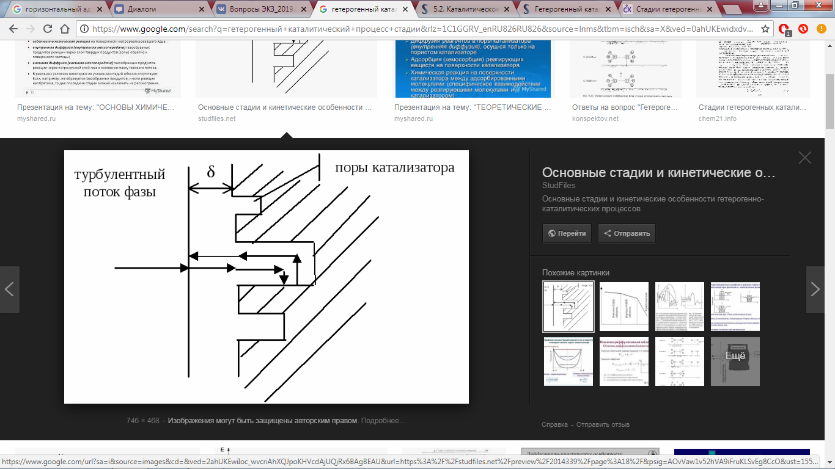 1 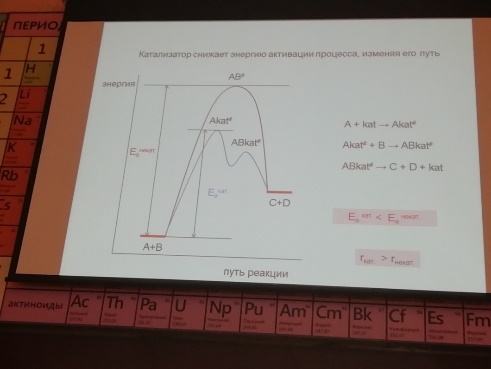 0. Катализатор. Механизм ускоряющего действия катализатора. Классификация катализаторов. Физические и химические свойства катализаторов. 0. Катализатор. Механизм ускоряющего действия катализатора. Классификация катализаторов. Физические и химические свойства катализаторов.Катализ – процесс изменения скорости реакции под воздействием малых количеств веществ катализаторов, которые, участвуя в процессе, восстанавливают свой состав в конце каталитического цикла Катализ бывает положительным (катализатор) и отрицательным (ингибитор). Катализатор увеличивает скорость реакции, а ингибитор уменьшает ее. Катализатор снижает энергию активации процесса, изменяя его путь. Он не может смещать положение равновесия в обратимых процессах, т. к. в равной степени ускоряет как прямую, так и обратную реакции. -Классификация катализаторов: 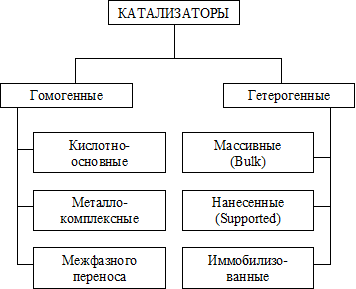 Гомогенными называются катализаторы, находящиеся в одной фазе с реагентами. (жидкая среда+растворимый kat) Гетерогенными называются катализаторы, образующие отдельную фазу, не смешивающуюся с реагентами и продуктами. Как правило, это твердые катализаторы. (жидкая/газовая смесь+твердый катализатор) Массивный катализатор целиком состоит из активного компонента, а активные центры представляют собой доступные для реагентов атомы или группы атомов на поверхности катализатора. Нанесенные катализаторы состоят из носителя и нанесенного на его поверхность тем или иным физическим методом активного компонента. При этом носитель может быть как инертным в данном процессе, так и оказывать определенное каталитическое либо промотирующее действие. Иммобилизованные катализаторы это катализаторы, в которых активный компонент химически закреплен на поверхности твердого материала (носителя). -Физические свойства: пористость, фракционный состав, насыпная и истинная плотности, механическая прочность. удельная поверхность, распределение пор по радиусам, объем пор, теплоемкость и теплопаростойкость. -Химические свойства: каталитическая активность(скорость превращенного реагента, отнесенная к единице объема поверхности или массы катализатора), селективность(способность ускорять только целевую реакцию), производительность катализатора (количество целевого продукта, произведенного в ед-цу времени с ед-цы поверхности(объема) катализатора). 11. Преимущества и недостатки гомогенного и гетерогенного катализа.
Гомогенные катализаторы отличаются значительно большей степенью дисперсности. Каждая молекула гомогенного катализатора является каталитическим центром, в то время как в гетерогенном катализаторе активны только доступные для реагентов центры на поверхности. Следовательно, гомогенный катализатор обладает гораздо большей активностью на единицу массы катализатора. Это позволяет использовать его в гораздо меньших концентрациях, чем гетерогенный. Гомогенно-каталитические реакции протекают чаще всего под кинетическим контролем, так как скорость диффузии реагентов к каталитическому центру значительно выше скорости собственно химической реакции. Так как гомогенные катализаторы – это легко идентифицируемые химические соединения, то механизмы гомогенно-каталитических реакций изучены, как правило, хорошо. Для гетерогенных же каталитических процессов представление о механизме реакций часто достаточно туманны и противоречивы. Основным недостатком гомогенного катализа является сложность отделения катализатора от продуктов реакции и его рециркуляция. Наоборот, для гетерогенного катализа сепарация (выделение) либо не требуется вообще (в случае стационарного слоя катализатора), либо осуществляется такими простыми способами как фильтрация или центрифугирование. Для выделения гомогенных катализаторов требуются значительно более сложные (энергоемкие) процессы, такие как экстракция, ректификация или ионный обмен. Идеальным выглядело бы создание катализаторов, обладающих положительными свойствами как гомогенных (высокая удельная активность и селективность), так и гетерогенных (простота сепарации) катализаторов. В настоящее время очевидно стремление перехода от гомогенно- к гетерогенно-каталитическим процессам. В современной химической промышленности доля гомогенно-каталитических процессов составляет 10-15%. За свою историю промышленный катализ прошел огромную эволюцию благодаря развитию инструментальных методов исследования катализаторов и механизмов каталитических реакций. Целью этих исследований является создание общей теории катализа - теории, которая бы позволяла предсказывать и создавать катализаторы для всех типов катализа – гомогенного, гетерогенного и ферментативного. Однако до сих пор этого сделать не удалось. 13 Требования, предъявляемые к катализаторам. Причины дезактивации и способы ее устранения. Типы промышленных катализаторов (модифицированные, смешанные, на носителях) Требования: 1) Каталитическая активность - скорость превращения реагента 2) Селективность- способность катализатора ускорять только целевую реакцию 3) Производительность - количество целевого продукта, произведенного в единицу времени с единицы поверхности. Причины дезактивации катализатора: 1. Старение-перестройка внутренней структуры катализатора, потеря его физических и механических свойств. Характеристика (Необратимость, естественность, равномерность). Нет способов борьбы. 2. Утомление – потеря активности вследствие неправильной эксплуатации, неестественный, неравномерный процесс 3. Спекание-перегрев катализатора, необратимы процесс. Способы борьбы- соблюдение температурного режима, организация правильного теплоотвода, введение структурообразующих добавок при приготовлении катализатора. 4. Зауглероживание - отложение на поверхности катализатора высоконденсированных ароматических структур (кокса). Обратимый процесс. Способы борьбы- очистка сырья, введение в состав катализатора специальных добавок препятствующих отложению. 5. Минерализация - отложение на поверхности катализатора минеральных веществ. Обратимый процесс. Способы борьбы: окислительная регенирация, окисление катализатора в токе воздуха. 6. Отравление - блокировка активных центров на поверхности катализатора небольшими количествами веществ. Каталитическими контактными ядами. Отравление может быть обратимым и необратимым. Полным или специфичным, мгновенным или прогрессирующим. Способы борьбы: использование малочувствительынх катализаторов к каталитическим ядам, очистка сырья от каталитических ядов, предкатализ - перевод токсичных примесей вещества в нетоксичные. Типы промышленных катализаторов 1) Модифицированные катализаторы. Модификатор – добавка к катализатору небольшого (до10 – 12 мас. %) количества другого вещества, каталитически не активного для данной реакции, но улучшающего те или иные качества катализатора (термостойкость, прочность, ядоустойчивость). 2) Смешанные катализаторы - катализаторы, содержащие несколько каталитически активных для данной реакции составляющих, взятых в соизмеримых количествах. 3) Катализаторы на носителях. Носитель определяет форму и размер гранул, оптимальную пористую структуру, прочность, термостойкость, снижение стоимости. Иногда увеличивает активность (см. теорию поля лигандов). Классификация носителей: синтетические – силикагель, активированный уголь, оксид алюминия (g, a), керамика; природные – пемза, диатомит; по объему пор – пористые (более 10%), непористые (10 и менее %); 14 Управление простыми необратимыми реакциями. Влияние температуры на скорость и степень превращения в простых обратимых реакциях. Получение соляной кислоты. Реактор синтеза хлороводорода. Инструментами управления простым необратимым гомогенным процессом являются те технологические параметры, которые влияют на скорость химической реакции (температура, давление, концентрация реагента, природа и концентрация катализатора). Скорость химической реакции увеличивается при увеличении концентрации реагентов; скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше; скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ. Скорость химической реакции возрастает при увеличении температуры на 100 в 2 - 4 раза. Это эмпирическое правило называется правилом Вант-Гоффа. Оно справедливо в области средних температур (до 4000С). Скорость реакции зависит от числа столкновений реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). Соляную кислоту получают с помощью химической реакции соединения: H2 + Cl2 = HCl - реакция происходит при повышенной температуре Реакция инициируется светом, влагой, твердыми пористыми веществами (древесный уголь, губчатая платина) и некоторыми минеральными веществами (кварц, глина). Абсолютно сухие хлор и водород не взаимодействуют между собой. Присутствие следов влаги ускоряет реакцию столь интенсивно, что она может произойти со взрывом. В производственных установках осуществляется спокойное, не взрывное горение водорода в токе хлора. Водород подается с избытком в 5-10%, что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту. 16. Понятие о равновесии. Влияние температуры, давления, концентрации на скорость и положение равновесия обратимых реакций. Химическое равновесие. В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реация в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными. Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием. 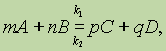 согласно закону действующих масс, скорости прямой реакции 1 и обратной 2 соответственно запишутся следующим образом: согласно закону действующих масс, скорости прямой реакции 1 и обратной 2 соответственно запишутся следующим образом:В момент достижения состояния химического равновесия скорости прямой и обратной реакций равны: где К — константа равновесия, представляющая собой отношение констант скорости прямой и обратной реакций. Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема. Концентрация. Увеличение концентрации одного из реагирующих веществ сначала приводит к увеличению числа молекул этого вещества. Поскольку число столкновений с участием этих молекул увеличивается, реакция, для которой они являются реагентами, ускоряется. Это приводит к увеличению концентраций реагентов у противоположной реакции и т. д. В результате изменяется концентрация всех веществ, участвующих в химической реакции. Можно сделать вывод, что при увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества. Давление. Влияние давления очень напоминает эффект изменения концентраций реагирующих веществ, но сказывается оно практически только на газовых системах. При повышении давления увеличивается число молекул в единице объема газовой системы. Прямая или обратная реакция, в которой участвует большее количество газообразных веществ, протекает при этом с большей скоростью. В результате этой реакции образуется больше молекул тех веществ, которые участвуют в обратной реакции. Произойдет изменение скорости обратной реакции, и в конце концов будет достигнуто новое состояние равновесия. При увеличении давления равновесие смещается в сторону уменьшения числа молекул газообразных веществ, т. е. в сторону понижения давления: при уменьшении давления равновесие смещается в сторону возрастания числа молекул газообразных веществ, т. е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе. Температура. Повышение температуры увеличивает кинетическую энергию всех молекул, участвующих в реакции. Но молекулы, вступающие в реакцию, при которой происходит поглощение энергии (эндотермическая реакция), начинают взаимодействовать между собой быстрее. Это увеличивает концентрацию молекул, участвующих в обратной реакции, и ускоряет ее. В результате достигается новое состояние равновесия с повышенным содержанием продуктов реакции, протекающей с поглощением энергии. При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры — в сторону экзотермической реакции. |
