охт шпоры. Вопрос 1. Предмет и содержание охт. Задачи химической технологии как науки. Основные понятия предмета охт Технология
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Вопрос №1. Предмет и содержание ОХТ. Задачи химической технологии как науки. Основные понятия предмета ОХТ «Технология» с греч. Наука о производстве (мастерстве) Первое упоминание 1772 г. Германия И.Беклан. В России 1807 г. И.А. Двигубский Технология – наука о способах массового производства продукции Технология делится на: 1)Механические- изменение формы размера и физических свойств сырья (механические процессы) 2)Химические - изменение состава и химических свойств сырья (хим. реакции) Частные хим. технологии: органические и неорганические ОХТ – наука, которая изучает теоретические основы разработки технологий для различных классов химических реакций. Предмет изучения ОХТ – производство хим. Продуктов. Задачи ОХТ: 1) отыскание общих законномерностей протекания ХТП, 2) нахождение оптимальных уловий введения ХТП, 3) повышение селективности сложных реакций 4) комплексное использования сырья, 5) экономия сырья, топлива, энергии 6) снижение содержания вредных примесей ХТП- хим. технология процессов. Методы ОХТ: экспериментальный и моделирование Основные определения: 1. Химическое производство – это совокупность процессов и аппаратов, в которых осуществляются процессы превращения сырья в химический продукт. 2. Сырье – исходный материал, поступающий на переработку и обладающий стоимостью. 3. Реагент – это главный компонент сырья, вступающий в реакции, приводящие к образованию целевого продукта. 4. Примеси – компоненты сырья, которые могут вступать в реакции или нет. 5. Целевой продукт – продукт, ради которого организованно производство. Вопрос №2. Методы активации химических реакций (термо-, каталитическая активация, нетрадиционные методы активации). Многие реакции могут протекать при стандартных условиях, но для проведения некоторых реакций нужно дать толчок. Да и протекающую реакцию можно ускорить. Самыми простыми и частыми способами являются повышение температуры и добавление катализаторов. При повышении температуры увеличивается кинетическая энергия молекул, что позволяет достигнуть барьера энергии активации. Добавление катализатора также способствует активации, так как катализатор образует промежуточное соединение, уменьшает путь реакции и энергию активации. К нетрадиционным методам можно отнести фотохимическую, плазмохимическую, радиационную активацию с использованием звуковых, ударных волн и т.п. Источниками энергии для активации при этом являются световые, звуковые (ультразвук), ударные волны, электрическое поле, ионизирующее излучение и т.п. 3. Технологическая классификация химических процессов. Критерии эффективности ХТП(химико-технологич. процесс). Классификация: ХТП делят на простые и сложные ПростойХТП можно описать одним уравнением превращения исходных реагентов, напр., А и В в продукты C и D. аА + вВ = cC + dD где а, в, c и d – стехиометрические коэффициенты. Сложный (последовательные, параллельные, смешанные) ХТП описывают более чем одним уравнением, т.е. ХТП всегда включает основную реакцию, дающую целевые продукты и побочные реакции, приводящие к образованию побочных продуктов. По механизму процессы могут быть необратимые и обратимые. Обратимые процессы в отличие от необратимых протекают одновременно в прямом и обратном направлении. По тепловому эффекту: Экзотермические: -с большим тепловым эффектом -с малым тепловым эффектом 2) Эндотермические: -каталитические -некаталитические Процессы могут быть гомогенные и гетерогенные. В гомогенных реакция протекает во всем объеме реактора, и все участники реакции находятся в одной фазе. В гетерогенных – (2 или более фазы) реакция протекает на границе раздела фаз. По организационной структуре: периодические и непрерывные. По количеству молекул: мономолекулярные, бимолекулярные, тримолекулярные. Пример: N2 + 3H2 = 2 NH3 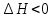 Реакция простая, обратимая, экзотермическая с большим тепловым эффектом, гомогенная, каталитическая. Критерии эффективности ХТП 1)Технологические:-конверсия -селективность-выход исх. продукта-производительность-интенсивность-пропускная способность-мощность 2) Технико-экономические: -расходные коэффициенты-качество продукции 3) Экономические: -себестоимость-прибыль 4) Социальные: -уровень механизации и автоматизации -безопасность в обслуживании -экологическая безопасность 4. Управление скоростью химической реакции. Влияние температуры, давления, концентрации, катализатора на скорость химической реакции. - При увеличении температуры на 10 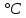 , скорость хим реакции возрастает в 2-4 раза. (правило Вант-Гоффа). , скорость хим реакции возрастает в 2-4 раза. (правило Вант-Гоффа).- Скорость хим реакции зависит от энергии активации Ea, чем Ea больше, тем чувствительней реакция к изменению температуры. Катализатор снижает Ea процесса, изменяя его путь. - Катализатор увеличивает скорость хим реакции. Катализаторы — это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции. - Давление влияет на изменение скорости реакции только в газовой среде. Это происходит потому, что для газообразных реагентов изменение давления приводит к изменению концентрации. Любой газ занимает весь предоставленный объем — молекулы разлетаются, и число их столкновений уменьшается. Если повысить давление, число активных соударений возрастает, соответственно, скорость реакции увеличивается. - Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Для реакции A + B = D по закону действующих масс: cкорость 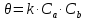 5.Области протекания гетерогенного процесса. Механизм (стадии) гетерогенного процесса. Способы интенсификации в системе "газ-тв". Получение серной кислоты. Обжиг колчедана. Реактор. Гетерогенные процессы сложны и протекают в несколько стадий – диффузия реагента А из потока сырья к внешней поверхности катализатора (внешняя диффузия); – диффузия А в порах катализатора к его внутренней поверхности (внутренняя диффузия); – адсорбция (хемосорбция) реагента А на внутренней поверхности катализатора; – химическая реакция на внутренней поверхности катализатора; – десорбция продукта В с внутренней поверхности в порах катализатора; – диффузия продукта В из пор катализатора к его поверхности; – диффузия продукта В от внешней поверхности катализатора в поток. Области протекания:
Пути интенсификации процесса “Г-Т”. Чем интенсивнее процесс, тем меньше tn. Для уменьшения tn: а) уменьшение Ro, т.е. измельчение твердого материала; б) повышение концентрации реагента в газовой фазе Co. Некоторые меры эффективны только для определенного режима. Так, нужно повышать Kn, но для каждого режима Kn имеет свой смысл (бетта) – для диффузионного и кинетического. Поэтому при диффузионном режиме дает эффект увеличение скорости обтекания частицы газом (бетта возрастает), а при кинетическом – повышении температуры (Kn возрастает). Получение серной кислоты осуществляется из серосодержащего сырья (Н2S, S, серный колчедан) до оксида S+4, далее в SO3 и он поглощается водой. 2SO2(г)+O2𝑉2𝑂5↔2SO3(г) ∆H= -94 КДж/моль (простой, обратимый, катал, газофазный, экзотермический, гетерогенно-катал). Объект управления: r проц и положение равновесия. Обжиг колчедана: Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы: 4FeS2 +11O2 = 2Fe2O3 + 8SO2 (I) S + O2 - SO2 (II) Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), которая помимо очистки от каталитических ядов включает выделение паров воды (осушку), а также получение побочных продуктов (Se и Te).На третьей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы: SO2 + 1/2O2 - SO3 (III) Последняя стадия процесса - абсорбция триоксида серы концентрированной серной кислотой или олеумом Реактор — устройство, действующее на основе различных типов реакций (физических, химических, биологических и т. п.) 6.Методы управления гетерогенным процесcом в диффузионной области. Уравнение Фика. Область протекания процесса: диффузионная Лимитированная стадия: диффузия -коэф. Вант-Гоффа k=1,3-1,7 -энергия активации Ea< 25кДж/моль -порядок реакции =1 гидродинамические факторы: W,f Если процесс протекает в диффузионной области, объектом управления становится скорость массопередачи; и появляются новые инструменты управления, такие как скорость перемешивания, поверхность контакта фаз и др. (гидродинамические факторы). Концентрация реагентов и температура оказывают уже меньшее влияние на процесс. Анализ влияния различных факторов на интенсивность процесса должен быть основан на законах массопередачи. Основное уравнение массопередачи отражает зависимость скорости массопередачи от движущей силы процесса, в качестве которой выступает разность концентраций вещества в разных точках системы. R = Kм f ∆C , где Км – коэффициент массопередачи, f – удельная поверхность контакта фаз, ∆C – движущая сила процесса.  Движущей силой любого массообменного процесса является разность (градиент) концентраций. Если в разных точках объема фазы концентрация вещества различна, молекулы вещества начнут самопроизвольно перемещаться в направлении, в котором концентрация его меньше. Движущей силой любого массообменного процесса является разность (градиент) концентраций. Если в разных точках объема фазы концентрация вещества различна, молекулы вещества начнут самопроизвольно перемещаться в направлении, в котором концентрация его меньше.Д  вижущая сила процесса ∆C = С1 – С2. Скорость процесса тем больше, чем больше разность концентраций. Пределом протекания процесса является равенство концентраций во всем объеме фазы С1 = С2. В этот момент ∆C = 0 и скорость процесса массопереноса равна нулю. Таким образом, движущая сила процесса массопередачи и скорость уменьшаются во времени. вижущая сила процесса ∆C = С1 – С2. Скорость процесса тем больше, чем больше разность концентраций. Пределом протекания процесса является равенство концентраций во всем объеме фазы С1 = С2. В этот момент ∆C = 0 и скорость процесса массопереноса равна нулю. Таким образом, движущая сила процесса массопередачи и скорость уменьшаются во времени.В случае гетерогенного процесса массоперенос осуществляется не только внутри фазы, но и через границу раздела фаз. Закон Фика: -градиент концентраций. Первый закон Фика характеризует скорость проникновения атомов одного вещества в другое при постоянном во времени потоке этих атомов и неизменном градиенте их концентрации. 7. Способы увеличения движущей силы процесса. Коэффициент массопередачи. Увеличение движущей силы процесса может быть достигнуто: а) возрастанием концентраций взаимодействующих компонентов в исходных материалах (сырье); б) повышением давления; в) регулированием температуры процесса; г) отводом продуктов реакции из реакционного объема с целью сдвига равновесия в сторону продукта. Движущая сила химических реакций, процессов абсорбции, адсорбции и конденсации выражается через разности действительных с и равновесных с* концентраций реагирующих веществ (с—с*). Поэтому увеличение движущей силы процесса может осуществляться или увеличением действительной конц-ии, или уменьшением равновесной, или одновременным соответствующим изменением обеих величин. Увеличение концентрации взаимодействующих компонентов в исходном сырье повышает действительную конц-ю и пропорционально увеличивает скорость процесса. Способ увеличения конц-ии взаимодействующих комп-ов в исх сырье зависит от агрегатного состояния материала. Увеличение содержания полезного составляющего в тв сырье называется обогащением, а в жид и газообразном — концентрированием. Увеличение концентрации взаимодействующих веществ — это один из самых распространенных приемов для интенсификации процессов. Повышение давления влияет на скорость процесса и состояние равновесия. Давление сильно влияет на скорость процессов, идущих в газовой фазе или же при взаимодействии газов с жидкостями и твердыми телами. В гомогенных процессах, протекающих в газовой фазе или в гетерогенных с участием газообразных компонентов, повышение давления уменьшает объем газовой фазы и соответственно увеличивает концентрации взаимодействующих веществ. Таким образом, повышение давления равносильно росту концентрации реагентов. Влияние давления определяется кинетическими уравнениями. В промышленности широко применяют повышенное давление для ускорения абсорбции. Для процессов десорбции газов и испарения жидкостей ускорение процесса и повышение выхода достигается снижением давления, т. е. применением вакуума. Коэффициент массопередачи – это количество вещества, переданного из одной фазы в другую через единицу поверхности в единицу времени при движущей силе равной единице. Основное уравнение массопередачи:  , , где М – нагрузка аппарата, F – пов-ть соприкосновения фаз,  – разность конц-ий (т.к.конц-ии фаз в ходе процесса меняются, то изменяется и – разность конц-ий (т.к.конц-ии фаз в ходе процесса меняются, то изменяется и  – ед. времени – ед. времениИз него следует: 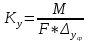 [ [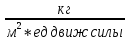 ] ]Движущая сила одного и того массообменного процесса может быть выражена разностью концентраций и по другой фазе: Чаще всего в массообменных аппаратах поверхность соприкасающихся фаз практически неопределима (например: жидкость с газовыми пузырями). Поэтому основное уравнение массопередачи (ОУМП) применяют в виде | ||||||||||||||||
