ХИМИЯ: тесты и вопросы. ХИМИЯ тесты и вопросы. Вопросы для самоподготовки
 Скачать 245.24 Kb. Скачать 245.24 Kb.
|
|
Вопросы для самоподготовки Что такое атомная орбиталь? Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1]; задаётся: главным n, орбитальным l, и магнитным m — квантовыми числами. Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемом ядром атома со всеми остальными электронами атома. Может ли магнитное квантовое число по своему значению превышать значение главного квантового числа того же электронного слоя? Да Может ли химическая связь между атомами осуществляться одним электроном? Может Какими показателями характеризуют прочность химической связи? Прочность связи. Мерой прочности химической связи может служить как количество энергии, затрачиваемой на ее разрыв, так и величина, которая при суммировании по всем связям дает энергию образования молекулы из атомов (средняя). Энергия разрыва связи (энергия диссоциации связи) всегда положительна энергия образования связи по величине та же, но имеет отрицательный знак. Чем должны обладать химические частицы для установления между собой химической связи по ковалентному механизму? Чем определяется валентность элемента в конкретном соединении? В чем состоит главная причина гибридизации атомных орбиталей, участвующих в образовании химических связей? Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам. Причины: необходимость образования равноценных связей с другими атомами. Максимальное удаление атомов друг от друга в пространстве. Какие атомные орбитали могут гибридизоваться? Если атом углерода образует только одинарные связи, то он находится в центре тетраэдра молекулы, в вершины которого ориентированы р -гибридные атомные орбитали углерода .При наличии двойной связи атомные орбитали углерода гибридизуются по типу р, а прн наличии тройной связи — по типу 3р. Наряду с σ-связью может образоваться и π-связь, если на орбитали атома металла, которая может перекрываться с вакантной орбиталью донорного атома, находятся соответствующие -электроны. Эта связь изменяет распределение заряда как у атома металла, так и у лиганда, усиливая σ-связь. Чем больше электронные облака перекрывают друг друга, тем более прочной является образующаяся ковалентная связь. Было показано, что для удовлетворения этого критерия необходимо, чтобы исходные атомные орбитали были гибридизованы, образуя новую систему эквивалентных орбиталей, принимающих участие в связи и имеющих определенное направление в пространстве. Вообще орбитали могут эффективно гибридизоваться лишь в том случае, если они имеют близкие энергии. У атомов с малыми Z для гибридизации пригодны только s- и р-орбитали. У атомов с большими Z в гибридизации могут участвовать также d-орбитали, что значительно расширяет возможности осуществления различных симметрий. По-видимому, наиболее важной из всех встречающихся в неорганической химии конфигураций является октаэдрическая конфигурация. Она возникает, когда к s- и р-орбиталям примешиваются еще две d-орбитали. Пространственное расположение шести гибридных sр -орбиталей и их связь с отдельными атомными орбиталями можно представить наглядно, рассматривая снова ядро в центре куба. Три взаимно перпендикулярные р-орбитали, ориентированные к центрам граней, и две d-орбитали направленные точно так же, смешиваются со сферически симметричной s-орбиталью, образуя шесть гибридных орбиталей, каждая из которых ориентирована к центру грани куба. Какой тип гибридизации атомных орбиталей наиболее часто осуществляется в неорганических соединеиях? sp-гибридизация 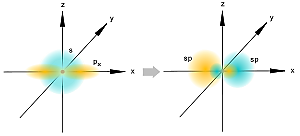 sp-гибридизация Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподеленными парами электронов. Что такое координационное число атома в его соединении? Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность. Что является мерой полярности химической связи? В качестве количественной меры полярности связи чаще всего используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный [относительный] смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи. Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Нδ+ — Clδ−, где δ — некоторая доля элементарного заряда) (Oδ−=C2δ+=Oδ−), Hδ+—O2δ−—Hδ+. Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны. ТЕСТ №1 1. Сколько квантовых чисел характеризуют состояние электрона в атоме? а) 6; б) 2; в) 4; г) 5. 2. Какому элементу соответствует следующее строение внешнего электронного уровня:  а) титан; б) алюминий; в) кремний; г) сера. 3. В какой из приведенных ниже частиц нет π-связей? а) SO3; б) CO2; в) K2O; г) MgO. 4. У какого из перечисленных веществ тетраэдрическая форма молекулы? а) ВеCI2; б) AIF3; в) СCI4; г) SCl6. 5. В каком соединении ионная связь? а) FrF; б) CCI4; в) NH3; г) SO2. Вопросы для самоподготовки По каким признакам классифицируют химические соединения? 1. Число и состав исходных веществ и продуктов реакции. 2. Агрегатное состояние реагентов и продуктов реакции. 3. Число фаз, в которых находятся участники реакции. 4. Природа переносимых частиц. 5. Возможность протекания реакции в прямом и обратном направлении. 2. Какие соединения называются оксидами, кислотами, основаниями, солями? Оксид (окисел, окись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Кислоты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка. Основания — (основные гидроксиды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов. В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли» ) с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание» , так и в виде «солей алкалоидов» . Соли — вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония ) и анионов кислотного остатка. 3. Составьте химические и графические формулы соединений: ортокремниевая кислота, сульфат алюминия, гидросульфит магния, гидросульфид калия, гидрокарбонат бария, иодид гидроксостронция, нитрат гидроксохрома (III), сульфат дигидроксожелеза (III). ортокремниевая кислота 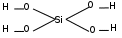 H4SiO4 H4SiO4сульфат алюминия Al2(SO4)3 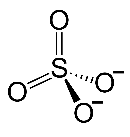 гидросульфит магния Mg(HSO3)2 гидросульфид калия KHSO3, 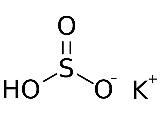 гидрокарбонат бария Ba(HCO3)2 иодид гидроксостронция (SrOH)2I 4. Напишите формулы оксидов, соответствующие указанным гидроксидам (KOH, H2SO4, Be(OH)2). Укажите кислотно-основные свойства оксидов и подтвердите химическими реакциями в молекулярном виде. Назовите полученные соединения. 5. Приведите молекулярные уравнения реакций получения солей (кислых, основных, средних) при взаимодействии гидроксидов H4SiO4, Mn(OH)2, Sn(OH)2 с а) HCl; б) NaOH. Назовите полученные соли. Если взаимодействие не происходит, объясните причину. 6. Назовите соединения, приведите их графические формулы: H3PO4, Ca(OH)2, Cr2(SO4)3, KMnO4, NaHSO3, Ca(H2PO4)2, (ZnOH)2SeO4, SO3. H3PO4 - Ортофосфорной кислоте Ca(OH)2 - Гидроксид кальция Cr2(SO4)3 - Сульфат хрома KMnO4 - Перманганат калия NaHSO3 - Гидросульфит натрия Ca(H2PO4)2 - дигидрофосфат кальция (ZnOH)2SeO4 - это комплексное соединение, образованное Zn(OH)2 и H2SeO - гидроксиселенат цинка и оксид серы. SO3 - Оксид серы 7. Составьте молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения: LiLiOHLiH2PO4Li2HPO4Li3PO4 BeBeCl2Be(OH)2Na2[Be(OH)4]BeCl2 2Li + 2H2O = 2LiOH + H2 LiOH+H3PO4=LiH2PO4+H2O LiH2PO4+LiOH=Li2HPO4+H2O Li2HPO4+LiOH=Li3PO4+H2O Be+2HCl=BeCl2+H2 BeCl2+2NaOH=Be(OH)2+2NaCl Be(OH)2+2NaOH=Na2[Be(OH)4] Na2[Be(OH)4]+4HCl=2NaCl+BeCl2+4H2O 8. Закончите уравнения реакций и назовите полученные соединения. Li2O + P2O5 = Li3PO4 ZnO + Na2O Na2ZnO2; CO2 + Mg(OH)2 H2O + Mg2CO3 CaOHNO3 + HCl Ca(NO3)2 + 2H2O + CaCl2; NaHCO3 + NaOH; Mg(HSO4)2 + MgOHNO3. 9. Составьте в молекулярном виде реакции получения всех возможных солей при взаимодействии гидроксида цинка и серной кислоты. При взаимодействии оснований с кислотами возможно получение следующих солей: 1)средних 2) кислых 3)основных СРЕДНЯЯ СОЛЬ сульфат цинка Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O КИСЛАЯ СОЛЬ Zn(HSO4)2 гидросульфат цинка (избыток кислоты) Zn(OH)2 + 2H2SO4 => Zn(HSO4)2 + 2H2O ОСНОВНАЯ СОЛЬ (ZnOH)2SO4 сульфат гидроксоцинка ( избыток основания) 2Zn(OH)2 + H2SO4 => (ZnOH)2SO4 + 2H2O 10. С какими из перечисленных ниже веществ будут реагировать серная кислота, гидроксид калия: Ba(NO3)2, ZnO, AICI3, CO2, Mg, Cu(OH)2, NaHCO3, Al, FeOHCI2, Be(OH)2. Напишите уравнения соответствующих реакций. ТЕСТЫ №2 1. Вставьте в уравнения реакций пропущенные соединения: а) SO2 + ... = K2SO3; б) H2SO4 + ... = ... + H2O; в) KOH + ... = AgOH + ...; г) NaCl + ... = PbCI2 + .... 2. Какие из перечисленных гидроксидов одновременно являются кислотами? а) Ba(OH)2; б) Be(OH)2; в) Mn(OH)2; г) Fe(OH)2. 3. Сколько кислых солей может быть получено при взаимодействии гидроксида калия и ортофосфорной кислоты? а) ни одной; б) три; в) две; г) одна. 4. Какие из приведенных реакций записаны неправильно: а) KOHSO3 + CaHNO2 = KSO3 + CaNO2 + H2O; б) Ca(OH)2 + 2NaOH = NaCaO2 + 2Н2О; в) SO3 + K2O = K2SO4; г) 3K2HPO4 + 3NaOH = 2K3PO4 + Na3PO4 + 3Н2О? 5. Из какого соединения можно получить негашеную известь? а) карбонат кальция; б) сернистая кислота; в) гидрокарбонат натрия; г) гидроксид кальция. Вопросы для самоподготовки 1 Что называется эквивалентом, молярной массой эквивалента вещества, эквивалентным объемом? Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентом вещества. Значение эквивалентного объема вещества, находящегося в газообразном состоянии, можно найти, зная, что в мольном объеме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов, состоящего из двухатомных молекул — 2 моля атомов и т. д. 2. Плотность газа по воздуху равна 0,59. Массовая доля азота в нем составляет 82,35%, водорода – 17,65%. Выведите формулу газа. Dвозд = 0,59 w(N) = 82,35% w(H) = 17,65% Вывести формулу газа Решение Плотность любого газа по воздуху определяется формулой, отсюда молярная масса газа M вычисляется по формуле Найдем формулу газа. В 100 г соединения m(N) : m(H) = 82,35 : 17,65, соответственно Формула газа: NH3. 3. Какой объем займут 1,505 · 1023 молекул газа при н.у.? дано: N(газ) = 1,505 *10²³ молекул найти: V(газ) решение: n(газ) = N\Na = 1,505 *10²³ \6,023*10²³ моль ⁻¹ = 0,25 моль V(газ) = Vm *n = 22,4 л\моль*0,25моль = 5,6 л ответ: V(газ) = 5,6 л 4. Какая масса природного известняка, содержащего 90 мас. % CaCO3, потребуется для получения 7,0 т негашеной извести? Какой объем газа выделится (T = 600C, P = 750 мм.рт.ст.)? CaCO₃⇒CaO + CO₂ 7 т = 7 000 кг v(CaO) = 7 000 / 0,056 кг/моль = 125 000 моль v(CaCO₃) = v(CaO) m(CaCO₃) = 125 000 моль * 0,1 кг / моль = 12 500 кг m(CaCO₃)₀ = 12 500 / 90% = 13888,889 кг 5. Вычислите объем водорода, выделившегося при взаимодействии цинка массой 13 г с серной кислотой массой 30 г (н.у) Уравнение реакции:Zn + H2SO4 = ZnSO4 + H2Определяем количества вещества реагентов:n(Zn) = 13/65 = 0,2 мольn(H2SO4) = 30/98 = 0,306 мольИз уравнения реакции следует, что кислота и цинк реагируют в соотношении 1:1, однако расчеты показывают, что цинк взят в недостатке, поэтому объем выделившегося водорода рассчитываем по цинку: Zn + H2SO4 = ZnSO4 + H2 13 г х л 65 г 22,4 лОтсюда х = 4,48 лОтвет: 4,48 л 6. Молярные массы эквивалентов кислорода и серы равны 8 г/моль. Выведите формулу их соединения и вычислите его молярную массу. 7. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,672 дм3 водорода. Определите этот металл. 8. При разложении оксида металла массой 0,92 г выделился металл массой 0,86 г. Вычислите молярную массу эквивалента металла. MexOy=xMe+yO2 m(O)=0.92-0.86=0.06г Ac2O3 Me=228/3=76 9. Определите массу соли, образующейся при взаимодействии оксида кальция массой 14 г с раствором, содержащим азотную кислоту массой 35 г. CaO+2HNO3=Ca(NO3)2 +H2O 1 моль 2 моль находим количества вещест n=m/M n(CaO)=14/56=0,25 моль n(HNO3)=35/63=0,56 моль По уравнению видно, что вещества вступают в реакцию как 1 к 2, значит на 0,25 моль СаО нужно 0,25*2=0,5 моль НNO3/ В реакцию полностью вступает СаО Соли образуется 0,25 моль m=n*M=0,25*164=41 г 10. К раствору, содержащему хлорид кальция массой 0,22 г, прибавили раствор, содержащий нитрат серебра массой 2,00 г. Какова масса образовавшегося осадка? Какие вещества будут находиться в растворе? CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2 n (CaCl2) = m/M = 0,22 г/111 г/моль = 0,002 моль n (AgNO3) = m/M = 2 г/170 г/моль = 0,012 моль таким образом, хлорид кальция в избытке 11. Определите эквивалентную массу карбоната кальция в реакции: CaCO3 + 2HCI = CaCI2 + CO2 + H2O CaCO2/2 = 42 ТЕСТ №3 1. У какого из элементов эквивалентная масса равна 8 г/ моль-экв? а) азот; б) кислород; в) углерод; г) кремний. 2. Что такое абсолютная масса? а) масса одной структурной единицы (атома, молекулы, иона); б) число частиц в одном моль; в) масса сложного соединения; г) масса простого соединения. 3. В какой реакции эквивалент ортофосфорной кислоты равен единице? а) H3PO4 + KOH = KH2PO4 + H2O; б) H3PO4 + 3KOH = K3PO4 + 3H2O; в) H3PO4 + 2KOH = K2HPO4 + 2H2O. 4. Какой объем занимают 4,4 г оксида углерода (IV) (н,у.)? а) 11,2 л; б) 44 л; в) 2,24 л; г) 22,4 л; д) 4,4 л. 5. Какова формула соли, если массы элементов находятся в соотношении K : S : O = 61:50:100? а) K2S2O7; б) K2S2O4; в) K2S2O8; г) K2S2O3. 6. Укажите массу и объем 0,1 моль воды при н.у.: а) 1,8 г; 2,24 л; б) 1,8 г; 18 л; в) 1,8 г; 22,4 л; г) 0,1 г; 0,1 л; д) 3,6 г; 22,4 л. ТЕСТ №4 1. Какая масса сульфата натрия содержится в 300 г 15%-го раствора соли? а) 25; б) 30; в) 45; г) 15. 2. Определите процентную концентрацию раствора, полученного при смешивании 300 г 20 %-го раствора с 200 г воды. а) 12; б) 10; в) 24; г) 16. 3. Какой объем 0,5 М раствора серной кислоты можно приготовить из 4,9 г кислоты? а) 200 мл; б) 100 мл; в) 250 мл; г) 400 мл. 4. Какая масса карбоната натрия необходима для приготовления 500 мл 1 н. раствора? а) 10,3 г; б) 26,5 г; в) 20,8 г; г) 1,04 г. 5. Какова нормальность 16%-го раствора гидроксида натрия (р = 1,12 г/мл)? а) 0,5 н; б) 5,1 н; в) 1,2 н; г) 4,5 н. ТЕСТ №5 1. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 100,8 кДж теплоты. Определить ΔH˚ образования CuO а) - 635,0 кДж/моль; б) -293,6 кДж/моль; в) 348,3 кДж/моль; г) 128,6 кДж/моль. 2. Энтальпия растворения CuSO4 · 5H2O в воде равна +117,7 кДж, а энтальпия гидратации CuSO4 равна – 77,8 кДж. Вычислить энтальпию растворения CuSO4. а) 39,9 кДж; б) 195,5 кДж/; в) -195,5 кДж; г) -28,6 кДж. 3. При сгорании 2 г графита до углекислого газа (стандартных условия) выделилось 65,6 кДж теплоты. Определить теплоту образования CO2(г). а) 393,6 кДж/моль; б) 264,3 кДж/моль; в) 1028,3 кДж/моль; г) – 444,5 кДж/моль. 4. Какое количество теплоты выделится при гашении 1 кг оксида кальция (тепловой эффект реакции равен –369,1 кДж/моль). а) 3746 кДж; б) 369,1 кДж; в) 738,2 кДж; г) 6591 кДж. 5. Сколько л азота, приведенных к н.у., участвовало в реакции с водородом при образовании аммиака, если при этом выделилось 18,45 кДж теплоты? а) 8,43 л; б) 22,4 л; в) 4,47 л; г) 11,2 л. ТЕСТ №6 1. Как изменится скорость прямой реакции А(г) + 2В(г)→АВ2, если давление в системе увеличить в 4 раза? а) скорость уменьшится в 10 раз; б) скорость не изменится; в) скорость увеличится в 16 раз; г) скорость увеличится в 64 раза. 2. Температурный коэффициент скорости некоторой реакции равен 2,0. Как изменится скорость этой реакции, если понизить на 40 градусов? а) увеличится в 8 раз; б) уменьшится в 8; в) уменьшится в 16 раз ; г) увеличится в 16 раз. 3. В гомогенной системе А + В = 2С равновесные концентрации реагирующих газов (моль/л): [А] = 0,06; [В] = 0,2; [С] = 0,8. Вычислите константу равновесия системы. а) 4,6; б) 25; в) 12; г) 53. 4. Для реакции NO(г) + O2(г) = NO2(г) при 25°С Кр = 0,1. Какова ∆G реакции? а) 23,5 кДж/моль; б) -5,7Дж/моль; в) -44,8 кДж/моль; г) 22,44 кДж/моль. 5. В каком направлении сместится равновесие при понижении температуры в реакции: C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г )(∆Ho= -1323 кДж)? а) сместится вправо; б) сместится влево; в) равновесие не изменится. ТЕСТ №7 1. Как изменит окраску лакмус в растворе CuCI2? а) красный; б) синий; в) голубой; г) оранжевый. 2. Какая из солей не подвергается гидролизу? а) NaNO3; б) MgCl2; в) FeCl3; г) K3PO4. 3. Раствор какой соли имеет такую же среду, как и раствор соли Fe(NO3)2? а) K3PO4; б) NaNO3; в) MgCl2; г) CaCI2. 4. Добавление NaOH к раствору какой соли усиливает гидролиз? а) K2S; б) Na2CO3; в) ZnCl2; г) Na3PO4. 5. Указать рН раствора соли Ca(NO3)2: а) < 7; б) = 7; в) > 7; г) = 0. ТЕСТ №8 Заряд комплексообразователя в [Ni(H2O)2(NH3)3Cl]Cl2 равен а) +3; б) +2; в) +4; г) +1 2. Формулой гексацианохромита калия является: а) K4[Cr3(CN)6]; б) K3[Cr2(CN)5]; в) K3[Cr(CN)5]; г) K3[Cr(CN)6]. 3. Формуле [Co(H2O)2(NH3)2(NO2)2]CI соответствует название а) хлорид динитродиамминдиаквакобальта (III); б) хлорид динитродиамминдиаквакобальта (II); в) хлорит нитритодиамминдиаквакобальта (III); г) хлорид динитритодиамминдиаква кобальта (II). 4. Координационное число комлексообразователя в [Fe(NH3)3(H2O)(OH)2]NO3 равно а) 5; б) 6; в) 4; г) 3. 5. Лигандом в комплексном соединении K2[SiF6] является а) калий; б) кремний; в) фтор. ТЕСТ №9 1.Коэффициент перед молекулой восстановителя в уравнении реакции K2Cr2O7 + NaNO2 + H2SO4 = Cr2(SO4)3 + NaNO3 + K2SO4 + H2O равен: а) 3; б) 6; в) 4; г) 2. 2. Какие из перечисленных веществ обладают восстановительными свойствами: а) NH3; б) HNO3; в) KMnO4; г) H2SO4. 3. Окислителем в реакции KMnO4 + KNO2 + H2SO4 = MnSO4 +K2SO4+ KNO3 + H2O является: а) H2SO4; б) KNO2; в) KMnO4; г) KNO3. 4. Коэффициент перед молекулой окислителя в уравнении реакции CrCI3 + Br2 + KOH = K2CrO4 + KBr + KCI + H2O равен: а) 3; б) 4; в) 5; г) 6. 5. Для того, чтобы определить направление окислительно-восстановительной реакции, необходимо рассчитать… а) элекродвижущую силу; б) силу тока; в) свободную энергию Гиббса; г) температуру. ТЕСТ №10 1.В гальваническом элементе электроны движутся: а) от катода к аноду; б) от анода к катоду; в) движения электронов нет; г) от аниона к катиону. 2. Значение электродного потенциала меди, погруженной в 0,0002 н. раствор Cu(NO3)2 составляет: а) –0,22 В; б) +0,25 В; в) -0,63 В; г) +1,2 В. 3. На сколько граммов уменьшится масса CuSO4 в растворе, после того как 1,2 г железа опущенного в раствор полностью прореагирует: а) 1,2 г; б) 0,6 г; в) 2,4 г; г) 3,4 г. 4. Определите электродвижущую силу гальванического элемента, состоящего из цинковой и алюминиевой пластин, погруженных в растворы их солей, если ΔG элемента равно -283 кДж: а) 1,62 В; б) 1,46 В; в) 0,71 В; г) 0,83 В. 5. Электроды погружены в 0,2 н. растворы солей. Вычислите ЭДС гальванического элемента (-)Fe/Fe(NO3)2//АgNO3/Аg(+): а) 1,23 В; б) 0,86 В; в) 1,36 В; г) 0,72 В. ТЕСТ №11 1. Какие вещества выделятся на аноде при электролизе расплава карбоната калия? а) калий; б) кислород; в) диоксид углерода и кислород; г) диоксид углерода. 2. Какие вещества выделятся на катоде при электролизе раствора хлорида натрия? а) натрий; б) хлор; в) водород; г) кислород. 3. Сколько времени необходимо затратить для получения 6 г меди при электролизе раствора хлорида меди(II) при силе тока 8 А? а) 1 час; б) 2 часа; в) 10 мин; г) 18,8 мин. 4. Какая масса металла выделится на катоде при электролизе расплава хлорида магния, если время электролиза -20 мин, а сила тока – 7А? а) 1 г; б) 10 г; в) 5 г; г) 7 г. 5. При электролизе водного раствора нитрата кальция на электродах выделяются: а) NO и Ca; б) Ca и H2; в) O2 и H2; г) O2 и Ca. ТЕСТ №12 1. Какой металл не корродирует в разбавленной серной кислоте в результате образования защитной пленки: Sn, Pb, Fe, Zn? а) Zn; б) Pb; в) Fe; г) Sn. 2. Укажите металл, переходящий в пассивное состояние при действии концентрированной азотной кислоты Zn, Fe, Cu, Mg. а) Zn; б) Fe; в) Cu; г) Mg. 3. Почему коррозия чистого цинка протекает очень медленно, а с примесью меди - быстро? а) потому, что разделяются катодные и анодные процессы; б) потому, цинк реагирует с медью; в) потому, что медь вытесняет цинк; г) потому, что одновременно корродируют два металла. 4. При контакте с каким металлом быстрее протекает коррозия железа: Fe/Ni, Fe/Sn, Fe/Cd, Fe/Cu? а) Fe/Ni; б) Fe/Cu; в) Fe/Cd; г) Fe/Sn. 5. Какой металл можно использовать для протекторной защиты железных конструкций от коррозии? а) Cu; б) Sn; в) Zn; г) Pb. |
