Вопросы (2). Вопросы к экзамену по дисциплине Химия для студентов специальности 31. 05. 02 Педиатрия Основные понятия химической термодинамики. Внутренняя энергия, работа, теплота, связь между ними
 Скачать 43.03 Kb. Скачать 43.03 Kb.
|
|
ФГБОУ ВО «Ставропольский государственный медицинский университет» Министерства здравоохранения Российской Федерации Кафедра общей и биологической химии «Утверждено» Проректор по учебной деятельности профессор Ходжаян А.Б. ______________________ «___»_____________2021г. «Согласовано» декан педиатрического факультета доцент, д.м.н. Л.Я. Климов ________________________ «___»______________2021г Вопросы к экзамену по дисциплине «Химия» для студентов специальности 31.05.02 Педиатрия 1. Основные понятия химической термодинамики. Внутренняя энергия, работа, теплота, связь между ними. 2. I начало термодинамики: определение, математическое выражение для изолированных, закрытых и открытых систем. Энтальпия, математическое выражение. Биологическое значение 1 начала термодинамики. 3. Стандартная энтальпия образования и сгорания вещества. Закон Гесса: формулировка, математическое выражение. Следствия из закона Гесса. Значение для термохимических расчетов. 4. Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов. Повозрастная динамика изменения энтропии организма. 5. II закон термодинамики: сущность, формулировка, математическое выражение для изолированных систем. Энергия Гиббса как обобщенная термодинамическая функция, ее применение для прогнозирования возможности и предела самопроизвольного протекания процессов, роль энтальпийного и энтропийного факторов. 6. Особенности живых организмов как открытых систем. Теорема И. Пригожина, поддержание состояния гомеостаза. 7. Особенности биохимических процессов в организме: закон адаптации, принцип энергетического сопряжения, многостадийность, обратимость. 8. Классификации реакций, применяющиеся в кинетике. Особенности кинетики сложных реакций. Понятие о молекулярности и порядке реакции. Примеры. Биологическая роль. 9. Скорость реакции, средняя скорость реакции в интервале, истинная скорость реакции. Кинетические кривые. Факторы, влияющие на скорость гомогенных и гетерогенных реакций. 10. Закон действующих масс, кинетические уравнения реакций, физический смысл константы скорости реакции. Напишите кинетические уравнения для реакций: а)2СО(г)+О2(г) → 2СО2(г); б) Н2(г)+S(тв.) → H2S(тв.) 11. Теория активных соударений. Энергетический профиль реакции. Природа энергии активации. Переходное состояние. 12. Влияние температуры на скорость реакции, особенности для биохимических процессов. Правило Вант-Гоффа. Энергия активации, ее значение, факторы, влияющие на величину энергии активации, источники активации реагирующих частиц. Уравнение Аррениуса, значение для характеристики скорости протекания химических реакций. 13. Катализ, катализаторы, ингибиторы, общие принципы катализа: -суть механизма гомогенного катализа, примеры; - энергетический профиль каталитической реакции; -особенности механизма гетерогенного катализа, примеры. 14. Закон действующих масс для обратимых процессов. Константа химического равновесия, способы ее выражения, факторы, влияющие на ее величину, связь с G, значение для характеристики обратимых процессов. 15. Коллигативные свойства растворов. Законы Рауля. Понятие о крио- и эбулиометрии, их применение в медико-биологических исследованиях. 16. Коллигативные свойства растворов электролитов и неэлектролитов: явления диффузии, осмоса. Осмотическое давление, закон Вант-Гоффа. Изотонический коэффициент. 17. Значение осмоса для живых организмов. Экзоосмос, эндоосмос, изоосмия. Осмотическое давление крови. Изо-, гипер-, гипотонические растворы, применение в медицине. Понятие об «осмотическом шоке» и «осмотическом конфликте». 18. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита Математическая связь между константой и степенью ионизации (вывод и формулировка закона разведения Оствальда). 19. Элементы теории растворов сильных электролитов Дебая- Хюккеля. Ионная сила, ее математическое выражение. Понятие об активности. Коэффициент активности. 20. Основные положения теории кислот и оснований Бренстеда- Лоури. Константа кислотности и основности. 21. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя. 22. Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория ЖМКО). 23. Протолитические реакции. Типы протолитических реакции (нейтрализации, гидролиза, ионизации). Примеры. 24. Буферные системы, буферные растворы, их состав. Классификация буферных систем. Механизм действия буферных систем. 25. Количественные характеристики буферных систем. Факторы, влияющие на буферную емкость. Распределение буферных систем в цельной крови и сыворотке по буферной емкости. 26. Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия. 27. Буферные системы крови: гидрокарбонатная буферная система. Состав, механизм действия, биологическая роль. 28. Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль. 29. Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль. 30. Буферные системы крови: протеиновая буферная система. Состав, механизм действия, биологическая роль. 31. Понятие о кислотно-основном состоянии организма. Ацидоз. Алкалоз. Щелочной резерв крови. Применение реакции нейтрализации в фармакотерапии. 32. Гетерогенные реакции в растворах электролитов. Константа растворимости. Соотношение между величиной Кs и произведением молярных концентраций ионов в насыщенном, ненасыщенном и пересыщенном растворе. 33. Условия существования гетерогенных равновесий. Взаимосвязь между растворимостью (S) и константой растворимости (Ks). Условия образования и растворения осадков, достижение полноты осаждения ионов из насыщенных растворов труднорастворимого электролита. 34. Гетерогенные процессы и равновесия в организме. Реакции, лежащие в основе неорганического вещества костной и зубной ткани; механизм функционирования кальций- фосфатного буфера. 35. Изолированные и совмещенные конкурирующие гетерогенные процессы. Примеры конкуренции за общий анион и общий катион. Явление изоморфизма. Биологическое значение. Реакции, лежащие в основе образования патологических конкрементов. 36. Комплексные соединения, их строение на основе координационной теории А. Вернера. Катионные, анионные, нейтральные комплексы. Номенклатура, примеры. 37. Реакции замещения лигандов. Константа нестойкости комплексного иона, константа устойчивости. 38. Конкуренция за лиганд или за комплексообразователь: изолированное и совмещенное равновесия замещения лигандов. Примеры конкурирующих процессов, приводящих к разрушению комплексного соединения. 39. Представления о строении металлоферментов и других биокомплексных соединений. Физико-химические принципы транспорта кислорода гемоглобином. 40. Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов на основе теории жестких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. 41. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностная энергия Гиббса и поверхностное натяжение. Механизм возникновения свободной поверхностной энергии Гиббса на границе раздела фаз жидкость-газ. Сорбция и ее виды. 42. Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Изотерма адсорбции Гиббса. Поверхностная активность, положительная и отрицательная адсорбция. 43. Поверхностно-активные, поверхностно-инактивные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран. 44. Адсорбция газов на твердых телах, факторы, влияющие на этот процесс. Теория Ленгмюра. Уравнение Ленгмюра. Изотерма адсорбции Ленгмюра. 45. Адсорбция из растворов на твердых адсорбентах. Молекулярная адсорбция. Правило выравнивания полярностей. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции. 46. Ионная адсорбция, факторы на нее влияющие. Правило Панета-Фаянса, лиотропные ряды. Применение в медицине. 47. Дисперсные системы. Классификация дисперсных систем Природа коллоидного состояния. 48. Методы получения и очистки коллоидных растворов. Физико-химические принципы функционирования искусственной почки. 49. Молекулярно-кинетические и оптические свойства коллоидно-дисперсных систем. Эффект Фарадея-Тиндаля. Уравнение Рэлея, его анализ. 50.Электрокинетические свойства: электрофорез и электроосмос; потенциал течения и потенциал седиментации. Биологическое значение. 51. Строение мицеллы лиофобного золя. Строение двойного электрического слоя. Межфазный и электрокинетический потенциалы коллоидных частиц, зависимость от различных факторов. Понятие об электрокинетическом потенциале как о факторе устойчивости. 52. Устойчивость дисперсных систем. Седиментационная и агрегативная и устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей. 53. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди, явление привыкания. Взаимная коагуляция. Коагуляция смесями электролитов. Биологическое значение коагуляции. Коллоидная защита и пептизация. 54. Механизм и кинетика электролитной коагуляции. Нейтрализационная и концентрационная коагуляция. 55. Высокомолекулярные вещества (ВМВ). Классификация. Структура. Форма макромолекул и типы связей между ними. Гибкость макромолекул. Биологическая роль ВМС. Применение ВМС в медицинской практике. 56. Сходство и различие растворов ВМС с истинными и коллоидными растворами. Механизм набухания и растворения ВМС. Зависимости величины набухания от различных факторов. Биологическая роль набухания. 57. Аномальная вязкость растворов ВМС. Уравнение Штаудингера. Вязкость крови и других биологических жидкостей. 58. Белки как полиамфолиты. Изоэлектрическая точка (ИЭТ), методы ее определения. Кислотно-основные, окислительно-восстановительные, комплексообразующие и поверхностные свойства белков. 59. Осмотическое давление растворов биополимеров. Уравнение Галлера. Онкотическое давление плазмы и сыворотки крови, его биологическая роль. 60. Мембранное равновесие Доннана. Биологическая роль 61. Устойчивость растворов биополимеров. Высаливание биополимеров из раствора. Коацервация и ее роль в биологических системах. Застудневание растворов ВМС. Свойства студней: синерезис и тиксотропия. Примеры. 62.Предмет биоорганической химии. Понятие о функциональной группе. Классификация и номенклатура органических соединений. Значение биоорганической химии для биологии и медицины. 63.Углеводы. Классификация моносахаридов Стереохимия в проекциях Фишера. Глюкопиранозы и глюкофуранозы, α - и β- аномеры. Формулы Хеуорса. 64.Строение и стереохимия пентоз на примере рибозы и дезоксирибозы, биологическая роль. 65.Биологически важные гексозы. Строение и стереохимия (на примере глюкозы, галактозы, фруктозы). 66. Моносахариды. Химические свойства. 67.Дисахариды: мальтоза, лактоза, сахароза. Строение и восстановительная способность. Гидролиз дисахаридов in vivo и in vitro. 68.Гомополисахариды (крахмал и гликоген). Строение, свойства, биологическая роль. 69.Классификация и номенклатура аминокислот. Природные аминокислоты. Заменимые и незаменимые аминокислоты. 70.Кислотно-основные свойства, амфотерность аминокислот. Изоэлектрическая точка. Свойства аминокислот: по аминогруппе, карбоксилу, отношение аминокислот к нагреванию. 71.Биологически важные реакции α- аминокислот (дезаминирование, гидроксилирование, декарбоксилирование). 72.Пептиды и белки. Первичная структура белков. Строение пептидной группы. Гидролиз белков и пептидов. 73. Вторичная, третичная, четвертичная структура белков и связи, их поддерживающие. 74.Пуриновые и пиримидиновые основания. Ароматичность. Лактим-лактамная таутомерия и прототропная таутомерия. 75.Строение мононуклеотидов, образующих нуклеиновые кислоты. Гидролиз нуклеотидов. 76.Первичная структура ДНК и РНК. Нуклеотидный состав ДНК и РНК. 77.Вторичная структура ДНК. Роль водородных связей, правила Чргаффа. Биологическая функция ДНК. 78.Вторичная структура РНК. Виды РНК. Их биологическая роль. 79.Строение АМФ, АДФ, АТФ. Биологическая роль АТФ. 80. Липиды. Классификация по Уайту. Биологическая роль. Нейтральные жиры. Строение, номенклатура, биологическая роль. Высшие жирные карбоновые кислоты. Классификация. Биологическая роль. 81.Фосфолипиды. Строение и биологическая роль. 82.Стероиды. Стерины. Строение, биологическая роль (на примере холестерина). ПРИМЕРНЫЙ ПЕРЕЧЕНЬ ЭКЗАМЕНАЦИОННЫХ ЗАДАНИЙ ДЛЯ ОСВОЕНИЯ ПРАКТИЧЕСКИХ НАВЫКОВ 1. Золь иодида серебра AgI получен в избытке раствора йодида калия. Определить заряд частиц полученного золя, написать формулу его мицеллы и указать, какой из электролитов: хлорид калия, хлорид бария или сульфат алюминия – будет обладать наибольшей коагулирующей способностью к полученному золю. 2. Рассчитать тепловой эффект реакции окисления глюкозы при стандартных условиях С6Н12О6(г) + 6О2(г) = 6Н2О(ж) + 6СО2(г), если Н0обр.[C6H12O6(т)] = –1260 кДж/моль; Н0обр.[CO2(г)] = –393,5 кДж/моль; Н0обр.[H2O(ж)] = –285,8 кДж/моль. 3. Объяснить лечебное действие повязок с гипертоническим раствором при лечении гнойных ран, приведите примеры. На чём основано действие слабительных средств? 4. Над раствором какого вещества: глюкозы, NaCl или Na3PO4 давление пара растворителя будет меньше, если температура и мольные доли веществ равны? Дать обоснованный ответ, используя понятие изотонического коэффициента. 5. Определить изотонические коэффициенты для растворов: NaCl, Na2SO4 и Al2(SO4)3. Составить ряд по увеличению π осм. этих растворов, если Cƒ экв. их равны 1 моль/л, а степень диссоциации составляет 0,5. 6.Осмотическое давление раствора неэлектролита при 17   Па. Определить осмотическое давление этого же раствора при 57 Па. Определить осмотическое давление этого же раствора при 57 . .7. В четыре пробирки с 1М растворами СН3СООК, КCNS, К2SO4 и KCl поместили по 0,5 г полярного полимера. В каком из растворов электролита набухание полимера максимально, в каком – минимально и почему? 8.Что произойдет с эритроцитами при 310 К в 2-% растворе глюкозы (ρ=1,006 г/мл)? Ответ подтвердить расчётом. 9. Осмотическое давление 0,1 М  при 0 при 0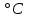 равно равно 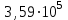 Па. Определить кажущуюся степень диссоциации соли в данном растворе. Па. Определить кажущуюся степень диссоциации соли в данном растворе.10. Над каким из растворов при одинаковых молярных концентрациях давление пара растворителя будет наибольшим: а) КCl; б) фруктоза (C6H12O6); в) Al2(SO4)3. Ответ пояснить. 11. На титрование 5 мл ацетатного буфера затрачено 3 мл раствора NaOH(Cf) =0,1 моль/л. Рассчитать буферную емкость системы, если рНо = 3, а после титрования рН = 7,5. 12. Комплексонометрия (трилонометрия): принцип метода, титрант, индикатор, реакции, лежащие в основе метода. Применение метода трилонометрии в санитарной практике и медико-биологических исследованиях. 13. Осадительное титрование (аргентометрия). Принцип выбора индикатора. Реакции, лежащие в основе данного метода. 14. Какую среду (рН) необходимо создать для окраски белков гистологических препаратов: основным красителем (R-ОН)? Написать схемы реакций. Для ответа использовать данные лабораторной работы. 15. В результате взаимодействия избытка хлорида бария с серной кислотой был получен золь. Приведите строение мицеллы, укажите ее составные части. Охарактеризовать составляющие компоненты и пояснить, какие факторы лежат в основе устойчивости коллоидных растворов. 16. Гидрофильные и гидрофобные адсорбенты (приведите примеры). На примере лабораторной работы, объяснить адсорбцию фуксина из водного и спиртового растворов. 17. Как изменяется поверхностное натяжение мочи при появлении желчных кислот? Ответ пояснить на примере лабораторной работы. 18. Рассчитать жесткость воды (ммоль/л), если на титрование исследуемой пробы воды объемом 5 мл пошло 1,5 мл раствора Трилона Б (молярная концентрация Cf=0,05 моль/л). Указать вид жесткости воды. 19. Рассчитать рН растворов, если: а) [Н+] = 10-4 ; б) [Н+] = 10-8. Укажите характер среды. 20. Что произойдет с эритроцитами если их поместить в: а) гипертонический раствор; б) гипотонический раствор; в) изотонический раствор? Дать пояснение. 21. К 5 мл золя Fe(OH)3 для начала явной коагуляции необходимо добавить один из следующих растворов: 4 мл 3 М KCl; 0,5 мл 0,01 М K2SO4; 3,9 мл 0,0005 М K4[Fe(CN)6]. Вычислить пороги коагуляции и определить, какой из электролитов имеет максимальную коагулирующую способность. 22.Константы растворимости Ks (Ag2SO4)=1,8 .10 -5 и Ks (CaSO4)=2,4. 10-5 величины одного порядка. Одинаковы ли молярные растворимости этих солей? Ответ обосновать с помощью расчетных формул. 23.Рассчитать содержание хлорид - ионов в сыворотке крови (Cf,Т) если на титрование 2 мл сыворотки затрачено 0,5 мл раствора AgNO3(Cf) =0,05 моль/л. Указать метод определения, вид титранта. 24. Поверхностное натяжение воды при температуре 20С составляет 72,75 мН/м. Некоторый объем воды вытекает из сталагмометра в виде 31 капли, а водный раствор пропионовой кислоты с концентрацией 0,25 моль/л - в виде 35 капель. Каково поверхностное натяжение этого раствора? Ответ подтвердить расчетом. Указать метод определения. 25. Напишите формулу соединения по названию: 2-гидроксипропан-1,2,3-трикарбоновая кислота. Назовите входящие функциональные группы и класс, к которому оно относится. Обладает ли данное соединение оптической активностью? Обоснуйте. 26. Напишите формулу по названию: 2-аминобутандиовая-1,4 кислота. Найдите центр хиральности и изобразите ее энантиомеры. 27. Название какого соединения соответствует тимину: 1) 2,4-диоксопиримидин; 2) 2,4-дигидрокси-5-метилпиримидин 3) 1,3,5-тринитробензол Напишите его структурную формулу, укажите таутомерную форму (лактим или лактам) Какова биологическая роль тимина? 28. Напишите формулу по названию: 2-амино-4-метилтиобутановая кислота. Укажите входящие функциональные группы и класс, к которому оно относится. Дайте тривиальное название соединению. 29. Докажите наличие альдегидной группы в молекуле глюкозы с помощью реакции Троммера. Напишите соответствующую реакцию и укажите на ее недостаток. 30. Как идентифицировать серусодержащие аминокислоты в молекуле белка? Опишите качественную реакцию Фоля и предложите соответствующие реакции. Приведите структурные формулы серусодержащих аминокислот. 31. Найдите и назовите реакционные центры в молекуле рибозы; прогнозируйте возможные химические свойства. 32. При отравлении хлоридом ртути (II) (сулема) в качестве противоядия при первой помощи используют яичный белок. Какое химическое взаимодействие лежит в основе обезвреживания сулемы? Дайте пояснения. 33. Докажите наличие гидроксильных групп в глюкозе. Напишите соответствующее уравнение реакции. 34. Напишите формулу по названию: 2-амино-3-гидроксипропановая кислота. Напишите ее оптические изомеры. 35. Напишите формулу по названию: 2-оксопентандиовая -1,5 кислота. Дайте тривиальное название соединению. Назовите входящие функциональные группы и класс, к которому оно относится. 36. Напишите формулу по названию: α, D-галактопираноза и ее β-аномер. Укажите реакционные центры. 37. Напишите формулу олеиновой кислоты (полуструктурно) и с помощью химических реакций докажите ее ненасыщенность. 38. Название какого соединения соответствует лизину: 1)2,5-диаминопентановая кислота; 2)2,6-диаминогексановая кислота; 3)бутандиамин-1,2; 4)2-аминопентандиовая кислота Укажите центр хиральности. Может ли лизин синтезироваться в организме? 39. Приведите структурную формулу фосфотидилхолина. Назовите входящие компоненты и фермент, расщепляющий его в желудочно-кишечном тракте: 40. АТФ. Напишите структурную формулу, назовите входящие компоненты, типы связей и ее биороль. 41. На примере аминокислоты аланина напишите образование возможных солей, которые могут давать аминокислоты. 42. На примере виннокаменной кислоты (2,3-дигидроксибутандиовой-1,4 кислоты) изобразите все возможные стереоизомеры. В составе какого реактива и для обнаружения какой функциональной группы используется калиево-натриевая соль этой кислоты? 43. Составьте формулу трипептида, образованного остатками аминокислот: лейцина, тирозина, серина. Назовите трипептид и качественные реакции на пептидную связь и ароматическую аминокислоту. 44. Напишите формулу по названию: 1-стеароил-2-олеоил-3-пальмитоилглицерин. Как доказать присутствие в этом соединении ненасыщенной кислоты? Напишите уравнение реакции. 45. Напишите формулу мальтозы. Обладает ли она восстанавливающей способностью? Ответ обоснуйте, приведите уравнение химической реакции. 46. Напишите формулу по названию: 2-аминопентандиовая-1,4 кислота. В какой среде будет находиться изоэлектрическая точка этого соединения? 47. Напишите схему ступенчатого гидролиза крахмала. С помощью каких качественных реакций можно доказать присутствие крахмала, промежуточных и конечных продуктов? 48. После нагревания соединения в присутствии минеральной кислоты были получены фосфорная кислота, дезоксирибоза, гуанин в соотношении1:1:1. Назовите исходное соединение. Напишите его формулу, укажите виды связей. Зав. кафедрой общей и биологической химии проф. Эльбекьян К.С. «____» __________________2021г. |
