Вопросы к экзамену по патологической физиологии Общая патология Патологическая физиология как наука и ее место среди других дисциплин. Задачи и методы исследования патологической физиологии и ее значение в подготовке будущего врача
 Скачать 1.32 Mb. Скачать 1.32 Mb.
|
|
Детергентное действие избытка свободных жирных кислот. Свободные жирные кислоты в больших концентрациях, так же как и лизофосфолипиды, оказывают детергентное действие и вызывают нарушение липидного бислоя мембран. Можно выделить четыре основных механизма повышения содержания свободных жирных кислот в клетке: усиленное поступление свободных жирных кислот в клетку при гиперлипоцидемии (повышении концентрации свободных жирных кислот в крови), что наблюдается при активации липолиза в жировой ткани, в частности, при стрессе, сахарном диабете; усиленное освобождение свободных жирных кислот в лизосомах из триглицеридной части липопротеидов, поступающих в клетку, что имеет место в условиях гиперлипопротеинемий, сопровождающих развитие атеросклероза; усиленное освобождение свободных жирных кислот из фосфолипидов мембран под действием уже упоминавшихся мембранных фосфолипаз; нарушение использования клеткой свободных жирных кислот в качестве источника энергии, что отмечается при уменьшении активности ферментов Р-окисления и цикла Кребса, а также при гипоксии. Для того чтобы предотвратить повреждающее действие избытка жирных кислот, клетка располагает системой ферментов, которые переводят свободные жирные кислоты в триглицериды. При этом наблюдается несвойственное в норме отложение последних в клетке в виде жировых капель, т. е. возникает жировая дистрофия клетки. Описанные выше липидные механизмы повреждения приводят к нарушению двух основных функций липидного бислоя клеточных мембран: барьерной и матричной. В основе нарушения барьерной функции мембран лежат два основных механизма: ионофорный и механизм электрического пробоя. Первый из них обусловлен появлением в клетке веществ, обладающих свойствами ионофоров, т. е. соединений, способных облегчать диффузию ионов через мембрану благодаря образованию проходимых через ее слои комплексов иона и ионофора. В процессе активации перекисного окисления липидов среди промежуточных продуктов его реакций появляются вещества — ионофоры по отношению к ионам кальция и водорода, в результате чего повышается проницаемость клеточных мембран для указанных ионов. Второй механизм ("самопробой") реализуется за счет существующей на многих мембранах (плазматической, внутренней митохондриальной) разности потенциалов. В результате появления гидрофильных продуктов перекисного окисления липидов, а также вследствие детергентного действия лизофосфолипидов и избытка свободных жирных кислот нарушаются электроизолирующие свойства гидрофобного слоя клеточных мембран, уменьшается электрическая их стабильность, что приводит к электрическому пробою мембраны, т. е. к электромеханическому ее разрыву с образованием новых трансмембранных каналов ионной проводимости. Сущность матричной функции липидного бислоя мембран состоит в том, что в нем вмонтированы мембранные ферменты и некоторые специализированные белки. В процессе перекисного окисления липидов нарушается активность мембранных ферментов в связи с изменением их липидного микроокружения, во многом определяющего свойства белковых молекул. Кроме того, в ходе реакций ПОЛ может произойти образование "сшивок" между молекулами белков и фосфолипидов, а также окисление сульфгидрильных групп активных центров, что приводит к необратимой инактивации ферментов. Кальциевые механизмы. Целый ряд важных патогенетических механизмов повреждения клетки обусловлен повышением концентрации ионов кальция в ее цитоплазме. В основе такого повышения могут лежать 2 механизма: избыточное поступление ионов Ca в цитоплазму и нарушение удаления их из цитоплазмы. Избыточное поступление ионизированного кальция в цитоплазму может осуществляться через неповрежденную плазматическую мембрану в случае повышения градиента его концентрации, например при гиперкальциемии. Однако гораздо чаще поступление кальция в цитоплазму усиливается в результате нарушения барьерной функции мембран, как это имеет место в условиях активации уже рассмотренных липидных механизмов повреждения клетки. Удаление ионов Ca из цитоплазмы нарушается вследствие недостаточности трех основных кальцийтранспортирующих систем клетки: Ca-насосов плазматической мембраны и эндоплазматического ретикулума; Na—Ca-обменного механизма и Ca-аккумулирующей функции митохондрий. Нарушение функционирования Ca-насосов может быть связано с наследственно обусловленными и приобретенными дефектами белковых компонентов Ca-насосов, а также с уменьшением в клетке концентрации АТФ, необходимой для осуществления процессов активного транспорта. Дефицит АТФ в клетке в свою очередь закономерно возникает в условиях нарушения энергетического обмена: при недостаточности энергетических источников в клетке, при гипоксии, при уменьшении активности ферментов гликолиза и цикла Кребса, при угнетении процессов клеточного дыхания и окислительного фосфорилирования. Na—Ca-обменный механизм удаления ионизированного кальция из цитоплазмы обеспечивается энергией градиента концентраций ионов Na по обе стороны плазматической мембраны. Поэтому основной причиной нарушения Na—Ca-обмена является уменьшение указанного градиента, что происходит в условиях нарушения функции Na—К-насоса, создающего этот градиент. Ca-аккумулирующая функция митохондрий является одним из альтернативных путей использования энергии транспорта электронов по дыхательной цепи, когда освобождающаяся энергия идет не на синтез АТФ, а на транспорт ионов Ca из цитоплазмы в митохондрии против концентрационного градиента. С учетом этого Ca-аккумулирующая функция митохондрий угнетается во всех случаях нарушения процессов транспорта электронов по дыхательной цепи. Стойкое повышение содержания ионов Ca в цитоплазме вызывает ряд важных последствий: нарушение специфических функций клетки, в осуществлении которых принимают участие ионы Ca; примером является развитие контрактуры миофибрилл мышечных клеток. При этом утрачивается способность таких клеток к расслаблению, а пересокращенные миофибриллы подвергаются разрушению под действием активированных избытком кальция протеолитических ферментов; активация фосфолипазы А, (см. выше); разобщение окисления и фосфорилирования. В условиях повышения концентрации ионов Ca в цитоплазме данный эффект возникает в результате использования энергии клеточного дыхания не на синтез АТФ, а на транспорт кальция из цитоплазмы в митохондрии. Кроме того, важное значение имеет повышение проницаемости внутренней митохондриальной мембраны под влиянием фосфолипазы А2, активированной избытком ионов кальция. Электролитно-осмотические механизмы. Электролитно-осмотические механизмы повреждения клетки обусловлены сдвигами в содержании главных клеточных катионов: Na и К. Выравнивание концентраций этих ионов по обе стороны плазматической мембраны приводит к увеличению внутриклеточной концентрации ионов Na и уменьшению концентрации ионов К в клетке. В основе указанных сдвигов могут лежать два механизма: усиленная диффузия ионов через плазматическую мембрану нарушение механизмов активного транспорта Na и К, обеспечивающих поддержание концентрационных градиентов указанных ионов. Усиление диффузии ионов Na в клетку и выход ионов К из клетки могут происходить как через неповрежденную плазматическую мембрану в условиях общих нарушений водно-электролитного обмена в организме (гипернатриемия, гипокалиемия), так и при нарушении барьерной функции плазматической мембраны. Перемещение ионов Na и К в этих случаях осуществляется через имеющиеся и вновь образовавшиеся каналы ионной проводимости за счет существующих концентрационного и электрического градиентов. Основу нарушений активного транспорта ионов Na и К через плазматическую мембрану составляет недостаточность Na—К-насосов. Главной причиной нарушений работы этих механизмов является дефицит АТФ, за счет энергии которой достигается перемещение ионов Na и К против электрохимического градиента. Поскольку основным источником АТФ для Na—К-насосов является гликолиз, то нарушения этого процесса при недостаточном поступлении глюкозы в клетку или уменьшении активности соответствующих ферментов будет приводить к рассматриваемым здесь электролитным сдвигам. Причиной нарушения функции Na—К-насосов может быть также изменение свойств липидного бислоя наружной клеточной мембраны и, в частности, увеличение содержания в нем холестерина, что наблюдается при атеросклерозе. Угнетение работы Na—К-насосов вызывается и целой группой специфических ингибиторов Na—К-АТФазы (строфантин, оубаин и др.). Сдвиги электролитного состава клетки в процессе ее повреждения проявляются развитием ряда изменений, среди которых наиболее важными являются: потеря клеткой электрического мембранного потенциала (потенциала покоя), отек клетки осмотическое растяжение мембран, приводящее к нарушению их барьерной функции. Ацидотические механизмы. В основе этой группы механизмов повреждения лежит увеличение концентрации ионов водорода в клетке, т.е. внутриклеточный ацидоз. Развитие внутриклеточного ацидоза может быть обусловлено следующими механизмами: избыточным поступлением ионов водорода в клетку из внеклеточной среды, что наблюдается в условиях общих нарушений кислотно-основного гомеостаза в организме — при декомпенсированных газовом и негазовом ацидозе; избыточным образованием кислых продуктов в самой клетке, что отмечается при активации гликолиза (молочная кислота), нарушениях цикла Кребса (три-и дикарбоновые кислоты), гидролитическом расщеплении фосфолипидов клеточных мембран (жирные кислоты, фосфорная кислота), усиленном распаде свободных адениновых нуклеотидов (фосфорная кислота); нарушением связывания ионов водорода в результате недостаточности буферных систем клетки; и, наконец, нарушением выведения ионов водорода из клетки при недостаточности Na—Н-обменного механизма цитоплазматической мембраны, а также в условиях расстройства местного кровообращения в ткани. Повышение внутриклеточной концентрации ионов водорода приводит к развитию ряда изменений: нарушению функциональных свойств белков (ферментов, сократительных и др.) в результате изменений конформации их молекул; активации лизосомальных гидролитических ферментов; повышению проницаемости клеточных мембран вследствие изменения жидкостного состояния мембранных липидов. Протеиновые механизмы включают в себя: ингибирование ферментов (обратимое и необратимое); денатурацию — т. е. нарушение нативного строения белковых молекул в результате изменений вторичной и третичной структуры белка, обусловленных разрывом нековалентных связей, и протеолиз, осуществляющийся под действием лизосомальных гидролитических ферментов (катепсинов) и Ca-активируемых протеаз. Основу нуклеиновых механизмов повреждения клеток составляют нарушения 3 процессов: репликации ДНК, транскрипции и трансляции. На субклеточном уровне реализация рассмотренных выше молекулярных механизмов повреждения клетки приводит к нарушению строения и функции отдельных ее органелл. Поскольку большинство из них относится к мембранным образованиям, то универсальным механизмом повреждения субклеточных структур является нарушение проницаемости и целостности клеточных мембран. Суммируя приведенные в этом разделе сведения, можно выделить 5 основных механизмов повреждения мембран: перекисное окисление липидов, активация фосфолипаз, осмотическое растяжение мембран, адсорбция белков на мембране (например, комплексов антиген—антитело), изменение фазового состояния мембранных липидов (ацидоз, изменения температуры). Повреждение цитоплазматической мембраны может проявляться нарушениями ее барьерной функции, расстройствами систем активного транспорта веществ (Na-К- и Ca-насосов, Na-Ca- и Na-H-обменных механизмов и др.); изменениями белков, образующих специфические каналы ионной проводимости; повреждением рецепторных макромолекул, воспринимающих внешние регуляторные сигналы; нарушениями белковых комплексов, осуществляющих межклеточные взаимодействия и, наконец, изменениями гликопротеидов, определяющих антигенность клетки. Наиболее характерными проявлениями повреждения митохондрий являются эффект разобщения окисления и фосфорилирования и угнетение клеточного дыхания. Основным патогенетическим фактором разобщения окисления и фосфорилирования является нарушение барьерной функции внутренней митохондриальной мембраны, в результате чего не может быть реализован постулированный Митчелом хемиосмотический механизм сопряжения клеточного дыхания и ресинтеза АТФ. Повышение ионной проницаемости внутренней митохондриальной мембраны делает неэффективной работу водородной "помпы", приводит к падению электрохимического градиента, энергия которого обеспечивает в норме ресинтез АТФ в определенных точках митохондриальной мембраны благодаря встроенным здесь сложным АТФ-азным комплексам. Ситуация усугубляется также и тем, что переход ионов Na и К в митохондриальный матрикс закономерно сопровождается набуханием и отеком митохондрий. Это в свою очередь приводит к растяжению митохондриальной мембраны и, как следствие, к еще большему нарушению ее барьерных функций. В результате такого "порочного круга" разобщение окисления и фосфорилирования приобретает стойкий характер. Повреждение эндоплазматического ретикулума проявляется нарушениями свойственных ему многочисленных функций: синтетической, детоксикационной, депонирующей и др. Повреждение лизосом сопровождается выходом и активацией многочисленных гидролитических ферментов, в результате чего повреждение клетки становится необратимым, происходит ее аутолиз. С повреждением микротрубочек и микрофиламентов могут быть связаны изменение формы клетки, нарушение ее подвижности, угнетение процессов клеточного деления. Все многообразные защитно-компенсаторные реакции клетки в ответ на ее повреждение можно условно разделить на 2 группы: направленные на восстановление нарушенного внутриклеточного гомеостаза направленные на создание функционального покоя поврежденной клетки. Первая группа включает в себя активацию механизмов активного транспорта ионов, репаративный синтез поврежденных компонентов клетки, усиленную регенерацию антиоксидантных систем и др. Непременным условием реализации этих механизмов является достаточное энергетическое обеспечение клетки. Это достигается, с одной стороны, повышением интенсивности энергетического обмена (активация гликолиза, клеточного дыхания, пентозного цикла), а с другой, перераспределением имеющихся в клетке энергетических ресурсов. Вторая группа реакций направлена на то, чтобы устранить возможные дополнительные сдвиги внутриклеточного гомеостаза при действии физиологических нервных и гуморальных возмущающих факторов (стабилизация повреждения) и свести к минимуму энергетические траты на выполнение специфических функций клетки, обеспечив таким образом энергетические ресурсы для восстановления нарушенного гомеостаза. Примером может служить образование в поврежденной клетке простагландинов, которые ингибируют аденилатциклазу и тем самым "охраняют" клетку от действия целого ряда медиаторов и гормонов (катехоламинов, тироксина и др.). При полном дефосфорилировании АТФ образуется аденозин, который, являясь естественным блокатором кальциевых каналов плазматической мембраны, препятствует запуску Ca-опосредуемых клеточных функций. Все перечисленные изменения, направленные на создание функционального покоя поврежденной клетки, имеют двойное значение. С одной стороны, они являются защитно-компенсаторными для самой клетки, поскольку помогают ей выжить в условиях действия повреждающего агента, с другой стороны, они имеют неблагоприятное значение для организма в целом, особенно если происходят в клетках жизненно важных органов. Виды клеточной смерти. Сравнительная характеристика некроза и апоптоза. Последствия нарушения апоптоза. На сегодняшний день известны 3 вида смерти клеток: некроз, апоптоз и конечное дифференцирование. Некроз (греч. nekros - мертвый) возникает в результате прямого воздействия патогенного фактора (микроорганизм, ишемия и др.), нарушающего целостность мембраны клетки. Это приводит к массивному выбросу индукторов воспаления и к миграции иммунных клеток к очагу поражения. В результате в зоне поврежденной клетки развивается септическое или асептическое (в зависимости от причины) воспаление. При этом происходят характерные изменения как в ядре, так и в цитоплазме. Ядро сморщивается, наблюдается конденсация хроматина (кар(опикноз), затем он распадается на глыбки (каризрексис) и растворяется (кариолизис). В цитоплазме происходят денатурация и коагуляция белков. Мембранные структуры распадаются. Нарушаются окислительно-восстановительные процессы и синтез АТФ в митохондриях, и вся клетка начинает страдать от нехватки энергии. Постепенно клетка распадается на отдельные глыбки, которые захватываются и поглощаются макрофагами. На месте в прошлом функционально активной клетки формируется соединительная ткань. Апоптоз (греч. аро - отделение + ptosis - падение) по морфологическим признакам существенно отличается от некроза и имеет ряд специфических особенностей. Факторами, инициирующими апоптоз, являются возрастание экспрессии генов - индукторов апоптоза (или угнетение генов-ингибиторов) либо повышенное поступление кальция внутрь клетки. Клеточная мембрана при этом остается сохранной. Несмотря на внешнюю сохранность мембраны митохондрий, нарушаются окислительно-восстановительные процессы в основном за счет блокирования 1 митохондриального комплекса. Результатом описанных выше процессов является возрастание синтеза протеаз, которые начинают постепенно расщеплять внутриклеточные структуры. От мембраны клетки отщемляются небольшие везикулы, наполненные содержимым цитоплазмы (митохондрий, рибосомы и др.), окруженные мембранным липидным бис(оем. Клетка соответственно уменьшается в объеме и сморщивается. Отщепившиеся везикулы поглощаются соседними клетками. Ядро сморщивается на завершающих стадиях процесса, хроматин частично конденсируется, что говорит о сохранной активности ряда участков ДНК. Оставшиеся от клетки элементы фагоцитируются тканевыми макрофагами без развития воспалительной реакции и формирования соединительной ткани. Конечное дифференцирование, по мнению ряда авторов, является, по-видимому, одной из форм апоптоза. Основные отличительные черты некроза и апоптоза
Биологическое значение апоптоза Результатом апоптоза является постепенное и медленное избавление от "ненужных" в функциональном отношении на данный момент клеток. При этом не развивается воспаление и не нарушается нормальное функционирование соседних клеток, а также не происходит соединительнотканного замещения, что позволяет сохранить структуру органа. Функциональные элементы клетки, находящейся в состоянии апоптоза, не разрушаются, а поглощаются другими клетками и могут использоваться дальше. Особенно большую роль апоптоз играет в эмбриогенезе, когда важно постепенно избавляться от выполнивших свою функцию клеток, а активное фагоцитирование с развитием реакции воспаления может нарушить созревание плода. Апоптоз активно включается в развитие той или иной морфофункциональной системы организма. Наиболее ярко это можно продемонстрировать на примере созревания иммунной системы. На начальном этапе все иммунокомпетентные клетки проходят "обучение" в тимусе и лимфатических узлах, при этом каждый клон клеток приобретает способность распознавать определенный антиген. В ходе этого процесса возможно "патологическое научение" с последующим распознаванием как чужеродных антигенов своего организма и формированием иммунного ответа на них. В данном случае апоптоз является защитным механизмом, уничтожающим ставшие опасными клетки. В то же время лимфоцитарные клоны, распознающие антигены, не встречающиеся в течение жизни человека, не имеют функционального значения и апоптозируют. Апоптоз необходим также для элиминации клеток, выполнивших на определенном этапе развития свое функциональное значение и ставших ненужными. Помимо этого, апоптоз активно включается в процессы уничтожения клеток, подвергшихся мутации; в большей степени это относится к активно делящимся тканям (кроветворная, лимфатическая система и др.). Реактивность организма, ее роль в патологии. Характеристика основных видов реактивности. Факторы, определяющие неспецифический и специфический типы реактивности. Понятие о саногенезе. Факторы, определяющие общую неспецифическую реактивность в детском возрасте. Реактивность - эта свойство организма реагировать определенным образом на воздействие окружающей среды [Сиротинин Н. Н., 1966]. Она является таким же свойством организма, как рост, размножение, питание, обмен веществ [Адо А. Д., 1980]. Реактивность формируется в процессе эволюции, в фило- и онтогенезе. Она отражает видовые, групповые и индивидуальные особенности реагирования. Реактивность — одна из основных форм связи и взаимодействия организма как единой системы со средой, главным образом защитного, приспособительного характера. Первоначальные представления о реактивности возникли еще у врачей древних исторических эпох, отмечавших, что разные люди болеют неодинаково. Однако понятие "реактивность" возникло лишь к началу XX века, когда патологи стали выделять различные типы реагирования организма. Учение о реактивности с позиций общей патологии возникло и разрабатывалось в нашей стране и является достижением отечественных патологов. Большую роль в решении этой проблемы сыграли сравнительно-патологические исследованиям. И. Мечникова о фагоцитозе и его участии в воспалении и иммунитете; работы Н. Н. Сиротинина, установившего общие закономерности эволюции реактивности в фило- и онтогенезе; представления А. А. Богомольца, связавшего конституцию и реактивность со свойствами соединительной ткани. Понятие реактивности прочно вошло в практическую медицину, способствуя более правильной оценке состояния больного. Реактивность организма является одним из важных факторов патогенеза болезней, поскольку патологическая реактивность характеризуется понижением приспособительных возможностей организма. Любой патологический процесс в той или иной степени меняет реактивность организма, и в то же время изменение реактивности, превысившее физиологические границы, может стать основой развития заболевания В связи с этим изучение реактивности и ее механизмов имеет важное значение для понимания патогенеза заболеваний и целенаправленннго их лечения. В клинике внутренних и инфекционных болезней различают гиперэргическое и гипоэргическое течение пневмонии, туберкулеза, дизентерии и других заболеваний. Гиперэргическими называют болезни с быстрым и интенсивным течением, выраженными изменениями в деятельности органов и систем. Под гипоэргическими понимают заболевания с вялым течением, стертыми симптомами, низким уровнем антителообразования и фагоцитоза. Виды реактивности. Наиболее общей формой реактивности является биологическая, или видовая реактивность, которая определяется прежде всего наследственными факторами и выражает способность всех представителей данного вида реагировать на различные воздействия окружающей среды (токсины, гипоксию, радиальное ускорение и др.) однотипными изменениями жизнедеятельности, как правило, защитно-приспособительного характера. Ее также называют первичной. Видовые особенности реактивности определяют видовой иммунитет к инфекционным заболеваниям. Так, видовым иммунитетом объясняется невосприимчивость человека к возбудителям чумы рогатого скота. Примером видовых изменений реактивности является зимняя спячка животных, сезонная миграция рыб и птиц. При зимней спячке, характеризующейся глубоким угнетением активности нервной, эндокринной систем, обмена веществ и снижением в связи с этим температуры тела (до 3 — 4°С в прямой кишке), значительно снижается реактивность ко многим факторам. Суслики, зараженные в период спячки чумой, туберкулезом, не болеют. Спячка повышает устойчивость к стрихнину и другим ядам. На основе видовой реактивности формируется групповая и индивидуальная. Групповой реактивностью обладают люди, сходные по каким-либо наследственно-конституциональным особенностям. Например, по конституциональному типу, группе крови, лейкоцитарным антигенам и др. Известно, что люди с I группой крови чаще болеют язвенной болезнью желудка, а имеющие антиген HLA-B8 — сахарным диабетом. Индивидуальная реактивность обусловлена наследственными и приобретенными факторами. Она зависит от тех условий внешней среды, в которых организм развивается, — характера питания, климатического пояса, содержания кислорода в атмосферном воздухе и т. д. Реактивность зависит от пола. В женском организме реактивность меняется в связи с менструальным циклом, беременностью. Женский организм более устойчив к гипоксии, кровопотере, радиальному ускорению, голоданию. Известна роль возраста в реактивности. Ранний детский возраст характеризуется простыми формами реагирования и, как правило, низкой реактивностью. Это определяется неполным развитием нервной, эндокринной и иммунной систем, несовершенством внешних и внутренних барьеров. Более сложная и в большинстве случаев высокая реактивность наблюдается в зрелом возрасте, постепенно снижаясь к старости. Лица старческого возраста очень восприимчивы к инфекции, у них часто развиваются воспалительные процессы в легких, гнойничковые поражения кожи, слизистых оболочек. Причина этого заключается в ослаблении иммунных реакций и снижении барьерных функций старого организма. Индивидуальная реактивность может быть специфической и неспецифической. Специфическая реактивность выражается в способности образовывать антитела на антигенные раздражения. Таким требованиям удовлетворяет иммунная реактивность. Она обеспечивает невосприимчивость к инфекционным болезням, или иммунитет в собственном смысле слова, реакции биологической несовместимости тканей, повышенной чувствительности. Неспецифическая реактивность проявляется при действии на организм различных факторов внешней среды. Она реализуется с помощью таких механизмов, как стресс, изменение функционального состояния нервной системы, парабиоз, фагоцитоз, биологические барьеры и др. Специфическая и неспецифическая реактивность может быть физиологической и патологической. Физиологическая реактивность охватывает реакции здорового организма в благоприятных условиях существования. Примером может служить иммунитет (специфическая реактивность), реакция организма на действие различных факторов внешней среды в пределах, не нарушающих гомеостаза (неспецифическая реактивность). Патологическая реактивность проявляется при воздействии на организм болезнетворных факторов. Примером специфической патологической реактивности являются аллергия, иммунодефицитные и иммунодепрессивные состояния. Проявлением неспецифической патологической реактивности является изменение реактивности при травматическом шоке, наркозе. При шоке угнетается реактивность по отношению к инфекционным и другим болезнетворным воздействиям. Угнетается фагоцитоз, меняется чувствительность к лекарственным препаратам. По формам проявления различают повышенную (гиперэргия), пониженную (гипоэргия)и извращенную (дизэргия) реактивность. Реактивность на различных уровнях организации живых систем. Реактивность, формируясь на основе наследственности, конституционального типа, определенного уровня развития нервной, эндокринной и иммунной системы, является свойством организма как целостной системы и в то же время о реактивности можно судить на различных уровнях организации этой системы, начиная с субклеточного. Примером реактивности на молекулярном уровне служит реакция молекулы HbS при серповидно-клеточной анемии на гипоксию, результатом которой является изменение растворимости гемоглобина и образование кристаллов, повреждающих эритроциты. Клеточная реактивность связана с мембранными процессами, обеспечивающими взаимодействие клетки с окружающей ее средой посредством встроенных в нее белковых структур, выполняющих функцию клеточных рецепторов и ионных каналов. Реактивность на клеточном уровне наблюдается при осуществлении лейкоцитами фагоцитоза, при дегрануляции тучных клеток комплексом антиген—антитело. Реактивность органа проявляется, например, в спазме гладкомышечных органов в ответ на повторное поступление в организм аллергена. Примером реактивности системы органов и организма в целом служит перестройка терморегуляции и основных жизнеобеспечивающих систем в ответ на действие пирогена. В развитии многих патологических процессов (аллергия, воспаление) можно проследить изменения реактивности на различных уровнях. Саногенез Термин саногенез, происходящий от лат. sanitas (здоровье) и греч. genesis (происхождение) и означающий буквально «происхождение здоровья», - один из самых молодых в патофизиологической науке. Учение о саногенезе берет свое начало с 1966 г., когда определение этого понятия было сформулировано профессором С. М. Павленко. Саногенез - это динамический комплекс защитно-приспособительных механизмов физиологического и патофизиологического характера, развивающийся в результате воздействия на организм чрезвычайного раздражителя, функционирующий на протяжении всего патологического процесса (от предболезни до выздоровления) и направленный на восстановление нарушенной саморегуляции организма. Хотя это определение на первый взгляд несколько громоздко, каждая его часть имеет принципиальное значение для понимания термина саногенез. Саногенез - динамический комплекс механизмов. В этой части определения подчеркивается, что саногенетические механизмы не являются чем-то неизменным. Они меняются на протяжении патологического процесса. Если вредоносный агент еще не проник во внутреннюю среду организма, механизмы саногенеза будут препятствовать его проникновению; если агент уже проник в организм, то они будут стремиться вывести его или разрушить; если патогенный раздражитель уже вызвал в организме какие-либо «поломы», то саногенетические механизмы направляются на компенсацию или восстановление утраченной функции. Другими словами, саногенез - это постоянно меняющийся (т.е. динамический) комплекс защитно-приспособительных механизмов. Саногенез - комплекс механизмов физиологического и патофизиологического характера. Здесь подчеркивается тот факт, что в саногенезе принимают участие не только механизмы, сформировавшиеся в процессе заболевания, но и физиологические реакции, имеющие место в интактном организме и лишь при воздействии патогенного фактора начинающие играть роль саногенетических. Саногенез развивается при воздействии на организм чрезвычайного раздражителя, то есть только тогда, когда возникает (или может возникнуть) болезнь. В организме в норме имеется ряд механизмов, которые несут определенную функцию (обеспечивают экскрецию, выделение и т.д.). В нормальном организме они не выполняют никаких защитных функций и лишь при воздействии на организм чрезвычайного раздражителя превращаются в саногенетические. Саногенез - это комплекс механизмов, действующих на всем протяжении патологического процесса (от предболезни до выздоровления).Характерной чертой саногенетических сил является то, что их механизмы начинают функционировать в тот момент, когда на организм подействовал чрезвычайный раздражитель и заканчивают свою функцию лишь тогда, когда организм выздоровел. Другими словами, саногенез и патогенез - это два параллельно протекающих, тесно связанных между собой, но противоположных по своей биологической направленности процесса. Саногенез направлен на восстановление нарушенной саморегуляции организма. Саморегуляция организма - это его способность перестраивать свои функции с целью приспособления к меняющимся условиям среды. При патологии эта способность организма к адекватной саморегуляции нарушается, то есть организм не может полностью приспосабливаться к изменениям среды. Весь комплекс саногенетических реакций и направлен на восстановление этих нарушенных саморегуляторных связей. Классификация саногенетических механизмов представлена на схеме. 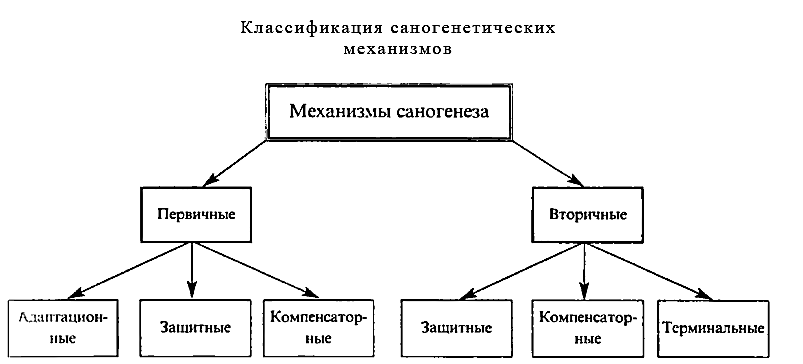 Прежде всего саногенетические механизмы подразделяются на первичные и вторичные. Отличие этих двух групп друг от друга сводится к следующему. Первичные (физиологические) механизмы саногенеза существуют в здоровом организме и лишь при воздействии на организм чрезвычайного раздражителя начинают играть роль саногенетических. Вторичные (патофизиологические) саногенетические механизмы возникают в организме в процессе развития патологии, то есть формируются на основе возникших в организме «поломов». Общий адаптационный синдром. Роль стресс-реализующих и стресс-лимитирующих факторов. Болезни адаптации. Вклад Г. Селье в учение о стрессе. Стресс и дистресс у детей. Стресс и общий адаптационный синдром Одним из достижений современной медицины является раскрытие важной роли эндокринных желез, в частности системы гипофиз — корковое вещество надпочечных желез, в адаптации организма к действию патогенных факторов. Широкую известность приобрела теория канадского ученого Ганса Селье о стрессе. Термином "стресс" (от англ. stress — напряжение) обозначают неспецифическую реакцию организма, возникающую под влиянием любых сильных воздействий (стрессоров) и сопровождающуюся перестройкой защитных систем организма. Селье обратил внимание на то, что, несмотря на разнообразие стрессоров (травма, инфекция, переохлаждение, интоксикация, наркоз, мышечная нагрузка, сильные эмоции и т. д.), все они приводят к однотипным изменениям в вилочковой, надпочечных железах, в лимфатических узлах, составе крови и обмене веществ. В опытах на крысах он наблюдал типичную триаду, которая включает гипертрофию коркового вещества надпочечных желез, инволюцию вилочково-лимфатического аппарата и геморрагические язвы на слизистой оболочке желудка и двенадцатиперстной кишки. Стресс проявляется в виде общего адаптационного синдрома, который состоит из трех последовательных стадий: реакции тревоги, стадии резистентности и стадии истощения. Реакция тревоги означает немедленную мобилизацию защитных сил организма. Она состоит из фазы шока и противошока. Вфазе шока наблюдаются гипотония мышц и артериальная гипотензия, гипотермия, гипогликемия, сгущение крови, эозинопения, повышение проницаемости капиллярных сосудов. Инволюция лимфоидной ткани, отрицательный азотистый баланс, язвенные поражения желудка свидетельствуют о преобладании процессов катаболизма. Фаза противошокахарактеризуется изменениями в обратном направлении (повышение артериального давления, мышечного тонуса, содержания глюкозы в крови), ведущими к развитию следующей стадии — стадии резистентности. Основное патогенетическое звено фазы противошока — это стойкое усиление секреции кортикотропина и кортикостероидов. В стадии резистентности гипертрофируется корковое вещество надпочечных желез и секретируется большое количество гормонов, активизируются анаболические процессы, усиливается гликонеогенез. Защитные реакции организма, обусловливающие возможность жизни при стрессе, Селье назвал синтоксическими. При длительном действии повреждающего агента адаптация нарушается. Истощение функциональных резервов и атрофия коркового вещества надпочечных желез, снижение артериального давления, распад белковых веществ характеризуют переход стадии резистентности в стадию истощения (дистресс). Исход стресса зависит от соотношения силы и длительности действия стрессора и потенциальных возможностей защитных сил организма. Биологическое значение адаптационного синдрома заключается не только в том, что во второй, наиболее длительной его стадии повышается резистентность организма поотношению к фактору, вызвавшему состояние стресса, но и в том, что при не очень сильном и длительном стрессе может создаваться или повышаться неспецифическая резистентность" организма к различным другим факторам. Она проявляется в повышенной выживаемости после воздействия летальных агентов или же в уменьшении воспаления, предупреждении гиперэргических реакций, поражении сердца, почек и других органов, возникающих под влиянием патогенных факторов. Например, кровопусканием (стрессор) можно ослабить воспаление, вызванное внутрикожным введением формалина. Мышечное напряжение или травма защищает животное от некроза в миокарде, вызываемого внутривенной инъекцией протеолитических ферментов. Кортикотропин и кортикостероиды играют в формировании неспецифической резистентности ведущую роль, поэтому их называют адаптивными гормонами (рис. 24.8). Систематическое воздействие на организм слабых и умеренных раздражителей (например, холодный душ, физические упражнения) поддерживает готовность эндокринной системы к адаптивным реакциям. Недостаточность адаптации или ее отклонения в противоположную сторону являются, по Селье, причиной развития болезней адаптации. Экспериментальное подтверждение этого положения состоит в возникновении гипертензии, нефросклероза, гиалиноза органов, усилении воспалительных реакций после введения больших доз дезоксикортикостерона, который обладает провоспалительными свойствами. Введение животным гликокортикоидов (противовоспалительные гормоны) тормозит воспаление, но в то же время подавляет иммунные реакции, вызывает язвенное поражение желудка и двенадцатиперстной кишки, создает условия для возникновения некроза миокарда. Недостаточность секреции гликокортикоидов способствует гиперэргическому течению иммунных процессов, снижает устойчивость к болезнетворным воздействиям. К болезням адаптации Селье относит ревматизм, бронхиальную астму, некоторые болезни почек, сердца и сосудов, ряд кожных и других заболеваний. В их возникновении большое значение придается кондициональным (обусловливающим) факторам. Этими факторами могут быть переохлаждение, перегревание, физическое переутомление, отягощенная наследственность, избыточное потребление поваренной соли. Совместное введение кортикостероидов и натрия хлорида создает фон, на котором различные раздражители вызывают некротические изменения в сердечной мышце. Теория Г. Селье возникла на основе изучения эндокринных механизмов приспособительных реакций организма. Между тем еще раньше трудами У. Кеннона, Л. А. Орбели и их учеников было создано учение об адаптационно-трофической роли симпатической части вегетативной нервной системы в защитно-компенсаторных реакциях. Некоторые проявления стресса (появление язв) наблюдаются у гипофизэктомированных животных. Следовательно, невозможно сводить все разнообразие этих проявлений к одной только гормональной перестройке. Стресс является сложной нервно-гуморальной реакцией, в развитии которой принимают участие нервная система и эндокринные железы. Вместе с тем следует подчеркнуть, что теория Г. Селье оказала и продолжает оказывать большое влияние на развитие медицины. Она дала теоретическое обоснование кортикостероидной терапии. На основе этой теории разработан новый подход к проблеме старения, получила объяснение неспецифическая терапия (кровопускание, аутогемотерапия, иглоукалывание). Основные положения этой теории успешно разрабатываются и в настоящее время. Наследственные болезни. Этиология, патогенез. Методы изучения наследственной патологии. Наследственные болезни В зависимости от размеров повреждения наследственного аппарата половых клеток (генная или хромосомная мутация) различают молекулярно-генетические и хромосомные болезни. По типу наследования — доминантные, рецессивные, сцепленные с полом и полигенные. Молекулярно-генетические болезни. Поскольку генная мутация по сравнению с хромосомной затрагивает сравнительно небольшой участок генетического материала, то обычно сопровождается менее грубыми нарушениями. Репродуктивная функция носителя при этом сохраняется, и поэтому такие заболевания чаще передаются в поколениях, т. е. являются наследственными в полном смысле слова. По доминантному типу наследуются различные скелетные и другие аномалии, не препятствующие размножению, не сокращающие продолжительность жизни и поэтому мало подверженные отбору. Такими аномалиями могут быть короткопалость, многопалость, сросшиеся и искривленные пальцы, искривление ногтей, отсутствие боковых резцов, близорукость, дальнозоркость, астигматизм. Из тяжелых болезней по доминантному типу! передаются врожденная катаракта, отосклероз, некоторые формы мышечной атрофии, прогрессирующая хорея Гетингтона, ахондроплазия, характеризующаяся карликовым ростом и непропорциональным сложением тела. К наиболее опасным болезням этой группы можно отнести множественный полипоз толстой кишки, имеющий тенденцию к злокачественному перерождению, и нейрофиброматоз (болезнь Реклингхаузена). Некоторые болезни передаются по типу неполного доминирования. Типичным примером является серповидно-клеточная анемия. Ген, ответственный за передачу серповидно-клеточности эритроцитов, является доминантным, т. е. изменение эритроцитов проявляет себя в гетерозиготе, но в связи с тем, что при этом наряду с HbS синтезируется и нормальный НbА, такие больные могут и не знать о наличии у них патологического гемоглобина. Только при гипоксии (например, высотной, под наркозом) заболевание может проявиться распадом эритроцитов. В гомозиготном состоянии ген HbS проявляет себя резкой анемией уже при рождении ребенка, что обычно заканчивается смертью. Большинство наследственных болезней передается по рецессивному типу. Болезнь проявляется тогда, когда дети получают патологический ген от обоих родителей. Сами же родители, являясь гетерозиготными носителями признака, остаются фенотипически здоровыми. Большое значение для проявления этих болезней у потомства имеет кровное родство родителей, имеющих большую вероятность обладания одинаковым рецессивным патологическим геном. К этой группе болезней относятся дефекты аминокислотного обмена (фенилкетонурия, альбинизм, алкаптонурия), врожденная глухонемота, микроцефалия, пигментный ретинит и др. По такому же типу наследуются ферментопатии. На примере наследственных аномалий обмена веществ можно проследить чрезвычайно важное в клиническом отношении обстоятельство. Как правило, у гетерозиготных носителей рецессивного признака заболевание клинически не проявляется. Однако если- у них усилить нагрузку на соответствующее звено ферментативных процессов, то можно обнаружить его повышенную ранимость. Наследование, сцепленное с половой хромосомой, проявляется у человека около 60 патологическими наследственными признаками, связанными с Х-хромосомой. Большинство из них рецессивны. Это значит, что в более выгодном положении находятся женщины, у которых наличие Х-хромосомы с патологическим геном компенсируется наличием второй нормальной Х-хромосомы. Следовательно, болезнь проявляется только у мужчин, в то время как женщины остаются здоровыми, являясь, однако, носительницами этого признака (могут передавать его своему мужскому потомству). По такому типу передается гемофилия (не синтезируется антигемофильный глобулин), дальтонизм (красно-зеленая слепота), атрофия зрительных нервов, юношеская глаукома, гемералопия (отсутствие сумеречного зрения). Ген гипофосфатемического рахита, не поддающегося лечению эргокальциферолом (витамином Д2), сцеплен с X-хромосомой, но в отличие от гемофилии и дальтонизма (когда патологический ген рецессивен) является доминантным, т. е. проявляется как у мужчин, так и у женщин в гетерозиготном состоянии. Полигенное наследование. Большинство признаков в организме определяется не одним, а многими генами, причем их аддитивное (дополняющее) действие не зависит от того, аллельны они или нет, сцеплены или нет, доминантны или рецессивны. Установление физиологического гомеостаза в этих случаях в значительной степени зависит от внешних условий. Когда говорят о роли наследственной предрасположенности в патогенезе таких заболеваний, как гипертоническая болезнь, язвенная болезнь, бронхиальная астма, сахарный диабет, атеросклероз, то надо иметь в виду, что они наследуются полигенно. При этих заболеваниях количественные показатели гомеостаза определяются как генетическими факторами, так и факторами среды, причем существует порог, за пределами которого гомеостаз легко нарушается. Хромосомные болезни. В отличие от генных хромосомные мутации в половой клетке обычно резко нарушают ее жизнеспособность и она гибнет. В случае, если жизнеспособность половой клетки сохранена и она участвует в оплодотворении, плод может погибнуть на разных этапах своего развития. Если, однако, хромосомный дисбаланс совместим с постнатальным существованием, то у такого ребенка обычно нарушено соматическое и психическое развитие, а способность воспроизводить потомство отсутствует. В тех редких случаях, когда репродуктивная функция все же сохраняется (3 — 5 %), потомство наследует ту же хромосомную аномалию. Описана семейная тенденция к нерасхождению хромосом. Есть все же в литературе сообщения о том, что и хромосомные перестройки могут быть сбалансированными, а клинические проявления — незначительными. Описано около 300 хромосомных синдромов. Некоторые из них изучены довольно подробно. Синдром Дауна. Изучение кариотипа показало наличие трисомии по 21-й хромосоме. Общее число хромосом 47. Но может быть и 46, что означает, что лишняя 21-я хромосома слилась с одной из крупных, например 15-й. При этом наблюдаются: умственная отсталость, характерная внешность — низкий рост, короткопалые руки и ноги, монголоидный разрез глаз, задержка физического развития, аномалии внутренних органов, особенно сердца. Синдром Дауна встречается относительно часто — один случай на 500 — 600 родов. Женщины с болезнью Дауна иногда имеют детей. Поскольку это доминантный признак, 50 % детей, родившихся от таких матерей, здоровы, а 50 % страдают той же болезнью. Синдром Клайнфелтера. Заболевание встречается у мужчин, частота его 1 : 1000. Общее число хромосом 47 (кариотип XXY), но встречается 48 (кариотип XXXY) и 49 хромосом (кариотип XXXXY) (рис. 4.1, а). Наружные половые органы сформированы по мужскому типу. Характерны высокий рост, астеническое телосложение, длинные ноги, снижение сперматогенеза. Как и для других хромосомных болезней, свойственна умственная отсталость. В соматических клетках обнаруживается половой хроматин (тельца Барра) в количестве, равном числу Х-хромосом минус 1. Синдром Шерешевского—Тернера. Синдром развивается тогда, когда в женском организме вместо двух половых хромосом (XX) имеется одна Х-хромосома. Общее число хромосом 45 (кариотип 45, ХО). Наружные половые органы сформированы по женскому типу. Характерны низкий рост, широкая щитоподобная грудная клетка, недостаточное физическое и половое развитие. Внутренние половые органы недоразвиты, яичники представлены фиброзными тяжами. В клетках слизистой оболочки рта отсутствует половой хроматин, что помогает поставить диагноз. Трисомия по Х-хромосоме (кариотип XXX). В неделящихся клетках- видны два тельца Барра. У больных женщин наблюдается недоразвитие яичников, но менструальный цикл не всегда нарушен, бесплодие наблюдается не всегда. Носители хромосомного набора типа У0 гибнут на ранних стадиях внутриутробного развития. Изучение хромосомных аномалий приводит к заключению, что дефицит аутосом, по-видимому, более опасен, чем их избыток, так как случаи моносомии по какой-нибудь аутосоме пока не описаны. Не описаны трисомии по самым крупным аутосомам. Возможно, такая передозировка наследственной информации тоже смертельна. Наблюдались все же случаи трисомии по 13 — 15-м парам хромосом. При этом отмечались дефекты со стороны глаз и сердца. |
