транс.почка 2. Введение 1 Топография почки 2 Методы исследования 3 Мочекаменная болезнь(мкб) 5
 Скачать 366.54 Kb. Скачать 366.54 Kb.
|
ОглавлениеВведение 1 Топография почки 2 Методы исследования 3 Мочекаменная болезнь(МКБ) 5 Хроническая почечная недостаточность(ХПН) 5 Гемодиализ (искусственная почка) 8 Пересадка почки 11 Операция нефрэктомии у живого донора и трансплантации почки 12 Принципы ведения ближайшего послеоперационного периода 13 Иммуносупрессия при трансплантации почки. 14 ВведениеПОЧКИ (лат. ren) — парные органы бобовидной формы, располагаются вне брюшной полости, позади нее, в поясничной области, по обе стороны от позвоночника. Каждая почка достигает в длину около 12 см, в ширину 5—6 см, в толщину 3—4 см. Масса одной почки приблизительно 150 г. Правая почка в норме расположена несколько ниже, поскольку сверху она граничит с печенью. Почки выполняют в организме очень важные функции: — регулируют артериальное давление крови; — поддерживают водный и солевой баланс; — стимулируют кроветворения; вырабатывают эритропоэтин — вещество, которое стимулирует образование новых красных клеток крови эритроцитов, вырабатывают ангиотензин — гормон, который поднимает давление крови, суживая кровеносные сосуды и также побуждает надпочечники производить другой гормон — альдостерон, важный регулятор выведения натрия. Почки вырабатывают простагландины, вещества, которые помогают регулировать давление крови, выделение натрия и другие стороны обмена веществ; — участвуют в обмене веществ в костях скелета, переводят витамин Д в особую активную форму и это вещество управляет процессами, происходящими в костях скелета. Нормальная работа почек положительным образом сказывается на плотности и прочности костей; — очищают организм от токсичных отходов и удаляют избыточную жидкость; — поддерживают постоянство внутренней среды организма: регулируют содержания солей, кислот, питательных веществ и многих других элементов. В процессе обмена веществ в организме разрушаются и возникают разные соединения, как полезные, так и вредные, «отходы» обмена веществ. Постоянно, 24 часа в сутки кровь очищается почками от вредных соединений, накапливающихся в теле человека. В почках этим занимаются нефроны, у здорового человека в каждой почке находится около 1,2 миллиона нефронов. Работая вместе, они производят около 1,5—2,0 литров мочи в сутки, успевая профильтровать при этом около 200 литров крови. Нефроны — это очень тонкие и точные устройства и гибель их в результате болезни является невосполнимой утратой — погибшие нефроны никогда уже больше не восстанавливают свою работу. Трансплантация почки является наиболее эффективным видом заместительной почечной терапии, в том числе и потому, что она замещает все функции почки, тогда как диализа отчасти компенсирует только выделительную функцию почек, а для замещения других функций почки необходимо применение лекарственных средств (эритропоэтина, метаболитов витамина Д и т.д.). Человек — что маленький, но высокотехнологичный завод. Много потребляет — ест, пьет, дышит. Вырабатывает, в основном, одну продукцию — энергию. Отходы — известным нам всем способом, выбрасывает. Вот ведь какая вещь эта — почка. Небольшая, с кулачок, а замену ему люди до сих пор не могут сконструировать. Хотя искусственные сердца, говорят, уже вставляют. А гемодиализный аппарат /«искусственная почка»/ до сих пор напоминает бензоколонку и требует целой инфраструктуры — специальные растворы диализаты и огромные системы очистки воды, занимающие целые помещения. Топография почкиГолотопия почек: располагается в поясничной области, в забрюшинном пространстве. Скелетотопия почек: Левая почка-ThXI– LIII Правая почка.- ThXIl– LIV(ниже левый, из-за давления печени сверху.) Синтопия почек: сзади почка прилежит к поясничной части диафрагмы, квадратной мышце поясницы и большой поясничной мышце, которые образуют почечное ложе; со стороны брюшной полости – к правой доле печени, восходящей ободочной кишке и нисходящей части двенадцатиперстной кишки – правая почка; передняя поверхность левой почки прикрыта желудком, хвостом поджелудочной железы, селезеночной кривизной ободочной кишки, петлями тонкого кишечника; к верхним полюсам обеих почек прилегают надпочечники. Функционирующий аппарат почки. Почечные ложе: диафрагма, квадратная мышца поясницы, поперечная мышца живота, запятая, большая поясничная мышца. Почечная ножка: Входят : почечная артерия и нервы Выходят : почечная вена, мочеточник, лимфатические сосуды. Почечная фасция. Жировая капсула. Внутрибрюшное давление Сегменты почек. 1) верхний сегмент — соответствует верхнему полюсу почки; 2, 3) верхний и нижний передние — расположены спереди лоханки; 4) нижний сегмент — соответствует нижнему полюсу почки; 5) задний сегмент — занимает две средние четверти задней половины органа между верхним и нижним сегментами. Оболочки почек. Фиброзная капсула-покрывают паренхимы почек. Жировая капсула-располагается кнаружи от фибринозный капсулы. Почечная фасция-располагается кнаружи от жировой капсулы, состоит из 2 листков – предпочечного и позадипочечного. Внутреннее строение почки. Поверхностный слой-корковое вещество cortex renalis. Между мозговым веществом-почечные столбы columnae renales. Лучистая часть pars radiata-светлые участки, здесь располагаются прямые канальцы. Свёрнутая часть pars convoluta-тёмные участки, здесь находится почечные тельца, проксимальный и дистальный, извитые канальцы. Структурно-функциональный и цепочки является нефроном. Накануне сдачи анализов в моче рекомендуется избегать приёма алкоголя; острой и солёной пищи; пищевых продуктов изменяющий цвет мочи; сдачи анализов во время менструации Методы исследованияКоличественные методы назначают при отсутствии патологическая лейкоцитурии и эритроцитурии (метод Нечипоренко, Амбурже, Каковского-Аддиса) 1). Проба по Нечипоренко. 1.Проводится туалет наружных половых органов. 2.Используется средняя порция 1 утренней мочи. 3.Оценивается экскреция в 1 миллилитр. У человека в норме 1 мл. мочи лейкоцитов до 2000 у мужчин и до 4000 у женщин, эритроцитов до 1000, Цилиндров до 20. 2). Проба по Амбурже. Специальная подготовка: ограничивают приём жидкости днём и исключает ночью. Сбор мочи проводится только утром! 1.Проводится туалет наружных половых органов. 2. После опорожнения мочевого пузыря( например, в 5 часов утра),моча собирается через 3 часа(в 8 часов утра) 3. Оценивается экскреция за 1 минуту. У человека в норме лейкоцитов до 2000, у мужчин до 4000, у женщин, эритроцитов до 1000, цилиндров до 20. 3). Проба Аддиса-Каковского Специальная подготовка: за сутки до исследования ограничивает приём жидкости, может назначаться мясная диета. Проводится туалет наружных половых органов. После опорожнения мочевого пузыря моча собирается в течение суток. Оценивается экскреция за сутки. У человека в норме лейкоцитов до 2000000, эритроцитов до 1000000, цилиндров до 2000. 4). Проба по Земницкому 1. Проводится туалет наружных половых органов. 2. После утреннего опорожнения мочевого пузыря собирается в восьмичасовых порций мочи в течении суток. 3. Определяется количество мочи каждой порции, оценка фильтрационной функции почек. 4. Определяется удельный вес каждой порции, оценка концентрационный функции почек. 5. Проводится оценка общего диуреза, дневной диурез + ночной диурез. 5). Проба Реберга-Тареева. =СКФ(скорость клубочковой фильтрации) = КЛИРЕНС ЭНДОГЕННОГО КРЕАТИНИНА Проводится туалет наружных половых органов. Моча собирается в течение суток. Первая утренняя порция удаляется, все предыдущие собираются в 1 ёмкость, которая хранится в холодильнике( + 4 -+ 8.) Заверши сбор, изменяется суточный объем моча перемешивается и отливается в стерильную баночку. В лабораторию доставляется только нужное количество мочи. Указывается общий диурез в мл, рост и m тело. Берётся кровь из вены. Определяется концентрация Креатинин в сыворотке крови и в моче. Мочекаменная болезнь(МКБ)Мочекаменная болезнь(МКБ)-это урологическое заболевание, проявляющееся формированием камней в различных отделах мочевыделительной системы, чаще всего в почках и мочевом пузыре. Что происходит: Нарушение функции почек; Нарушение АД; 50 мл. В час , при норме 1200; Удельный вес мочи.-1010-1020; Цвет соломино– жёлтый. Хроническая почечная недостаточность(ХПН)Хроническая почечная недостаточность(ХПН) -симптомыкомплекс, развивающийся при хронических двухсторонних заболевания почек вследствие постепенно необратимо гибели нефронов и характеризующийся нарушением гомеопатической функции почек. Хронической почечной недостаточности связано с прогрессирующей гибелью нефронов — мор фофункциональной единицы почек. Гибель нефронов может быть связана с заболеваниями почек — хроническим гломерулонефритом, поликистозом, пиелонефритом, но чаще ее причиной являются такие заболевания, как сахарный диабет, гипертоническая болезнь, системные заболевания. При снижении массы действующих нефронов до критической величины, развивается почечная недостаточность. Функция почек – сохранять нормальный баланс жидкости и солей в организме, а также выводить из организма продукты обмена белков (азотистые шлаки), образуя мочу. При ХПН очищение крови не происходит в достаточной степени, что со временем может приводить к тяжелым осложнениям. На ранних стадиях хронической почечной недостаточности может не возникать никаких симптомов. Заболевание часто обнаруживается, когда функция почек значительно ухудшается. Очень важно как можно раньше установить диагноз "ХПН", чтобы своевременно начать лечение, которое позволяет замедлить скорость снижения функции почек, так как длительное повреждение почек является необратимым. Без лечения функция почек может критически ухудшаться, что может потребовать проведения процедуры гемодиализа (искусственного очищения крови с помощью аппарата "искусственная почка"). Коды МКБ: N18 Хроническая почечная недостаточность N18.0 Терминальная стадия поражения почек N18.8 Другие проявления хронической почечной недостаточности N18.9 Хроническая почечная недостаточность неуточненная N19 Почечная недостаточность неуточненная Существует пять стадий хронического заболевания почек, которые подразделяются на следующие: Стадия 1 (G1): нормальная СКФ (> 90 мл / мин) с признаками повреждения почек по результатам других тестов Стадия 2 (G2): слегка сниженная СКФ (60-89) Стадия 3a (G3a): умеренное снижение СКФ (45-59) с легким или умеренным снижением функции почек Стадия 3b (G3b): умеренно уменьшенная СКФ (30-44) с умеренным или сильным снижением функции почек Стадия 4 (G4): резко сниженная СКФ (15-29) с выраженным снижением функции почек и очевидными возможными симптомами Стадия 5 (G5): резко сниженная СКФ (<15). Упоминается как почечная недостаточность Лабораторная диагностика. КФ (клубочковая фильтрация) менее 20 мл/мин на 1,73 м² (проба Реберга) креатинин сыворотки более 0,132 ммоль/л мочевина более 8,3 ммоль/л Значение альбумина (общего белка) в моче и их приблизительные эквиваленты [5].
СПУ – суточная протеинурия, МАУ – микроальбуминурия, САК – соотношение альбумин/креатини, СПК – соотношение протеин/креатини. 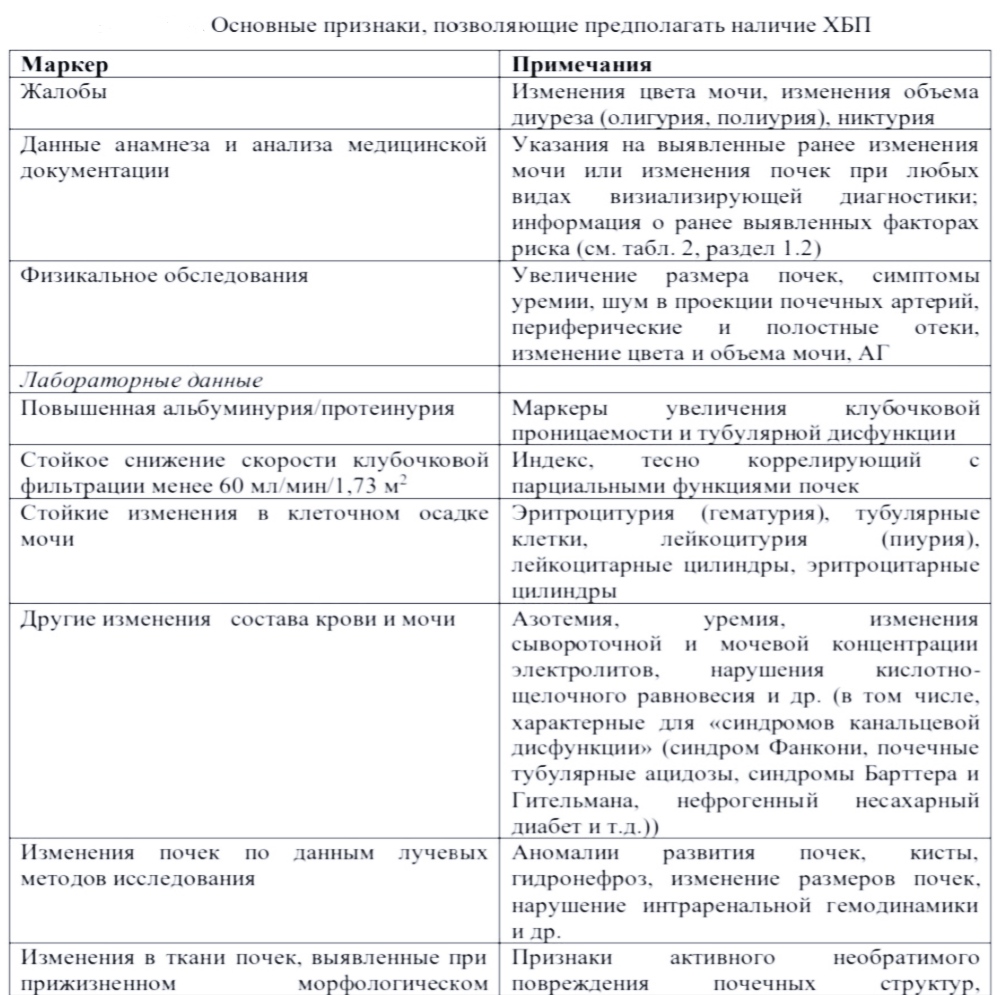 Симптомы Признаки и симптомы почечной недостаточности в течение длительного времени могут не появляться. Симптомы могут быть разнообразными и включать: тошноту, рвоту, потерю аппетита; частые ночные мочеиспускания; усталость, быструю утомляемость; сухость, бледность кожи, стойкий кожный зуд; высокое кровяное давление (гипертония); мышечные подергивания, покалывания в разных частях дела, судороги; кровотечения из желудочно-кишечного тракта, из десен, носа; извращение вкуса; снижение либидо, аменорею (отсутствие менструаций); отеки стоп, лодыжек; снижение интеллектуальной активности Лечение Подразделяется на два вида: Консервативное; Активное. К консервативному лечению относится: Соблюдение диеты – ограничение количества потребляемого белка, ограничение или полный запрет соли; Снижение уровня артериального давления при наличии артериальной гипертензии; Гормонотерапия при аутоиммунных заболеваниях; Мочегонные препараты (Фуросемид, Верошпирон); Эритропоэтин при анемии; Переливание крови при выраженных анемиях; Незаменимые аминокислоты (Кетостерил). К активному лечению относятся: Гемодиализ – выполняется при помощи аппарата «искусственная почка», посредством очищения крови вне организма. Частота проведения около двух-трех раз в неделю. Перитонеальный диализ – осуществляется путем введения раствора в брюшную полость при помощи специального катетера, а затем отсасыванием этой жидкости. Благодаря этому удаляются вредные вещества. Трансплантация почки. К активному лечению прибегают при терминальной форме хронической почечной недостаточности, когда уже неэффективны консервативные методы лечения. Гемодиализ (искусственная почка)Замещение функций жизненно важных органов при помощи искусственных устройств во многих случаях является единственной возможностью спасения жизни пациента при острой патологии или ее продления при патологии хронической. За последние полвека в разработке и внедрении в клиническую практику искусственных органов и систем достигнуты несомненные успехи. Тем не менее большинство современных устройств замещения функций жизненно важных органов далеко от совершенства. В идеальном варианте искусственный орган должен соответствовать следующим основным критериям. 1. Имплантабельность, то есть возможность поместить искусственный аналог на место естественного органа: искусственное сердце — на место естественного, искусственную почку — на место естественной и т. д.; габариты устройства по меньшей мере должны позволять поместить его в организм человека. При этом искусственный орган не должен иметь сообщения с внешней средой для подключения источников питания, приводов и управляющих устройств, поскольку такое сообщение может служить входными воротами для инфекции и соответственно стать причиной серьезных осложнений. 2. Имплантируемый искусственный орган должен иметь конструкцию, обеспечивающую долговечность. Например, искусственное сердце, которое имплантируют молодому пациенту, десятилетиями должно работать надежно, не нуждаясь в замене как целого органа, так и его элементов. 3. В ряде случаев долговечность функционирования искусственных устройств ограничивается бионесовместимостью материалов, из которых они выполнены. Создание искусственных материалов, которые не вызывали бы нежелательных реакций в организме (коагуляции крови, иммунного ответа, воспаления) — немаловажный аспект развития проблемы искусственных органов. 4. Искусственный орган должен максимально полно моделировать все функции своего естественного аналога. Рассматривая устройство и принципы работы искусственной почки — системы гемодиализа, можно убедиться, что она не соответствует ни одному из приведенных критериев «идеальности» искусственного органа. Тем не менее искусственная почка на сегодняшний день является единственной системой, которая даже при полном отсутствии функции естественного аналога позволяет длительно и на достаточно вы соком качественном уровне поддерживать жизнь пациентов. Процесс проникновения веществ через полупроницаемую мембрану под воздействием градиента концентрации и называется диализом. Другой процесс представляет собой фильтрацию жидкой составляющей крови под воздействием градиента гидростатического давления (то есть разности давления в контурах крови и диализирующей жидкости) и называется ультрафильтрацией. При стандартном диализе ультрафильтрация определяет выведение избытка жидкости из организма пациента. Сочетание этих двух процессов — диализа и ультрафильтрации, происходящих на мембране, разделяющей кровь пациента и диализирующую жидкость, и определяет принципы функционирования системы искусственной почки. Стоит отметить, что, хотя в системе гемодиализа обрабатывается кровь пациента, нельзя считать и именовать диализ «очищением крови». В ходе процедуры гемодиализа от веществ, способных проникать через диализную мембрану, очищается вся водная среда организма — внутрисосудистая, внеклеточная и внутриклеточная жидкость. Именно это обстоятельство требует определенной (обычно не менее 4 ч) продолжительности процедуры. Кровь же является переносчиком веществ из организма пациента к мембране. Краткая история развития гемодиализа. Родоначальником диализа считается шотландский химик Томас Грэм (Thomas Graham), основатель коллоидной химии. В середине XIX в. он наблюдал процесс проникновения кристаллоидов (в частности мочевины) через мембрану из перга9 мента и назвал этот процесс диализом. В эксперименте на животных диализ впервые опробовали Джон Джейкоб Абель (John Jacob Abel) с сотрудниками в 1913 г. Устройство представляло собой систему трубочек из нитрата целлюлозы, по которым циркулировала кровь уремичных собак. Снаружи система трубок, заключенная в стеклянный корпус, омывалась физиологическим раствором . Количественное выведение мочевины в эксперименте оказалось достаточным для того, чтобы сделать вывод о возможности лечения подобным методом почечной недостаточности. Первые процедуры диализа в клинической практике проводил в 1924–1928 гг. в Гессене Георг Хаас (Georg Haas). Устройство и функционирование системы гемодиализа. Диализаторы и диализные мембраны. «Сердцем» системы гемодиализа является диализатор, в котором через диализную мембрану происходит массобмен между кровью пациента и диализирующей жидкостью. Диализаторы с плоскими мембранами на сегодняшний день отошли в прошлое. Практически все современные диализаторы представляют собой пучок из 10 000 и более полых волокон (капилляров) диаметром 200 мкм и толщиной стенки 5–40 мкм (в зависимости от материала, из которого они выполнены). Пучок полых волокон заключен в цилиндрический корпус . Во время гемодиализа в просвете полых волокон протекает кровь пациента, а снаружи волокна, заключенные в корпус, омываются диализирующей жидкостью. В зависимости от количества полых волокон и архитектоники диализатора площадь поверхности диализной мембраны может составлять от нескольких десятых квадратного метра — такие устройства используются преимущественно в педиатрической практике — до двух и более квадратных метров. Диализные аппараты. Аппарат для гемодиализа имеет две основные функции: обеспечение эффективной и безопасной перфузии крови пациента через диализатор; подача диализирующей жидкости нужного состава при заданной температуре и при том давлении, которое обеспечит необходимый объем ультрафильтрации в тот же диализатор, но с другой стороны диализной мембраны. Методики, имеющиеся в арсенале программного диализа. Современная диализная аппаратура позволяет, помимо стандартного гемодиализа, применять и другие методики. Как уже упоминалось, стандартный гемодиализ основан на диффузионном переносе веществ сквозь диализную мембрану. Ультрафильтрация при стандартном диализе ограничивается объемом избыточной жидкости, накапливающейся в организме пациента между процедурами, и обычно не превышает 2–3 л. Имеется возможность, не подавая диализирующую жидкость в диализатор, создавать разрежение в диализном контуре и быстро, а главное — управляемо, фильтровать жидкую фракцию крови с растворенными веществами, способными проникнуть через мембрану. Такая процедура называется изолированной ультрафильтрацией и используется при лечении состояния гипергидратации. Для «очищения» организма удаление нескольких литров жидкости значения не имеет, но может оказаться эффективным для устранения рефрактерного к мочегонным средствам отека легких при застойной сердечной недостаточности. Мы уже упоминали, что современные синтетические мембраны отличаются высокой проницаемостью,сопоставимой с проницаемостью естественного гломерулярного фильтра. Поэтому, если через такую мембрану фильтровать из крови пациента большие, сопоставимые с общим количеством воды организма объемы, это окажется практически полной моделью образования первичной мочи в гломерулах естественных почек. Понятно, что огромные, исчисляющиеся десятками литров объемы фильтрата необходимо восполнять. Для этого используются специальные замещающие растворы, по составу идентичные диализирующей жидкости, но стерильные и апирогенные. Такая процедура — гемофильтрация — используется преимущественно для постоянного лечения острой почечной недостаточности, для чего применяется специальная аппаратура и фабричные замещающие растворы, однако это отдельная большая тема. В рамках программного диализного лечения гемофильтрация практически не применяется прежде всего потому, что эта методика не включает собственно диализ — при гемофильтрации нет диффузионного переноса веществ через мембрану, обеспечивающего выведение основной массы низкомолекулярных уремических токсинов. Чтобы не пренебрегать диффузионным переносом, в практике программного диализа используется сочетание диализа и гемофильтрации — гемодиафильтрация. При этом обычный диализ с потоком диализирующей жидкости через диализатор сочетается с фильтрацией объемом до 25 л за процедуру и соответствующим замещением. Раньше для замещения отфильтрованного объема использовали фабричные растворы, что делало гемодиафильтрацию слишком дорогой процедурой в сравнении с диализом. Пересадка почкиПересадка почки - самая частая операция в трансплантологии. Она детально разработана и даёт хорошие результаты. История В эксперименте на животных впервые почку пересадили Каррель и Ульман в 1902 г. В 1934 г. Вороновым была предпринята первая попытка трансплантации трупной почки больной при острой почечной недостаточности, закончившаяся неудачно. В 1953 г. Хьюм выполнил первую успешную пересадку почки от родственного донора. В России в 1965 г. Б.В. Петровский впервые успешно трансплантировал почку от живого донора и от трупа. В настоящее время в России ежегодно пересаживают около 500 почек (в Европе - около 10 000). Показания Показанием к трансплантации почки считают терминальную стадию хронической почечной недостаточности (III стадии), когда необходим постоянный гемодиализ. Причины развития почечной недостаточности могут быть различными: хронический гломерулонефрит, хронический пиелонефрит, поликистоз почек, мочекаменная болезнь с исходом в гидронефроз и т.д. Особенности трансплантации Так как почка - парный орган, возможна пересадка как от живого родственного донора, так и от нежизнеспособного донора. В последнем случае забор почки можно осуществлять при констатации смерти мозга на работающем сердце или сразу после фактической гибели донора и остановки сердца. После забора почка, сохраняемая в растворе Евро-Коллинз при температуре 4-6 ?С, может быть трансплантирована в течение 36 ч. При трансплантации почки проводят подбор донора на основании результатов типирования по антигенам системы HLA, совместимости по AB0 и перекрёстной пробе. После операции назначают традиционную иммуносупрессивную терапию. Трансплантацию почки осуществляют гетеротопически - на подвздошные сосуды . При этом обычно формируют анастомоз с наружными подвздошными артерией и веной по типу «конец в бок» и накладывают неоуретероцистоанастомоз (соустье между мочеточником донорской почки и мочевым пузырём реципиента). Собственные нефункционирующие почки предварительно удаляют лишь в случае развития в них инфекционного процесса (при поликистозе, гидронефрозе). После операции почка начинает функционировать практически сразу, но в некоторых случаях отмечают олигурию, возможны кризы отторжения, в связи с чем проводят сеансы вспомогательного гемодиализа. При отторжении донорской почки возможны повторные пересадки. В течение 1 года функционирует более 85% трансплантированных почек. В течение 2 лет - более 75%. Есть наблюдения за пациентами в течение 20 лет после пересадки почки с сохранением её функций. Несколько советов как сберечь почки: 1.Поменьше сидите, побольше двигайтесь. Только физическая нагрузка способна сни-зить риск болезней не только почек, но и всех органов человека 2.Следите за уровнем сахара в крови. Хронические заболевания почек появляются как минимум у половины людей, страдающих сахарным диабетом 3. Боритесь с артериальным давлением, которое, как правило, приводит к болезням почек 4. Снижайте избыточный вес. Излишняя масса тела становится всеобщим бедствием. Вес – причина многих болезней, в том числе и заболеваний почек 5. Пейте достаточное количество воды. Как минимум, надо пить не менее 1,5 л воды в сутки. Причем пейте по возможности воду, а не сладкие напитки. Вода – мощное средство против всех болезней и, в первую очередь, почек 6. Избавьтесь от вредных привычек. Алкоголь разрушает не только печень, но и почки, а никотин сужает сосуды и уменьшает кровоток в почках, приводит, в том числе к раку почек Операция нефрэктомии у живого донора и трансплантации почкиОперационные доступы, используемые при открытой нефрэктомии у донора, подразделяются на боковые и передние. При этом боковой доступ всегда является забрюшинным (традиционная люмботомия). В свою очередь, передний доступ может быть как забрюшинным, так и чрезбрюшинным. После рассечения кожи и мышц ход операций идентичен. После вскрытия фасции Героты почку выделяют из собственной жировой капсулы. Затем выделяют почечную ножку, почечную вену мобилизуют до ее впадения в нижнюю полую вену. Артерию мобилизуют на всем протяжении до аорты. Следующим этапом выделяют мочеточник, пережимают его на уровне подвздошных сосудов и пересекают. Зажим на почечную артерию накладывают так, чтобы оставить культю, достаточную для лигирования и прошивания. Пережимают почечную вену (ближе к полой вене), сосуды пересекают. Культи почечных сосудов прошивают и перевязывают. Известны различные способы создания артериального анастомоза при наличии одной почечной артерии трансплантата: «конец в бок» с общей подвздошной или наружной артерией или «конец в конец»с внутренней подвздошной артерией реципиента. В случае наличия множественных почечных артерий, которые встречаются в 30% случаев, могут быть использованы несколько вариантов сосудистой реконструкции. Венозный анастомоз всегда формируется по типу «конец в бок» с наружной подвздошной веной, причем по выбору хирурга он может быть выполнен после артериального или до него. Множественные почечные вены не составляют проблемы, ибо одна из них (меньшая по размеру) может быть легендировано. Перед снятием сосудистых зажимов артериальное давление (АД) должно быть не ниже 140 мм рт. ст., ЦВД — 100 мм вод. ст. Внутривенно вводят 0,5–1 г метилпреднизолона и 200 мг лазикса. После включения трансплантата в кровоток (время вторичной тепловой ишемии не должно превышать 30–40 мин) при необходимости накладывают дополнительные швы, осуществляют гемостаз в воротах трансплантата, после чего переходят к восстановлению непрерывности мочевыводящих путей. Экстравезикальная методика Lich заключается в имплантации мочеточника в дно мочевого пузыря, слизистая которого обнажается путем рассечения мышц на протяжении 2,5–3 см. После вскрытия просвета пузыря на протяжении 8–10 мм мочеточник анастомозируют со слизистой отдельными узловыми швами или непрерывным обвивным швом нитью из рассасывающегося материала. Второй слой (мышцы мочевого пузыря) сшивают над анастомозом таким образом, чтобы создать подслизистый туннель. Другим способом восстановления непрерыв ности мочевыводящих путей является анастомозирование лоханки или мочеточника пересаженной почки с собственным мочеточником больного после удаления (или без него) почки на стороне операции. При этом, как считают сторонники данной методики, сохраняется физиологический пассаж мочи, что является надежной профилактикой пиелонефрита трансплантата. Принципы ведения ближайшего послеоперационного периодаВ течение ближайшего послеоперационного периода после трансплантации почки, помимо общепринятых мер, проводят специфические назначения, направленные на создание оптимальных условий для функционирования пересаженной почки. Первичная функция трансплантата может быть немедленной, если она начинается сразу после реваскуляризации донорского органа, или отсроченной, когда с момента операции в течение нескольких дней и даже недель имеет место олигоанурия. Немедленная функция трансплантата оценивается как удовлетворительная при адекватном диурезе и отсутствии потребности в послеоперационном диализе. Уровень креатинина в таких случаях нормализуется в течение 7–12 суток. Отсроченная функция обычно является клиническим проявлением острого канальцевого некроза. По данным разных центров, он развивается в 20–80% наблюдений, по нашим данным, у 40– 50% реципиентов. Частота и тяжесть канальцевого некроза зависят от состояния донора перед изъятием почки, условий консервации донорского органа, характера консервирующего раствора, течения анестезии во время трансплантации, адекватности послеоперационной инфузионной терапии и начального режима иммунодепрессии. Специального лечения острый канальцевый некроз не требует. В большинстве случаев он обратим, и до восстановления функции донорского органа необходимо продолжать программный гемодиализ. Диагностика данной патологии в условиях анурии включает, помимо общеклинических оценок и УЗИ с допплерографией, проведение при необходимости и пункционной биопсии. Первично нефункционирующий трансплантат наблюдается в 8–10% случаев, когда функция трансплантата не восстанавливается. Причиной может быть как особая тяжесть его ишемического повреждения с исходом в кортикальный некроз, так и наслоение на ишемическую нефропатию сверхострого или ускоренного отторжения. Для профилактики острого канальцевого некроза и скорейшего восстановления функции почки рекомендуется назначать антагонисты кальция, простагландины, допамин, начиная с момента реперфузии. Как правило, операция трансплантации почки хорошо переносится больными. В течение нескольких суток после операции может наблюдаться парез кишечника, который разрешается обычно самостоятельно. Мочевой катетер в зависимости от техники имплантации мочеточника может быть удален через 2–6 дней, если суточный диурез не превышает 2,5 л. Среди послеоперационных назначений,помимо иммуносупрессии, можно назвать следующие: антибиотики широкого спектра действия в течение 5–7 суток в сочетании с противогрибковыми препаратами (нистатином) с последующим переходом на уросептики с учетом результатов посевов мочи; противовирусная терапия, направленная на профилактику и лечение цитомегаловирусной инфекции; гастропротективная терапия, включающая антациды, блокаторы H2 рецепторов (циметидин), ингибиторы протонной помпы (омепразол); гипотензивная терапия по показаниям. При выборе гипотензивных препаратов предпочтение отдается антагонистам кальция, учитывая их дополнительные свойства: улучшение кровообращения в пересаженной почке и снижение степени реперфузионных повреждений. Иммуносупрессия при трансплантации почки.Цель иммуносупрессивной терапии при пересадке органов заключается в том, чтобы обеспечить эффективную профилактику как острого, так и хронического отторжения трансплантата при одновременном сведении к минимуму возможности развития инфекционных осложнений и других побочных эффектов. При использовании ингибиторов кальциневрина (ЦсА, такролимуса) после пересадки почки существует дополнительная опасность развития проявлений нефротоксичности в течение ближайшего посттрансплантационного периода, когда функционирование трансплантата уже может быть нарушено в результате ишемических реперфузионных повреждений. Иммунологический ответ выражен максимально во время ближайшего посттрансплантационного периода и далее обычно ослабляется. Соответственно весь период иммуносупрессии после пересадки почки может быть разделен на два периода. Первый из них является периодом индукционной иммуносупрессии и охватывает примерно первые 12 недель после трансплантации. Для него характерны неустойчивая функция трансплантата и повышенная аллореактивность с наиболее высокой вероятностью кризов отторжения. Задачей индукционной иммуносупрессии является предупреждение раннего отторжения при минимальном риске дополнительных повреждений донорского органа, а также других серьезных, в первую очередь инфекционных, осложнений. Второй период — поддерживающей иммуносупрессии, в свою очередь, также может быть разделен на два этапа: первый (до одного года) — относительно короткий период ранней поддерживающей терапии, когда постепенно снижают дозы иммуносупрессантов; второй — период хронической поддерживающей иммуносупрессии, когда, с одной стороны, уровень иммуносупрессии относительно стабилен и достаточен для предупреждения отторжения и, с другой стороны, не приводит к осложнениям иммуносупрессии. Основной задачей на отдаленных сроках после трансплантации становится профилактика и торможение прогрессирования хронической трансплантационной нефропатии. В настоящее время известны многочисленные протоколы базисной иммуносупрессии, применяемые в мире, которые различаются как по выбору, количеству используемых препаратов (одно, двух, трех и четырехкомпонентные), так и по их дозировкам, последовательности и длительности назначения. ЦсА и такролимус обладают относительно узким «терапевтическим окном», так что недостаточная их дозировка резко повышает риск отторжения трансплантата, тогда как избыточная чревата развитием проявлений нефротоксического эффекта. В связи с этим мониторинг терапии этими лекарственными средствами требует строгого контроля уровня препаратов в крови. При выборе оптимальной схемы поддерживающей иммуносупрессии в каждом конкретном случае должно учитываться исходное состояние реципиента, в частности его иммунный статус (уровень предсуществующих антител), предыдущие трансплантации, сопутствующая патология (сахарный диабет, поражения печени), а также функция пересаженного органа и сроки после операции. В современной практике наибольшее распространение получила трехкомпонентная иммуносупрессия. Эта схема включает в себя ингибиторы кальциневрина, которые назначают больному с первых часов после операции, микофенолаты, а также глюкокортикостероиды. Оптимальный набор и дозировки препаратов зависят от срока после трансплантации, ренальных и/или экстраренальных осложнений и ряда других факторов. Литература 1. Здоровье, почки, диализ, жизнь. Часть 2. Записки пациента / Ш. Ш. Шабаев —С 10. 2. Ермоленко, В.М. Хроническая почечная недостаточность / В.М.Ермоленко; ред. проф. И.Е.Тареева.—М.: Медицина, 2000.—C.596—698. 3. Лавиль, М. Роль артериальной гипертонии в прогресси ровании почечной недостаточности, эффективность антигипертензивной терапии / М.Лавиль // Нефрология.— 2000.—Т.4, № 1.—С.119—121. 4. Мухаметзянов, И.Ш. Комплексная оценка потребности и обеспеченности в заместительном лечении больных с терминальной почечной недостаточностью / И.Ш.Мухаметзянов // Нефрология и диализ.—2001.—Т.3, № 1.— С.17—24. 5. Мухин, Н.А. Хронические прогрессирующие нефропатии и образ жизни современного человека / Н.А.Мухин, И.М.Балкаров, С.В.Моисеев [и др.] // Терапевт. архив.— 2004.—№ 9.—С.5—11. 6. Николаев, А.Ю. Лечение почечной недостаточности / А.Ю.Николаев, Ю.С.Милованов.—М.: Медицина, 1999.— 362 с. 7. О состоянии заместительной почечной терапии ХПН в Российской Федерации в 1998 г. [Ежегодный отчет по данным Российского регистра] // Нефрология и диализ.—2000.—Т.2, № 1—2.—С.4—24. 8.Российского трансплантологического общества http://transpl.ru/specialist/rto/ 9.Рубрификатора клинических рекомендаций МЗ РФ http://cr.rosminzdrav.ru/ 10.Федеральной электронной медицинской библиотеки http://www.femb.ru/feml 11.Готье С.В. Состояние и перспективы научных исследований в области трансплантологии и искусственных органов // Трансплантология: итоги и перспективы. — 2015. — Т. VII / Под ред. С.В. Готье. — М.; Тверь: Триада, 2016. — С. 174-220 12.Шагидулин М.Ю., Готье С.В. Разработка и экспериментальное исследование клеточ: ноинженерных конструкций печени для лечения печеночной недостаточности // Трансплантология: итоги и перспективы. — 2015. — Т. VII / Под ред. С.В. Готье. — М.; 13. Необыкновенные способности, почки.Жильбер Дерз. Самара 2015г. |
