Исследование ликвора. Введение Лабораторные методы исследования ликвора
 Скачать 1.08 Mb. Скачать 1.08 Mb.
|
1 2 Оглавление:
Исследования ликвора – это неотъемлемая часть диагностики заболеваний, поражающих центральную нервную систему. Спинномозговая жидкость является непосредственным продолжением внеклеточного и перикапиллярного пространства нервной ткани, поэтому она немедленно реагирует на любые изменения, произошедшие в мозге. По физико-химическим параметрам и клеточному составу ликвора можно судить о характере патологии, ее стадии и контролировать ход лечения. При вирусных инфекциях центральной нервной системы в спинномозговой жидкости обнаруживаются антигены возбудителя, при бактериальных микроскопическим методом выявляются микробные тела, бактериологическим – определяется вид бактерий и их чувствительность к антибиотикам. Современные возможности лабораторной диагностики существенно расширили объем информации, который можно получить в результате люмбальной пункции. Создание высокочувствительных методов
Ликвор (спинномозговая жидкость) – это биологическая жидкость, которая омывает структуры центральной нервной системы. Синтез ее происходит в венозных сосудистых сплетениях боковых желудочков головного мозга, откуда по через foramen interventriculare жидкость поступает в III мозговой желудочек. Последний через сильвиев водопровод сообщается с IV желудочком, из которого по срединной и боковой апертурам ликвор переходит в подпаутинное пространство спинного и головного мозга. Незначительная часть жидкости проникает также в субдуральное пространство. 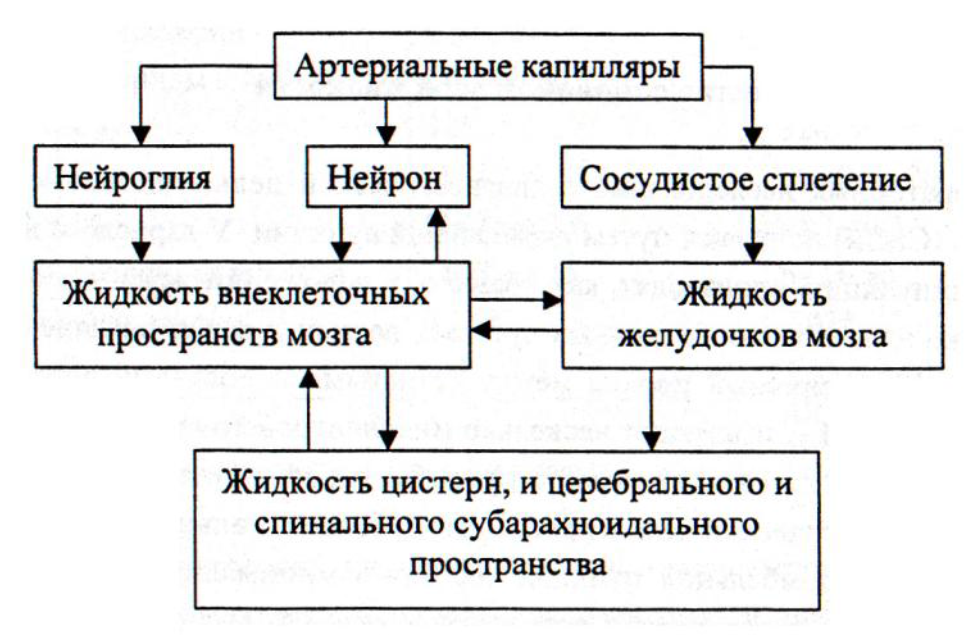 Рисунок 1 – Схема основных путей образования ликвора. Образование ликвора в боковых желудочках происходит достаточно интенсивно, благодаря чему в их полости создается достаточное давление, чтобы придать току жидкости каудальное направление. Однако, спинномозговую жидкость нельзя приравнять к фильтрату плазмы крови, так как к ней примешивается внеклеточная жидкость нервной ткани, поступающая через эпендиму желудочков. В какой-то мере происходит и обратный процесс – поступление ликвора через эпендиму к нейроцитам и клеткам глии. Современные радиоизотопные методы исследования позволили установить, что спинномозговая жидкость в течение нескольких минут покидает полость желудочков и в течение 4-8 часов поступает в подпаутинное пространство из цистерн основания мозга. В сутки у взрослого человека секретируется около 500 мл ликвора, количество его в ликвороносных путях составляет 125-150 мл (10-14% от массы головного мозга). В боковых желудочках находится по 10-15 мл жидкости, в III и IV суммарно около 5 мл, в подпаутинном краниальном пространстве – 30 мл, в спинальном – 70-80 мл. В течение суток ликвор сменяется до 3-4 раз у взрослых и до 8-ми раз у детей. Циркуляция ликвора в субарахноидальном пространстве происходит по системе ликвороносных каналов и подпаутинных ячеек. Ток жидкости ускоряется при изменении положения тела в пространстве и под влиянием мышечных сокращений. На сегодняшний день считается, что ликвор, находящийся в поясничном отделе в течение одного часа перемещается краниально, возможно, что циркуляция происходит в обоих направлениях одновременно. Отток спинномозговой жидкости на 30-40% происходит через пахионовы грануляции паутинной оболочки в верхний сагиттальный синус, который является частью венозной системы твердой мозговой оболочки. Они появляются у человека в возрасте 1,5 лет, разрастаясь на наружной поверхности паутинной оболочки вдоль крупных пазух и вен. Обращены грануляции в сторону твердой мозговой оболочки и с веществом мозга не соприкасаются. Ликвор скапливается в верхнем сагиттальном синусе, создавая в нем давление на 15-50 мм.рт.ст. выше, чем венозное, за счет чего происходит переход жидкости из ликворных путей в кровеносную систему.  Рисунок 2 – Схема взаимоотношения оболочек головного мозга и грануляций паутинной оболочки (пахионовых грануляций). 1 – твердая мозговая оболочка; 2 – субдуральное пространство; 3 – паутинная оболочка; 4 – подпаутинное пространство; 5 – грануляции паутинной оболочки; 6 – верхний сагиттальный синус; 7 – боковая лакуна; 8 – сосудистая оболочка. Отток спинномозговой жидкости происходит также по ликвороносным каналам в субдуральное пространство, из которой она поступает в кровеносные капилляры твердой мозговой оболочки и переходит в венозную систему. Кроме того, она частично поступает в лимфатическую систему по периневральным пространствам черепно-мозговых нервов (5-30%), всасывается эпендимой желудочков (10%) и поступает в паренхиму мозга.
По составу ликвор сходен с плазмой крови и состоит на 90% из воды и 10% сухого остатка. В нем содержатся аминокислоты (20-25), белки (около 14 фракций), ферменты, принимающие участие в метаболизме нервной системы, сахар, холестерин, молочная кислота и около 15 микроэлементов. В ликворе определяются нейромедиаторы: ацетилхолин, норадреналин, дофамин, серотонин; гормоны – мелатонин, эндофины, энкефалины, кинины. Функции ликвора:
Окончательно функции ликвора не изучены по сей день, поэтому исследовательские научные работы по его изучению продолжаются.
Впервые ликвор для исследования получил Квинке в 1891 году, после чего его методика получила широчайшее распространение. Общеклинический анализ спинномозговой жидкости проводится в течение 3-х часов после забора материала, поэтому анализ всего проводят в неотложном порядке. Для получения ликвора в большинстве случаев используют люмбальную пункцию, редко – субокципитальную, интраоперационно – вентрикулярную. Люмбальную пункцию проводит невролог/анестезиолог-реаниматолог в условиях процедурного кабинета, перевязочной или операционной. Больного укладывают на бок с приведенными коленями к груди, после чего вводят иглу в пространство между 4 и 5-м поясничными позвонками в подпаутинное пространство. Первые пять капель ликвора удаляют, так как в них содержится путевая кровь из поврежденных в процессе манипуляции кровеносных сосудов. Собирают жидкость в 2 стерильные пробирки: одна из них направляется на биохимическое и цитологическое исследования, другая используется для обнаружение фиброзной пленки или сгустка. Если существует необходимость в бактериологическом посеве, ликвором наполняется 3-я пробирка. Без опасности для здоровья у взрослого человека можно забрать 8-10 мл ликвора, у детей 5-7 мл, у грудничков 2-3 мл. Нельзя встряхивать полученный биоматериал, подвергать его воздействию перепада температур, так как это существо изменяет его показатели. Все пробирки маркируются до начала исследования, нумеруются, после наполнения их плотно закупоривают и немедленно отправляют в лабораторию. В направлении следует указать:
2.4 Методы лабораторного исследования ликвора 2.4.1. Макроскопическое исследование Макроскопическое исследование – это вся информация о биоматериале, которую лаборант может получить при помощи органов чувств.
2.4.2. Микроскопическое исследование ликвора Это один из самых ответственных этапов исследования спинномозговой жидкости, на основании данных которого нередко подтверждаются либо опровергаются диагнозы. Подсчет количества форменных элементов проводится в течении 30 минут после извлечения спинномозговой жидкости с последующей дифференциацией клеток. Для подсчета лейкоцитов препарат окрашивают одним из реактивов:
Окрашенный препарат помещают в камеру Фукса-Розенталя объемом 3,2 мкл. Лейкоциты считают на малом увеличении во всех 256 квадратах, при высоком плеоцитозе 200-1000х106/л считают половину сетки и результат умножают на 2, при плеоцитозе свыше 1000х106/л подсчитывают один ряд больших квадратов и результат умножают на 4. Нормальные значения цитоза указаны в таблице 1, при различных видах патологии – в таблице 2. Таблица 1 Цитоз в люмбальном ликворе
Таблица 2 Плеоцитоз при различных заболеваниях
Количество эритроцитов в ликворе подсчитывают в счетной камере Горяева. Для этого СМЖ с примесью крови разводят в 10 раз — 9 частей изотонического раствора хлорида натрия и 1 часть СМЖ смешивают в пробирке. Полученную жидкость тщательно перемешивают, заполняют счетную камеру Горяева и, согласно правилам подсчета количества эритроцитов крови, определяют число эритроцитов в пяти больших квадратах. Количество эритроцитов в 1 мкл СМЖ определяют по формуле: 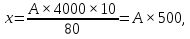 где А – количество эритроцитов в 5 больших (80 малых) квадратах, 1/400 – объем малого квадрата, 10 – разведение ликвора, 80 – количество малых квадратов. При подсчете в камере Фукса-Розенталя в окрашенных фуксином клеточных и форменных элементах просматриваются структуры ядра и цитоплазмы, что позволяет проводить их дифференцировку. Оценку их проводят при увеличении 7х40. Регистрация результатов подсчета может иметь процентное или численное выражение (ликворограмма). Учитывая, что форменные и клеточные элементы могут подвергаться дегенеративным изменениям, при долгом нахождении в СМЖ, необходимо проводить оценку и подсчет форменных и клеточных элементов в окрашенных препаратах. Клетки ликвора имеют совершенно другое сродство к красящим веществам, чем клетки крови, поэтому и подбор красителей должен быть иным. Хорошие результаты дают следующие виды окраски препаратов:
Нормальные значения содержания клеточных элементов в ликворе представлены в таблице 3. Таблица 3 Содержание форменных элементов в ликворе в норме у детей и взрослых
Технология цитоцентрифугирования (цитоспин). Приготовление окрашенных препаратов ликвора из осадочной жидкости после центрифугирования не всегда позволяет получить тонкий слой клеток, пригодный для диагностики. Для решения этой проблемы была разработана технология цитоцентрифугирования, которая заключается в аппаратном изготовлении высококачественных препаратов. Для этого полученный ликвор подготавливают к исследованию и помещают в цитокамеру, после чего он дозированно подается на вертикально распложенные в роторе цитоцентрифуги слайды. Под действием центробежно силы клетки равномерно распределяются по стеклу, в то время как более легкая жидкость удаляется с поверхности препарата. Высушивание, фиксация и окраска препарата также проводятся в цитоцентрифуге. Аппарат позволяет создать до 8-ми диагностических зон на одном слайде. Атипичные клетки – чаще являются клетками опухолей ЦНС или её оболочек. Так же могут встречаться при хроническом воспалительном процессе (туберкулезный менингит, менингоэнцефалит, рассеянный склероз, энцефаломиелит) – это клетки эпендимы желудочковпаутинной оболочки, а так же лимфоциты, моноциты и плазмоциты с изменениями ядра и цитоплазмы. Измененные клетки и тени клеток обнаруживаются при длительномих нахождении в СМЖ. Чаще всего подвергаются аутолизу нейтрофильные гранулоциты, клетки паутинной оболочки, эпендимы желудочков. Диагностического значения измененные клетки и тени клеток не имеют. Кристаллыв ликворе обнаруживаются редко. На 4–5 день после субарахноидального кровоизлияния, черепно-мозговой травмы обнаруживаются кристаллы гемосидерина, в случае распада опухоли в содержимом кисты можно обнаружить кристаллы гематоидина, холестерина, билирубина, так же кристаллы холестерина образуются в очагах жировой дистрофии, некроза ткани мозга и в кистах мозга. Для выявления кристаллов в СМЖ используют реакции, представленные в таблице 4. Таблица 4 Реакции, используемые для выявления кристаллов в ликворе
Элементы эхинококка – крючья, сколексы и обрывки хитиновой оболочки пузыря эхинококка могут быть выявлены при множественном эхинококкозе мозговых оболочек. Находят их чрезвычайно редко. 1 2 |
