свойства водорода. Введение общие свойства водорода
 Скачать 204.21 Kb. Скачать 204.21 Kb.
|
|
Содержание Введение …………………………………………………………….…3 1. Общие свойства водорода ………………………………………...…3 2. Получения водорода из реакции сплава алюминия и ртути в воде 3 А). Физический смысл реакции ………….……………….….….3 B). Химический смысл реакции ………………….………….…..5 3. Гидрореагирующая композиция для получения водорода и способ ее приготовления …..……………………………………………….…….…6 4. Получение водорода из воды путем ее разложения гидрореагирующими металлами…..…………………………………………………….….……7 5. Автономный водородный генератор для термощелочной обработки нефтегазовых скважин …………………………………………………..9 Список использованной литературы……………………….…………..8 Введение Одним из перспективных видов топлива с точки зрения экономики и экологии является водород. При его сжигании отсутствуют парниковые газы и образуется вода, которую повторно можно разложить на водород и кислород, причем не вызывая никакого загрязнения окружающей среды. Однако применение водорода в качестве энергоносителя имеет ряд недостатков: технические и экономические трудности при его хранении, транспортировании и распределении, взрывоопасность смеси водород–воздух. В связи с этим целесообразно использовать энергоаккумулирующие вещества, в частности алюминий, в качестве промежуточного энергоносителя для производства водорода. С помощью концепции выработки электроэнергии, основанной на окислении алюминия в воде, предложено получать тепловую энергию из водородного топлива. Изучена кинетика образования водорода при химическом разложении воды. Проведена серия экспериментов, позволивших выявить зависимости скорости выделения Н2 и объема водорода, выделившегося с поверхности алюминиевого образца, от времени реакции. 1. Общие свойства водорода В свободном состоянии и при нормальных условиях водород - бесцветный газ, без запаха и вкуса. Относительно воздуха водород имеет плотность 1/14. Он обычно и существует в комбинации с другими элементами, например, кислорода в воде, углерода в метане и в органических соединениях. Поскольку водород химически чрезвычайно активен, он редко присутствует как несвязанный элемент. Охлажденный до жидкого состояния водород занимает 1/700 объема газообразного состояния. Водород при соединении с кислородом имеет самое высокое содержание энергии на единицу массы: 120.7 ГДж/т. Это - одна из причин, почему жидкий водород используется как топливо для ракет и энергетики космического корабля, для которой малая молекулярная масса и высокое удельное энергосодержание водорода имеет первостепенное значение. При сжигании в чистом кислороде единственные продукты - высокотемпературное тепло и вода. Таким образом, при использовании водорода не образуются парниковые газы и не нарушается даже круговорот воды в природе. 2. Получения водорода из реакции сплава алюминия и ртути в воде. Физический смысл реакции Метод довольно прост и способен дать Вам водород довольно быстро. берем слиток алюминия, наносим на него шарик ртути, той, что используется в обыкновенных градусниках. Берем острый предмет, например нож и царапаем им алюминий прямо под шариком ртути, то есть вводим в ртуть кончик ножа и царапаем под ним алюминиевый слиток, после этой операции у нас под шариком ртути получиться амальгама, то есть сплав ртути с алюминием, когда мы царапаем алюминий, то мы срываем с него защитный слой оксида алюминия. В обычных условиях, на открытом воздухе алюминий сразу покрывается тончайшей, но очень прочной оксидной пленкой, эта пленка и препятствует дальнейшему окислению алюминия. Но когда мы покрыли алюминий ртутью и под ней поцарапали алюминий, то мы, содрав пленку позволили ртути создать сплав с алюминием, то есть ртуть тут же внедряется в кристаллическую решетку алюминия. Теперь самое главное. Оксидная пленка препятствует окислению, а вот то место, где мы сделали амальгаму, там алюминий довольно активно будет окисляться кислородом воздуха с образованием белого порошка, так будет продолжаться пока весь слиток алюминия не окислиться. Если положить такой слиток в воду, то он будет очень активно окисляться и там, вытесняя из воды водород. реакция в воде протекает настолько бурно, что происходит взрыв. Чтобы взрыва не было и чтобы можно было контролировать выход количества водорода, можно не класть слиток в воду, а продувать мимо такого слитка водяной пар, который будет окисляться до водорода, то есть алюминий будет отнимать у пара кислород, а водород будет побочным продуктом, который Вы запросто можете использовать в качестве топлива для авто. Алюминий можно добывать повсюду, на свалках, на помойках, можно даже открыть нелегальный приемный пункт, в любом случае при всех затратах, этот метод окупиться с лихвой, это будет самое дешевое и легко добываемое топливо. Представьте, что у Вас на авто стоит некий герметичный бачок, который Вы можете открыть и бросить туда алюминиевую вилку, ложку или кастрюлю, или кучу алюминиевых проводов, естественно вначале следует купить градусник и ртуть из него нанести на алюминий вышеупомянутым способом. Для удобства можно плавить алюминиевый хлам и отливать из него компактные заготовки, потом создать на слитке хотя бы маленькую точку амальгамы, а после покрыть это место замазкой или скотчем, или просто положить в целлофановый пакет и плотно завязать его, чтобы не было реакции окисления. Вот такие заготовки потом Вы можете кидать в герметично закрывающийся бачок, потом подавать туда пар и получать на выходе чистый водород, который будет питать Ваше авто. метод взрывобезопасен, так как количество выделенного водорода зависит от количества поданного пара. располагать такой «реактор» можно непосредственно перед камерой куда будет впрыскиваться водород, чтобы выделяющийся водород, сразу же использовался не образуя больших взрывоопасных скоплений. Химический смысл реакции Алюминий – активный в химическом отношении металл. Обычно он защищен от атмосферного кислорода и влаги тонкой пленкой на его поверхности, содержащей оксидный и молекулярный кислород в сложном химическом сочетании; это не просто оксид алюминия Аl2O3, как это представляли раньше. Обрабатывая алюминий солью ртути, мы разрушаем защитную пленку. Вот как это происходит. Находясь в растворе нитрата ртути(II), алюминий вытесняет (восстанавливает) из cоли металлическую ртуть: 2Аl + 3Нg(NO3)2 = 3Hg + 2Аl(NО3)3, На очищенной поверхности ложки появляется тонкий слой амальгамы алюминия (сплава алюминия и ртути). Амальгама не защищает поверхность металла, и он превращается в пушистые хлопья метагидроксида алюминия: 4(Аl, Нg) + 2Н2O + 3O2 = 4АlО(ОН) + 4Нg. Израсходованный в этой реакции алюминий пополняется новыми порциями растворенного в ртути металла, а выделившаяся ртуть снова «пожирает» алюминий. И вот вместо блестящей ложки на бумаге остаются АlO(ОН) и мельчайшие капельки ртути, потерявшиеся в белых хлопьях метагидроксида алюминия. 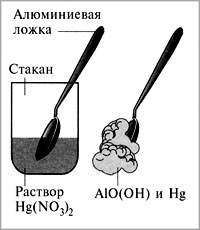 Если после раствора нитрата ртути(II) алюминиевую ложку сразу же погрузить в дистиллированную воду, то на поверхности металла появятся пузырьки газа и чешуйки белого вещества. Это водород и метагидроксид алюминия: 2Аl + 4Н2О = 2АlO(ОН) + 3Н2. Подобным же образом ведет себя алюминий в водном растворе хлорида меди(II) СuCl2. Попробуйте опустить в этот раствор обезжиренную алюминиевую пластинку. Вы увидите образование коричневых хлопьев меди и выделение пузырьков газа. Выделение меди вполне объяснимо: более активный в химическом отношении металл алюминий восстанавливает медь из ее солей: 2Аl + 3СuCl2 = 3Сu + 2АlСl3. 3. Гидрореагирующая композиция для получения водорода и способ ее приготовления Изобретение относится к технологии получения водорода, основанной на химических реакциях твердого и жидкого реагентов, более конкретно к составу и способу приготовления гидрореагирующей композиции для получения водорода. Изобретение может найти применение при создании генераторов водорода (водородных картриджей) для малогабаритных источников питания на топливных элементах, в том числе для источников автономного питания ноутбуков, для устройств зарядки аккумуляторов сотовых телефонов и т.п. Известен состав гидрореагирующей композиции для получения водорода, включающей алюминий и ртуть, при этом содержание ртути составляет 3-5 мас.% (см. авт. свид. СССР № 945061, опубл. в бюл. № 27, 1982 г.) Способ приготовления указанной гидрореагирующей композиции включает активацию алюминия ртутью, причем активацию ведут путем заполнения ртутью отверстия, выполненного в центре слитка алюминия, в количествах 3-5 мас.% с последующей термообработкой изделия в вакууме при 600-658°С в течение 1-1,5 ч. Грамм порошка полученного сплава выделяет водород при взаимодействии с водой с максимальной скоростью, равной 1440 мл/(г·мин), при температуре 90°С. Общее количество выделившегося водорода равно 1040 мл с 1 г сплава (см. авт. свид. СССР № 945061). Недостатками известного состава и способа его получения являются сравнительно сложная, малоэффективная и экологически неприемлемая технология получения гидрореагирующей композиции при активации алюминия ртутью, в том числе связанная с необходимостью утилизации образовавшихся продуктов. 4. Получение водорода из воды путем ее разложения гидрореагирующими металлами При взаимодействии гидрореагирующих металлов с водой выделяется водород. Выход водорода в этих реакциях достаточно велик, и использование некоторых металлов может представлять практический интерес. Тип реакции зависит от количества воды, а оно, в свою очередь, — от рабочих параметров реактора (избытка воды по сравнению со стехиометрическим коэффициентом, давления, температуры). Реакция (а) протекает при Т = 250 °С, Р = 8 МПа. Средняя скорость окисления алюминиевого порошка недостаточна для создания пригодного для использования в энергетических установках реактора. Реакция (б) протекает при температуре Т = 300—350 °С, Р = 16—18 МПа. Реакция идет достаточно быстро и поддается регулированию. Продуктом реакции, помимо водорода, является порошок с размером частиц от 1 до 5 мкм, которые не слипаются. Реакция (в) протекает при температуре, превышающей 300— 350 °С, давлении Р = 20—30 МПа. Продуктом реакции, помимо водорода, является порошок, состоящий в основном из AlO , который может образовывать твердые агломераты, плохо растворимые в воде и откладывающиеся на стенках трубопроводов. Процесс трудноуправляемый и опасный. Проведенный анализ этих процессов позволил остановиться на реакции (б). Поскольку скорость реакции растет с увеличением степени дисперсности порошка, желательно иметь максимально возможную дисперсность. Освоенные отечественной промышленностью марки порошков представлены в таблице 1.6.  Удельный массовый выход водорода, отнесенный к 1 кг металла, составляет, согласно приведенным уравнениям, величину, приблизительно равную 11,1 % для алюминия. Это примерно в 2—3 раза ниже аналогичных значений для лучших гидридов. Приведенные результаты свидетельствуют о том, что для транспортных установок этот метод труднореализуем вследствие неудовлетворительных массогабаритных характеристик и сложности технологической схемы установки. 5. Автономный водородный генератор для термощелочной обработки нефтегазовых скважин. Отражена хронология развития одного из направлений в «водородной энергетике», основанного на использовании прямой реакции между водными растворами и гидрореагирующими металлами применительно к решению эксплуатационных проблем нефтедобычи. Обозначены два различных подхода. Создание безопасного автономного гидрореагирующего элемента (ГРЭЛ)-генератора водорода реализовано на принципе ограничения площади взаимодействия в системе: Na-Al- H2O. Предложен критерий оценки вероятности перехода процесса взаимодействия в режим теплового взрыва. Представлен уровень реализации технических решений и утвержденной нормативно технической документации. Отражена хронология развития одного из направлений в «водородной энергетике», основанного на использовании прямой реакции между водными растворами и гидрореагирующими металлами применительно к решению эксплуатационных проблем нефтедобычи. Обозначены два различных подхода. Создание безопасного автономного гидрореагирующего элемента (ГРЭЛ)-генератора водорода реализовано на принципе ограничения площади взаимодействия в системе: Na-Al- H2O. Предложен критерий оценки вероятности перехода процесса взаимодействия в режим теплового взрыва. Представлен уровень реализации технических решений и утвержденной нормативно технической документации. Любая нефтедобывающая страна, длительные годы осваивающая свои ресурсы углеводородов, неизбежно сталкивается с проблемой создания новых технологий, обеспечивающих более эффективное и полное их извлечение из продуктивных пластов[1]. Отличительной особенностью отечественного опыта эксплуатации нефтегазовых месторождений является применение заводнения на начальных этапах разработки месторождений. До того, как заметно снизится пластовое давление. К основным особенностям такой практики по мнению Уоттенберга [2] относят следующие: — возможность извлечения большого объема нефти при минимальных затратах; снижение нагрузок на насосное оборудование. Нефтяной комплекс России включает более 150 тыс. нефтяных скважин. За более, чем 100-летнюю историю добыто почти 13 млрд. т. нефти. Более 40% приходится на последние 15 лет [3]. С 1989 года наметилась устойчивая тенденция деградации сырьевой базы отрасли. Обусловлено это значительной выработкой высокопродуктивных месторождений, длительно находящихся в эксплуатации, и вводом в разработку все большего числа месторождений с низкопроницаемыми коллекторами, залегающими на больших глубинах, и аномальными свойствами нефтей. Доля трудно извлекаемых запасов возросла к 1995 году до 48%. Интенсивное возрастание средней обводненности скважин (с 45% в 1975 г. до 90% в 1995 г.) усугубляет ситуацию. В мировой практике более распространена практика воздержания от закачки воды в пласт до тех пор, пока не произойдет существенное снижение естественного пластового давления. В то же время проблема остаточной нефти имеет аналогичную тенденцию. Запасы остаточной нефти в отработанных месторождениях, как правило, превышают ее количество, извлекаемое традиционными способами, причем по мере выработки нефтеносных пластов они из года в год возрастают. К 1984 году в США добыто около 16 млрд. т. нефти, в недрах осталось около 35 млрд. т.[4]. Один кубический метр тонкопористой породы пласта имеет развитую полную удельную поверхность, достигающую десятков гектаров. При толщине остаточной пленки нефти 0,01 мм этот объем породы прочно удерживает силами адгезии до 80 кг остаточной нефти. Для извлечения этой нефти испытывались различные способы преодоления энергии адгезии, основанные на законах физики, химии, термо- и гидродинамики. За последние полвека список отечественных патентов на способы извлечения остаточной нефти превысил 300 наименований и это только начало. В конкретных геолого-промысловых условиях большинство патентованных способов оказались малоэффективными или экономически невыгодными. Весьма продуктивными оказались способы теплового воздействия на нефтеносные породы. Установлено, что водяной пар, проходящий через нефтенасыщенные породы, практически нацело увлекает за собой нефть. Длительное время потребовалось для выяснения особенностей теплопередачи в пористой среде и обосновании экономичного способа создания «тепловой волны». Для обработки залежи необходимо создать начальную зону прогрева, радиусом в десятки метров, а затем нагнетать в пласт холодную воду. Применение этой технологии добычи нефти в масштабах нашей страны ставит перед нефтяниками новые проблемы, в частности, довооружение нефтяной промышленности специализированным наземным и подземным оборудованием, мощными теплогенераторами, термостойкими трубами… Обстоятельный анализ этих проблем, приводит к тому, что их решение может быть ускорено разработкой автономного химического способа создания начальной прогретой зоны. Такой подход исключает необходимость создания опасных термических напряжений в обсадной колонне труб и не требует установки специального теплогенерирующего оборудования на устье скважины. Термин «водородная энергетика», по утверждению[5] появился в 70-е годы, несмотря на то, что энергетический потенциал элемента № 1 в периодической системе по достоинству оценен, как минимум, столетием ранее. Сырьевые запасы водорода в виде водных систем безграничны. Работы по генерации водорода при взаимодействии металлических лития, натрия, калия, кальция, алюминия их гидридов и других соединений, в водных средах проведены в 50-х годах[6]. Предполагалось, что гидрореагирующие металлы могут быть использованы как в двигателях прямой реакции, так и в камерах сгорания-газогенераторах для получения рабочего тела поршневых, турбинных двигателей и МГД- генераторов. Большой объем теоретических и экспериментальных исследований при взаимодействии жидких Li, Na, K c водой был выполнен в США[7]. Показано влияние избыточной воды на температуру взаимодействия, скорость истечения водорода и удельную энергию. Экспериментально установлено, что характеристики форсунок влияют на полноту сгорания металлов. Сделан вывод о существовании критического размера капель, при превышении которого полнота сгорания снижается, уменьшение размера капель ниже критического не дает существенного выигрыша, но увеличивает гидравлические потери и приводит к засорению форсунок. При размещении гидрореагирующих металлов в виде твердого заряда непосредственно в камере сгорания проявились другие трудности. В частности, удельная скорость горения такого рода заряда оказалась нестабильна во времени и значительно уступала капле. Интерес к процессам, сопровождающимся выделением водорода, обусловлен не только «водородной энергетикой». Так, развитие химико-металлургических производств редких металлов неизбежно связано с необходимостью переработки отходов металла в водных растворах, сопровождающихся выделением водорода. Обеспечение безопасности процессов с гарантированным предотвращением образования взрывоопасных смесей водорода с воздухом, достигается регулированием поверхности контакта металла с водными растворами в импульсном режиме[8]. Другим побудительным мотивом реализации процессов в системе щелочной металл – вода оказались эксплуатационные трудности нефтяников, обусловленные асфальто-смолистыми и парафино-гидратными (АСПГ)отложениями в насосно-компрессорных трубах (НКТ) и призабойных зонах продуктивных пластов (ПЗП). Приоритетные попытки решения проблем АСПГ отложений[9] в «лоб»- нерегулируемый самопроизвольный высокоэнергетический процесс взаимодействия щелочных металлов с водой при непосредственном контакте с АСПГ отложениями, были реализованы с использованием металлического лития, натрия на Талинском месторождении г. Нягань в 1993–1994. Взаимодействие щелочных металлов с водными растворами сопровождается интенсивным выделением тепла. При реализации этого процесса в пластовых условиях на глубинах свыше двух километров, можно предполагать эффективное суммарное воздействие на АСПГ отложения, осложняющие процессы фильтрации в пористых средах. Известно, что вода в условиях суб- и суперкритики имеет качественно иные свойства и ее воздействие на природные и техногенные системы кардинально изменяется, по сравнению с обычными условиями (Рис. 1). Водород, выделяющийся в процессе реакции интенсивно турбулизирует реакционный объем, способен эффективно воздействовать на двойные связи, снижая вязкость отложений. Щелочь при высокой температуре активно «омыляет» соединения, входящие в состав АСПГ отложений, и смывает пленку остаточной нефти. В таблице 1 представлены основные характеристики металлов, способных при определенных условиях реагировать с водными растворами. 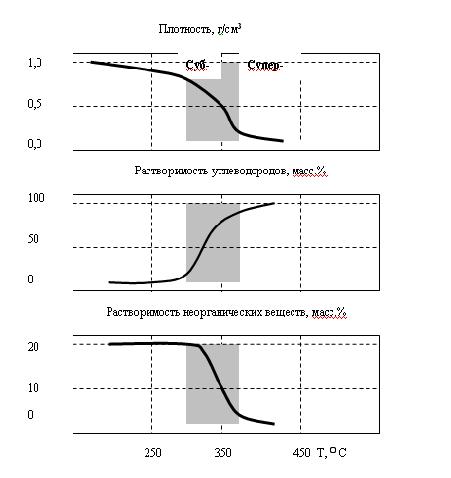 Рис. 1 Свойства водных систем в суб-и суперкритических условиях при давлении 218- 300атм. Характеристики гидрореагируюших металлов 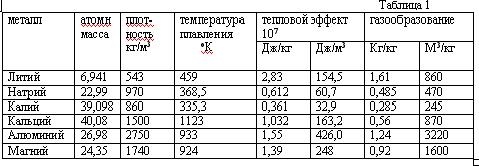 Этот и последующие этапы разработок в области генерации высоко-параметрической парогазовой смеси для решения эксплуатационных задач нефтегазодобычи проводились по двум принципиально разным подходам. Один из них состоял в том, что активная масса гидрореагирующего металла вводилась во взаимодействие с водным раствором в неорганизованном режиме с самопроизвольно развивающейся поверхностью контакта фаз в скважине[10]. Второй подход, как продолжение [8], основан на использовании принципа ограничения площади контакта воды в процессе взаимодействия с активной массой гидрореагирующего металла, и, как следствие, регулируемой скорости генерации водорода[11]. Первый подход преследует решение узко-профильных задач обработки нефтегазовых скважин с целью разрушения АСПГ отложений за счет чрезвычайно высокой энергетики процесса взаимодействия в системе гирореагирующий металл-вода. Выделение водорода, как опасный фактор авторами игнорируется. Обеспечение безопасности процесса обосновывается тем, что в сопутствующих нефти газах отсутствует кислородная составляющая, а привнесение дополнительного водорода, не изменяет категории системы в целом. Изготовление устройств в рамках реализации подхода связано с нанесением на литые заготовки защитных составов и пленочных – оболочных покрытий. Для обработки ПЗП устройства помещаются в герметичный контейнер, спускаются на забой, процесс взаимодействия со скважинной жидкостью инициируется разрушением оболочки. Второй подход изначально ориентирован на создание устройств и способов реализации взаимодействия гидрореагирующих металлов, как генераторов водорода для решения широкого круга технических задач, не смотря на то, что приоритетным остается нефте-газовое направление. Так при лабораторном моделировании и исследовании взаимодействия в первую очередь были разработаны методы оценки вероятности перехода процесса в область «теплового взрыва» и разработан критерий баланса скоростей выделения тепла и его распространения. В соответствие с [12] производственные процессы имеют право на существование, в том случае, если вероятность взрыва на любом взрывоопасном участке в течение года не превышает 10–6. В случае технической или экономической нецелесообразности обеспечения указанной вероятности возникновения взрыва, производственные процессы должны разрабатываться так, чтобы вероятность воздействия опасных факторов взрыва на людей в течение года не превышала 10–6 на человека. Существуют два вида взрывов, определяемых условиями процесса и типом реакции[13]. Основной причиной для термического взрыва является экспоненциальная зависимость скорости реакции от температуры. Если энергия экзотермической реакции не может быть отведена, то температура реакционной системы увеличивается, и реакция ускоряется. Это приводит к выделению тепла с прогрессирующей скоростью, реакция продолжается еще быстрее…, катастрофически быстро. Другой основной тип взрывов связан с цепными реакциями. Если имеются стадии, которые увеличивают число радикалов в системе, скорость реакции может каскадно приводить к взрыву. Типичным примером разветвленной цепной реакции является взаимодействие водорода с кислородом. При взаимодействии водных растворов со щелочными металлами вероятность реализации обоих видов взрывов наиболее высока, поэтому использование высокой энергетики самопроизвольных процессов, генерации водорода или утилизации отходов, содержащих активные металлы, составляет сложную техническую задачу. И если, для предотвращения взрывов воздушно-водородной смеси, рецепт решения очевиден, то перевод процессов в русло теплового сбалансированного режима, требует детального рассмотрения. Протекание экзотермической химической реакции в изолированной системе может быть описано кинетическим уравнением типа: 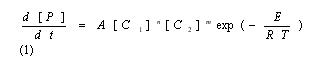 где А- предэкспоненциальный множитель, E- энергия активации в законе Аррениуса для константы скорости химической реакции, R- универсальная газовая постоянная, T- температура реакции, [P]- концентрация продуктов реакции, [C1] [C2] – реагирующих веществ. При избытке исходных реагентов, процесс всегда завершается тепловым взрывом, по истечении периода индукции, равного константе b [14], определяемой уравнением (2): Где где F/f- соотношение площадей активной массы и ограничивающей к ней доступ воды растворимой оболочки, Т кр- температура, определяющая порог перехода в режим теплового взрыва, Е1- энергия активации растворения материала оболочки.; представлены на рисунке 2. 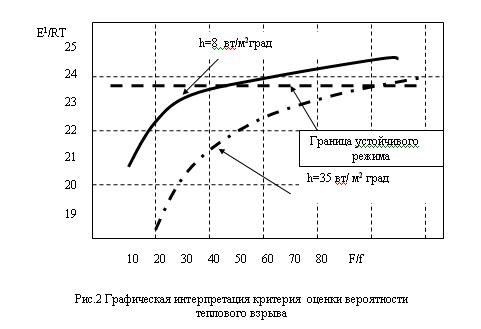 На принципе сбалансированного теплоотвода с поверхности реакции рассчитана безопасная геометрия автономного генератора водорода, проведены испытания, созданы временные технические условия и выпущена опытная партия изделий. Разработанное устройство имеет жесткий цилиндрический алюминиевый корпус в виде стакана. В качестве активной массы использован металлический натрий, который в расплавленном состоянии заливается в корпус. Открытый торец после кристаллизации металла покрывается защитным слоем на основе парафина. Упаковка изделий в стандартные барабаны, используемые для транспортировки металлического натрия, обеспечивает двойную гарантию безопасности транспортировки и длительного хранения. Защитный слой из открытого торца корпуса ГРЭЛ удаляется непосредственно перед целевым использованием. После проведения промысловых испытаний в Башкирии и Сургуте разработаны действующие технические условия на «заряд термохимический, направленного действия» ТУ 3666–002–33905302–98, использование согласовано письмом ГОСГОРТЕХНАДЗОРА России от 24.09.98 № 10–03/467. Всего за период с 1997 года с учетом опытной партии изготовлено более 5000 изделий, проведены уникальные промысловые испытания для различных типов АСПГ отложений и геологических условий. Промысловые испытания выявили целый ряд ограничений, связанных с приемами подготовки скважин к проведению обработок, которые относятся к профессиональным аспектам квалификации эксплуатационного персонала. При ближайшем рассмотрении явления АСПГ отложений в НКТ добывающих скважин, оказалось, что во многом проблема обязана своим существованием низкому уровню технологической дисциплины и несвоевременной профилактики. В то же время, в процессе проведения промысловых испытаний метода разрушения АСПГ отложений в НКТ добывающих скважин, выявлена объективная реальная проблема, связанная с состоянием призабойных зон продуктивных пластов действующего фонда нефтегазовых скважин. Использование автономных водородных генераторов для восстановления фильтрационных свойств ПЗП, можно рассматривать, как эффективный способ восстановления и поддержания продуктивности действующего фонда нефтегазовых скважин. Опыт обработки первых скважин, проведенный на месторождениях Нефтеюганска и Нягани в 2004 году с использованием автономных водородных генераторов, отслеживается по показателю дополнительной добычи, и соотношению проницаемости призабойной и удаленной зон продуктивных пластов, испытания продолжаются. Список использованной литературы 1. Справочник. “Водород. Свойства, получение, хранение, транспортирование, применение”. Москва “Химия” - 1989 г. 2. Ю.М. Буров “Сверхадиабатические обжиговые печи” стр.6-7. “Машиностроитель”1995г. №12. 3. Варшавский И.Л. Энергоаккумулирующие вещества и их использование. Киев, Наукова Думка, 1980. 238 с. 4. Дмитриев А.Л., Иконников В.К., Рыжкин В.Ю., Румянцев А.И. Технологии применения алюминия в водородной энергетике. Альтернативная энергетика и экология, 2010, № 6(86), с. 127–129. 5. Мазалов Ю.А., Сороковиков А.И. Направления исследований по разработке технологических основ алюмоэнергетики для обеспечения энергосбережения на объектах агропромышленного комплекса России. Машинно-технологическая станция, 2003, № 1, с. 47–49. 6. Шейндлин А.Е., ред. Окисление алюминия водой для эффективного производства энергии. Москва, Наука, 2012. 172 с. |
