лекция 9. Xiii. Постоянный электрический ток. 92. Электрический ток. Сила тока. Плотность тока
 Скачать 5.37 Mb. Скачать 5.37 Mb.
|
|
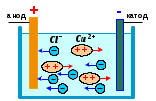 Рис.14.5 | Прохождение электрического тока через электролит сопровож-дается выделением веществ на электродах. Это явление получило название электролиза. (рис.14.5) Электрический ток в электролитах представляет собой упорядоченное перемещение ионов обоих знаков в противоположных направлениях. |
Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Поэтому, они называются катионами и анионами соответственно
Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
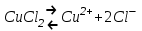 .
.Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Например, ионы хлора, достигнув анода, отдают по одному электрону, нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди. Диссоциация молекул сульфата меди происходит по схеме
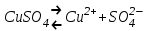 .
.Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион
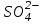 отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом: SO4 + Cu = CuSO4.
отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом: SO4 + Cu = CuSO4.Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
Закон Фарадея (англ.,1833 г.).
Масса вещества m, выделившегося в процессе электролиза на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
m = kQ = kIt.
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
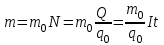 .
.Здесь m0 и q0 – масса и заряд одного иона,
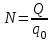 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде:
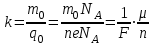 ,
,здесь: NA – постоянная Авогадро,
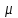 = m0NA – молярная масса вещества,
= m0NA – молярная масса вещества, 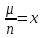 - химический эквивалент вещества.
- химический эквивалент вещества. II закон Фарадея: Электрохимический эквивалент вещества прямо пропорционален химическому эквиваленту, то есть
kxили
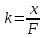 .
.F = eNA – постоянная Фарадея. F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде количество вещества, численно равное химическому эквиваленту этого вещества.
Закон Фарадея для электролиза приобретает вид:
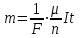 .
.Применения электролиза.
1. Гальваностегия.Электролитическим путем покрывают поверхности одного металла тонким слоем другого (никелирование, хромирование, омеднение и т.п.). Это прочное покрытие защищает поверхность от коррозии а так же в декоративных целях (золото, серебро, платина).
2. Гальванопластика. Процесс получения отслаиваемых покрытий называется гальванопластика. Если принять меры к тому, чтобы электролитическое покрытие хорошо отслаивалось от поверхности, на которую осаждался металл (этого достигают, например, нанося на поверхность графит), можно получить копию с рельефной поверхности. В полиграфической промышленности такие копии (стереотипы) получают с матриц (оттиска набора на пластичном материале). Для этого осаждают на матрицах толстый
слой железа или другого материала.
3. Рафинирование. При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
4. Металлургия. При помощи электролиза получают алю-миний, натрий, магний, бериллий и другие металлы из расплавов руд. Именно этот способ получения алюминия из бокситов сделал его дешевым и распространенным в технике и быту металлом.
