Контрольная работа по ОРГАНИЧЕСКОЙ ХИМИИ. органика готовая. Задача 1 Назовите указанные соединения по систематической и рациональной номенклатуре. 1
 Скачать 339 Kb. Скачать 339 Kb.
|
|
Задача №1 Назовите указанные соединения по систематической и рациональной номенклатуре. 1. 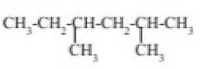 2,4 –диметилгексан (систематическая номенклатура) Метилэтилизобутилметан (Рациональная номенклатура) 2. 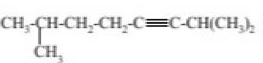 2,7диметилоктин –3 (систематическая номенклатура) 2–метилбутил-изобутил–ацетилен (Рациональная номенклатура) 3. 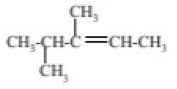 3,4диметилпентен–2(систематическая номенклатура) 2,3-несим–диметил пропилэтилен (Рациональная номенклатура) 4. 3-пентенэтинил(систематическая номенклатура) вторбутил–ацетилен (Рациональная номенклатура) Задача №2 Напишите структурные формулы для следующих соединений Орто-хлортолуол, 2-Метилциклогексадиен-1,3. Решение: 1. Орто-хлортолуол 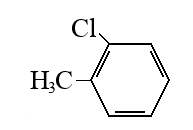 2-Метилциклогексадиен-1,3. 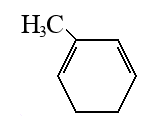 Задача №3 Напишите уравнения следующих реакций и назовите полученные продукты. а) нитрование м-фтортолуола нитрующей смесью; 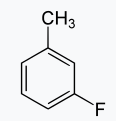 б) нагревание 3-метилгептана в присутствии платины, нанесенной на активированный уголь; 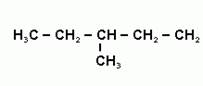  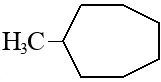 +Н2 +Н2Метилциклогептан в) взаимодействие этилбензола с изобутиленом в присутствии Н3РО4; 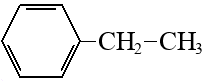 + + 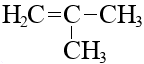 = =г) нагревание 3,5-диметилбензойной кислоты с водным раствором KMnO4. 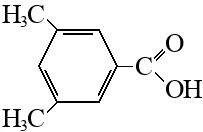 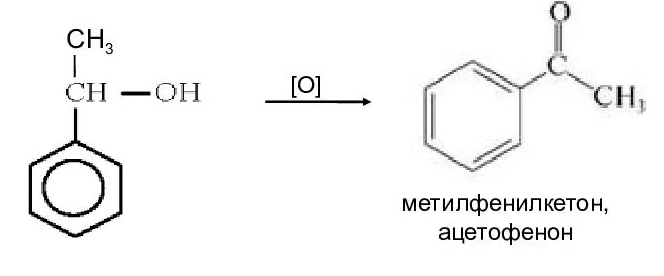 3,5-диметилфенилкетон Вариант 7 Задача №1 Для получения товарного масла смешали две масляные фракции в соотношении 1:3 (по объёму). Их относительные плотности равны соответственно 0,8793 и 0,8576. Найти ρ420 смеси. Дано: V1: V2=1:3 ρ1=0,8793 кг/дм3=879,3 кг/м3 ρ2=0,8576 кг/дм3=857,6 кг/м3 –––––––––––––––––––––– ρ420 – ? Решение: Пусть объем первой масляной фракции равен 1 м3, объем второй масляной фракции равен 3 м3. Формула относительной плотности: масса первой масляной фракции равна : m1= ρ1* V1=879,3*1=879,3кг масса второй масляной фракции равна : m2= ρ2* V2=857,6*3=2572,8кг ∑ m = m1+ m2=879,3+2572,8=3452,1кг ∑V= V1+V2=1+3 =4м3. Тогда: Ответ: ρ420 =0,863кг/л Задача №2 В резервуар закачали 50 м3 бензина А-80 при температуре 5о С. Бензин А-80 имеет плотность при 20 о С 745 кг/м3 . При снижении температуры до – 5 о С. изменится ли объём бензина . Дано: V1 =50 м3 t1 =5о С ρ420 =745 кг/м3 t2 = – 5о С –––––––––––––––––––––– ΔV – ? Решение: Зависимость плотности нефти и нефтепродукта от температуры основана на линейном законе (с повышением температуры их плотность снижается): где Значения температурной поправки даны в Прил. 1. при t1 =5о С γ1=(9,448+8,914)/2=9,181 при t1 = -5о С γ2=(10,031+9,448)/2=9,7395 Масса бензина А-80 не меняется. m= ρ45* V1=50*882,175=44135,75кг Объем бензина при t2 = – 5о С V2 = m/ ρ4-5 =44135,75/988,4875=44,65м3 Изменение объема: Δ V = V2 – V1 =50 – 44,65= -5,35м3 Ответ: объём бензина уменьшится на 5,35м3. ЗАДАЧИ Задача №1.1 Ароматический концентрат представляет собой смесь, состоящую из 120 кг бензола,75 кг толуола,25 кг этилбензола. Найти массовый и молярный состав смеси. Дано: m1=120 кг m2=75 кг m3=25 кг M1(С6Н6)=78,11 г/моль M2(С7Н8)= 92,14 г/ моль M3(С8Н10)= 106.167 г/моль –––––––––––––––––––––– wi – ?; хi– ? Решение: Найдем общую массу смеси m=m1+m2+m3=120+75+25=220 кг. Определим массовую долю каждой фракции: Молярная (мольная) доля Аналогично массовой доле Пересчет массового состава в молярный и обратный пересчет осуществляются по формулам: где Mi – молярная масса компонента, кг/моль. 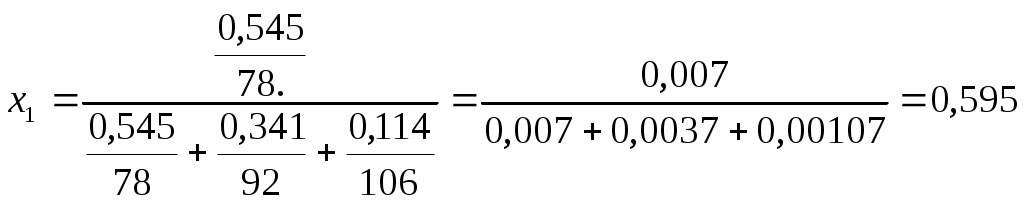 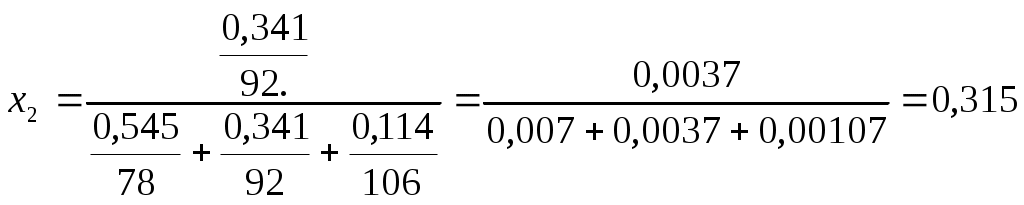  где Mi – молярная масса компонента, кг/моль. Ответ: Массовый состав смеси: Молярный состав смеси Задача №1.2 Для приготовления пробы товарного бензина смешали в соотношении 1:1 по массам прямогонную бензиновую фракцию (М=113 кг/кмоль, ρ=732 кг/м3) и бензин каталитического риформинга (М=106 кг/кмоль, ρ=791 кг/м3). Определить молярный и объемный состав полученной смеси. Дано: m1: m2=1:1 М1=113 кг/кмоль ρ1=732 кг/м3 М2=106 кг/кмоль Ρ2=791 кг/м3 –––––––––––––––––––––– φ i – ?; хi – ? Решение: Пусть массы каждого бензина равны 1 кг. m1=m2=1 кг Тогда V1 = 1/732 = 0,001366 м3, V2 = 1/791 = 0,001264 м3 ∑V= 0,001366 + 0,001264 = 0,00263 м3. Объемный состав полученной смеси: φ1 = V1/ ∑V=0,001366/0,00263 = 0,52 или 52%. φ2 = V2/ ∑V= 0,001264/0,00263 = 0,48 или 48% Количество вещества бензинов: n1 = m1/М1=1/113 = 0,00885 кмоль, n2 = m2/М2== 1/106 = 0,00943 кмоль. M(смеси) = ∑m/∑М=2/(0,00885 + 0,00943) = 109,41 кг/кмоль Молярный состав полученной смеси: Мольная доля ni какого-либо компонента смеси определяется как отношение числа киломолей Ni данного компонента к общему числу киломолей N смеси: х1 = n1/( n1+ n2)= 0,00885/(0,00885+0,00943)= 0,484 или 48,4% х2 = n2/( n1+ n2)= 0,00943/(0,00885+0,00943)= 0,5158 или51,6% Ответ: Объемный состав полученной смеси: φ1= 52%; φ2 = 48% Молярный состав полученной смеси х1 = 48,4%;х2 =51,6% Задача №1.3 Дана смесь двух нефтяных фракций. Объем первой фракции V1=36 м3, ее плотность ρ1=802 кг/м3, соответственно для второй фракции V2=76,5 м3, ρ2=863 кг/м3. Найти массовую долю каждой фракции. Дано: V1=36 м3 ρ1=802 кг/м3 V2=76,5 м3 ρ2=791 кг/м3 –––––––––––––––––––––– w i – ? Решение: Масса первой фракции: m1= V1* ρ1=36*802=28872 кг Масса второй фракции: M2= V2* ρ2=76,5*863=66019,5кг Найдем общую массу смеси m=m1+m2+m3=28872+66019,5+25=94891,5 кг. Определим массовую долю каждой фракции: Массовый состав смеси: Задача №1.4 Массовое содержание изо-октана в эталонной смеси – 70%, н-гептана – 30%. Определить молярные доли компонентов Дано: w1=70% М1= 114,23 кг/кмоль w2=30% М2=100,21 кг/кмоль –––––––––––––––––––––– хi – ? Пусть масса смеси равна 1 кг. m1= 1*70/100=0,7 кг m2=1*30/100=0,3 кг Количество вещества компонентов: n1 = m1/М1=0,7/114,23 = 0,00613 кмоль, n2 = m2/М2== 0,3/100,21 = 0,003кмоль. ∑n = n1 + n2 =0,00613+0,003=0,00913кмоль Молярный состав полученной смеси: Мольная доля ni какого-либо компонента смеси определяется как отношение числа киломолей Ni данного компонента к общему числу киломолей N смеси: х1 = n1/( n1+ n2)= 0,00613/0,0913= 0,671 или 67,14% х2 = n2/( n1+ n2)= 0,003/0,0913= 0,3286 или 32,86% Ответ: Молярный состав полученной смеси х1 = 67,14%;х2 =32,86% Задача №1.5 Углеводородный газ, служащий бытовым топливом, имеет следующее массовое содержание углеводородов: этан – 2%, пропан – 76%, бутаны – 21%, пентаны – 1%. Рассчитать молярное содержание компонентов в газовой смеси. Дано: w1=2% М1= 30 кг/кмоль (этан) w2=76% М2=44 кг/кмоль (пропан) w3=21% М3= 58 кг/кмоль (бутан) w4=1% М4=72 кг/кмоль(пентан) –––––––––––––––––––––– φ i – ?; хi – ? Решение: Пусть масса смеси равна 100 кг. m1= 100*2/100=2 кг m2=100*46/100=46 кг m3= 100*21/100=21 кг m4=100*1/100=1 кг Количество вещества компонентов: n1 = m1/М1=2/30 = 0,0667 кмоль, n2 = m2/М2== 46/44=1,045 5кмоль. n3 = m3/М3== 21/58 = 0,3621кмоль. n4 = m4/М4== 1/72 = 0,0139кмоль. ∑n = n1 + n2 +n3 + n4 =0,0667+1,0455+0,3621+0,0139=1,4882кмоль Молярный состав полученной смеси: х1 = n1/∑n=0,0667/1,4882= 0,0448 или 4,48% х2= n2/∑n=1,0455/1,4882= 0,7025или 70,25% х3 = n3/∑n=0,3621/1,4882= 0,2433 или 24,33% х1 = n1/∑n=0,0139/1,4882= 0,0093 или 0,94% Ответ: Молярное содержание компонентов в газовой смеси: этан – 4,48%, пропан – 70,25%, бутаны – 24,33%, пентаны – 0,94%. Задача №1.6 Природный газ Северного месторождения состоит из следующих компонентов (в объемных процентах): СН4 – 96,8; С2Н6 – 0,9; С3Н8 – 0,4; С4Н10 – 0,3; N2 – 1,0; О2 – 0,6. Найти массовый состав смеси. Дано: φ1=96,8% М1= 16 кг/кмоль (метан) φ2=0,9% М2= 30 кг/кмоль (этан) φ3=0,4% М3=44 кг/кмоль (пропан) φ4=0,3% М4= 58 кг/кмоль (бутан) φ5=1% М5=28 кг/кмоль(азот) φ6=0,6% М6=32 кг/кмоль(кислород) –––––––––––––––––––––– wi– ? Метан СН4 16г/моль 96,8% В одном моле его будет 16*0,968=15,488 г. Этан С2Н6 30 гр/моль 0,9% 30*0,009=0,27 г. пропан С3Н8 44 г/моль 0,4% 44*0,004=0,176 г. бутан С4Н10 58 г/моль 0,3 % 58*0,03=0,174 г. азот N2 28 г/моль 1,0 % 28*0,01 =0,28 г. кислород О2 32 г/моль 0,6 % 32*0,006 =0,192 г. Масса моля газа =15,488+0,27+0,176+0,174+0,28+0,192=16,58 г Массовые доли газов: метан 15,488/16,58= 0,9341 = 93,41% этан 0,27/16,58= 0,063 = 1,63 % пропан 0,176/16,58= 0,0106 = 1,06 % бутан 0,174/16,58= 0,0105= 1,05 % азот 0,28/16,58= 0,0169= 1,69% Кислород 0,192/16,58=0,01158=1,16% Ответ: Природный газ Северного месторождения состоит из следующих компонентов (в массовых процентах): СН4 – 93,41; С2Н6 – 1,63; С3Н8 – 1,06; С4Н10 – 1,05; N2 – 1,69; О2 – 1,16 Задача №1.7 При каталитическом крекинге масляной фракции получены продукты:
Определить молярные доли компонентов. Решение: Пусть масса смеси равна 100 кг. Расчетная таблица
Задача №1.8 Дана смесь двух бензиновых фракций самотлорской нефти, имеющих следующие характеристики:
Найти среднюю молярную температуру кипения смеси. Решение: Пусть масса смеси равна 100 кг. Среднюю молярную температуру кипения сырья можно найти по формуле: tср.м = Σxi*ti xi - молярная доля компонентов ti – средние арифметические температуры кипения узких фракций.
Ответ: средняя молярная температуру кипения смеси–124,4°С Задача №1.9 Определить молярную температуру кипения масляного погона, если известен его состав:
Решение: Среднюю молярную температуру кипения сырья можно найти по формуле: tср.м = Σxi*ti xi - молярная доля компонентов ti – средние арифметические температуры кипения узких фракций. Расчетная таблица
Ответ: молярная температура кипения масляного погона 441,6°С Задача №1.10 Имеется смесь двух нефтяных фракций:
Найти объемный состав и среднюю молярную температуру кипения смеси . Решение: Среднюю молярную температуру кипения сырья можно найти по формуле: tср.м = Σxi*ti xi - молярная доля компонентов ti – средние арифметические температуры кипения узких фракций. Для пересчета объемного состава в массовый и обратно необходимо знать плотность  ; ;Среднюю молярную температуру кипения сырья можно найти по формуле: tср.м = Σxi*ti xi - молярная доля компонентов ti – средние арифметические температуры кипения узких фракций. Расчетная таблица
Ответ: средняя молярная температуру кипения смеси 211,5°С; объемный состав: 1 фракции – 33,3%; 2 фракции – 66,7%. |
