Расчетка 1. Задача 1 задача 2
 Скачать 48.42 Kb. Скачать 48.42 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Казанский национальный исследовательский технологический университет» Кафедра теоретических основ теплотехники (ТОТ) Расчетное задание №1 «Смеси идеальных газов. Термодинамические процессы с идеальным газом» Вариант №72 Выполнила: студентка гр. 5121-П Кириллина Ю. С. Проверил: к.т.н., доц. каф. ТОТ Мухамадиев А. А. Казань 2014 Содержание Введение………………………………………………………………………………...…….3 Задача 1 ………………………………………………………………………………...……..4 Задача 2……………………………………………………………………………..…………7 Вывод…………………………………………………………………………………………12 Список литературы…………………………………………………………………………..13 Введение Работа посвящена основным понятиям и законам термодинамики. В первой задаче показывается умение работы со смесью идеальных газов, во второй - с термодинамическими процессами с идеальным газом. Идеальный газ – это модель реального газа, в котором отсутствует межмолекулярное взаимодействие и размерами молекул можно пренебречь по сравнению с размерами межмолекулярного пространства. Понятие идеального газа введено для удобства расчетов параметров состояния. Рабочим телом тепловых машин часто являются смеси различных газов. Если компоненты смеси не вступают в химическую реакцию друг с другом, и каждый компонент смеси подчиняется уравнению состояния идеального газа, то такая смесь может рассматриваться как некоторый новый идеальный газ, для расчетов с которым необходимо знать его среднюю (кажущуюся) молярную массу или удельную газовую постоянную смеси. Расчетное определение этих величин возможно, если задан состав смеси. Состав смеси задают объемными (молярными) или массовыми долями. Каждый компонент смеси ведет себя независимо от других, т.е. занимает весь объем, в котором заключена смесь, и оказывает свое, так называемое парциальное, давления на стенки сосуда. Температура всех компонентов смеси одинакова и равна температуре смеси. Теплоемкостью тела называют количество теплоты, необходимое для изменения ее температуры на 1К. В зависимости от того, в каких единицах задано количество теплоты вещества, в расчетах используют массовые, объемные или молярные удельные теплоемкости. Теплоемкость идеального газа зависит от характера процесса подвода/отвода теплоты, от атомности газа и температуры. Теплоемкость в процессе при постоянном давлении называется изобарной, а в процессе при постоянном объеме – изохорной. Термодинамический процесс можно наглядно изобразить на P-V и T-S диаграммах. Задача 1. Для газовой смеси, заданной объемными долями, требуется определить массовый состав смеси, среднюю (кажущуюся) молекулярную массу смеси через объемные и массовые доли, газовые постоянные компонентов и смеси, плотность смеси при заданных и нормальных условиях, средние мольную, объемную и массовую теплоемкости смеси при р=const и v=const в интервале температур от t1 до t2, а также затраты тепла на нагрев при р=const 10нм3 и 10кг смеси в интервале температур от t1 до t2. Зависимость теплоемкости от температуры считать нелинейной.
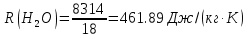 ; ;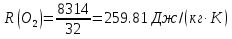 ; ;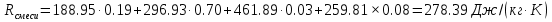 ; ;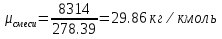 . .Плотность смеси определяют по уравнению состояния идеального газа: 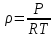 ; ;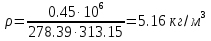 . .При физических нормальных условиях (Т=273К, Р=101325Па) 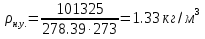 . .Из справочной таблицы выписываем средние изобарные мольные теплоемкости:
Средние изобарные мольные теплоемкости при заданных температурах находим методом интерполяции: 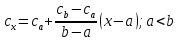 ; ;Для t1=40°C 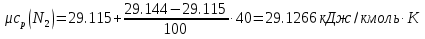 ; ;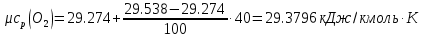 ; ;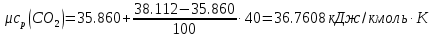 ; ;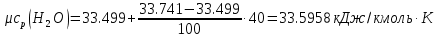 ; ;Для t2=380°C 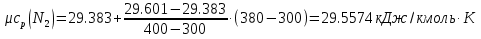 ; ;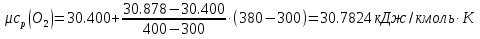 ; ;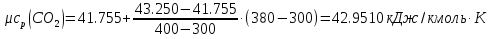 ; ;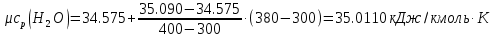 . .Средняя теплоемкость находится по формуле: 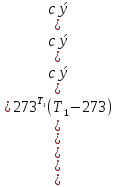 ; ;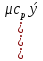 ; ;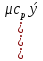 ; ;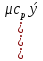 ; ;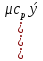 . .Мольная теплоемкость смеси находится по формуле: 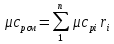 ; ;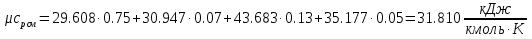 ; ;Массовую теплоемкость находим из соотношения: 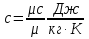 ; ; 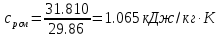 ; ;Объемная теплоемкость находится из соотношения: 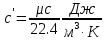 ; ;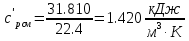 ; ;Мольную изохорную теплоемкость можно найти из уравнения: 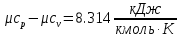 ; ;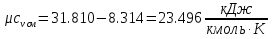 . .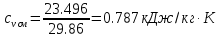 ; ;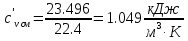 . .Количество теплоты находится по уравнению: 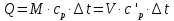 ; ;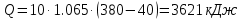 . .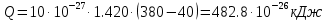 . .Задача 2. Газ массой m имеет начальные параметры – давление P1 и температуру t1. После политропного изменения состояния параметра газа стали P2 и V2. Определить характер процесса (сжатие или расширение), конечную температуру t2, показатель политропы n, теплоемкость процесса С, работу, тепло, изменение внутренней энергии, энтальпии и энтропии. Определить эти же параметры, а также конечное давление P2, если изменение состояния до того же конечного объема V2 происходит: а) по адиабате; б) по изотерме. Изобразить (без расчета) все процессы в PV и TS диаграммах. Составить сводную таблицу результатов расчета. Теплоемкость газа считать постоянной.
Температуру t2 определяют по формуле: 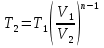 ; ;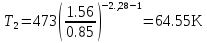 ; ;Теплоемкость политропного процесса определяется по формуле: 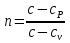 ; ; 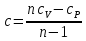 ; ;По таблице теплоемкости для многоатомного газа 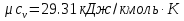 ; ;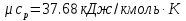 . .Связь между молярной и массовой теплоемкостью: 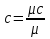 ; ;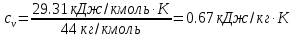 ; ;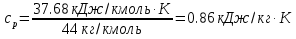 ; ;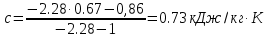 . .Для удобства дальнейших расчетов найдем показатель адиабаты k: 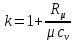 ; ;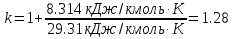 . .Работа сжатия газа:  ; где ; где  – удельная работа – удельная работа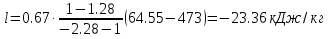 ; ;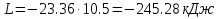 . .Общее количество теплоты, подведенное к системе, определяется по формуле: 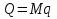 ; где ; где 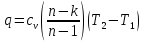 – удельное количество теплоты. – удельное количество теплоты.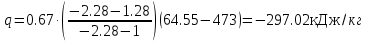 ; ;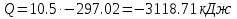 . .Изменение внутренней энергии определяют по формуле: 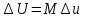 ; где ; где 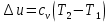 – изменение удельной внутренней энергии. – изменение удельной внутренней энергии.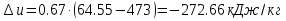 ; ;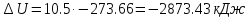 . .Изменение энтальпии определяют по формуле: 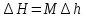 ; где ; где 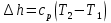 – изменение дельной энтальпии – изменение дельной энтальпии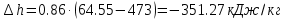 ; ;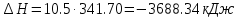 . .Изменение удельной энтропии в политропном процессе определяют по формуле: 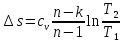 ; ;Изменение энтропии определяется по формуле: 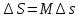 . .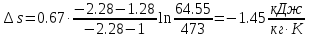 ; ;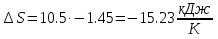 . .Адиабатный процесс – процесс без изменения энтропии. Уравнение адиабаты называют уравнением Пуассона: 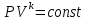 ; ;Показатель адиабаты k был вычислен ранее. k=1.28 Давление P2 можно найти через связь между параметрами состояния в адиабатном процессе: 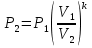 ; ;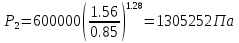 . .Температуру Т2 определяем по отношению: 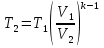 ; ;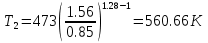 . .По первому закону термодинамики, при отсутствии теплообмена с окружающей средой работа адиабатного процесса осуществляется за счет внутренней энергии: 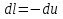 . .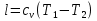 ; ;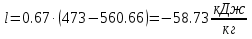 ; ;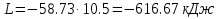 . .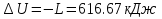 . .В адиабатном процессе ds=0, следовательно dq=ds∙T=0. ΔS=0, ΔQ=0 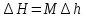 ; где ; где 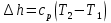 – изменение дельной энтальпии – изменение дельной энтальпии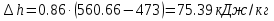 ; ;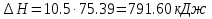 . .Изотермный процесс – процесс, проходящий при постоянной температуре. Уравнение изотермы: 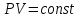 . .Давление P2 можно найти через связь между параметрами состояния в изотермном процессе: 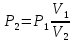 ; ;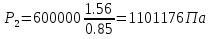 ; ;Т2=T1=473 К В случае постоянства температуры в процессе внутренняя энергия и энтальпия остаются постоянными ΔU=0; ΔH=0 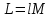 ; где ; где 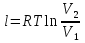 – удельная работа изотермного процесса. – удельная работа изотермного процесса.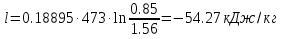 ; ;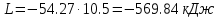 . .По первому закону термодинамики dU=dQ-dL. Т.к. dU=0, dQ=dL 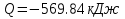 . .Изменение энтропии изотремного процесса: 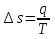 ; ;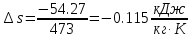 ; ;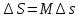 ; ;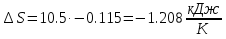 . .Сводная таблица результатов расчета:
Вывод Зная молярные (или массовые) доли компонентов смеси, можно вычислить основные параметры состава смеси: среднюю (кажущуюся) молярную теплоемкость, газовую постоянную, плотность, удельный объем, парциальное давление компонентов. Зная одну из удельных теплоемкостей (массовую, молярную, объемную, изобарную или изохорную), можно рассчитать другие. Если зависимость теплоемкости от температуры нелинейная, то средняя теплоемкость определяется в интервале температур. Рассчитав показатель политропы, можно определить, к какому термодинамическому процессу относится данный процесс. Также его можно определить графически, по P-V и T-S диаграммам. Список литературы
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

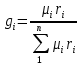 ;
; 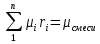 , μi – молярная масса компонента смеси, ri – объемная доля компонента смеси
, μi – молярная масса компонента смеси, ri – объемная доля компонента смеси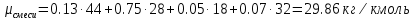 ;
;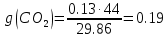 ;
;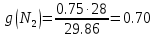 ;
;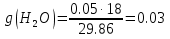 ;
;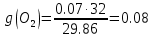 .
.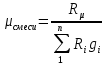 ;
; 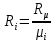 – удельная газовая постоянная,
– удельная газовая постоянная, 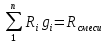
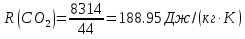 ;
;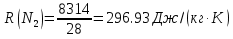 ;
;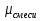 – ?
– ?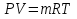 ;
;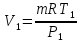 ; где
; где 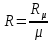 – удельная газовая постоянная СО2.
– удельная газовая постоянная СО2.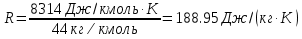 ;
;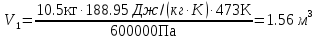 .
.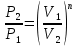 ;
; 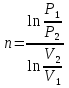 ;
;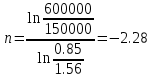 ;
;