Теор-решения. Задача 91 (автор Жиров А. И.)
 Скачать 0.95 Mb. Скачать 0.95 Mb.
|
|
Система оценивания 1. За определение вещества А 1 балл За 3 реакции (растворение фосфора, осаждение фосфата, реакция нейтрализации) – по 0,5 б всего 1,5 балла За растворимость фосфата серебра в кислой среде 0,5 балла. За молибденовую жидкость 1 балл. За реакцию с молибденовой жидкостью 1 балл. 2. За вещество В 1 балл. За степень окисления 1 балл. За 4 реакции – по 0,5 б, всего 2 балла. 3. За вещество С 2 балла. За 5 реакций – по 0,5 б, всего 2,5 балла. За цинк с соляной кислотой 0,5 балла 4. За определение вещества D 2 балла За подтверждение вещества D 2 балла. Уравнения реакций 2 балла Итого – 20 баллов Задача 11-3 (автор Ерёмин В. В.) 1. 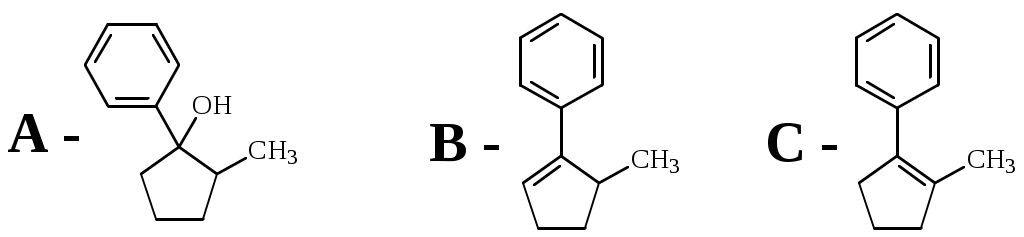 2. При равновесии скорость прямой элементарной реакции равна скорости обратной реакции: Константа равновесия имеет вид: Из условия равенства скоростей находим: 3. Вещество B образуется в первой прямой реакции и расходуется в обратной ей реакции: Аналогичное уравнение имеет место для вещества С: а) В начале реакции можно пренебречь обратными реакциями, и кинетические уравнения упрощаются: 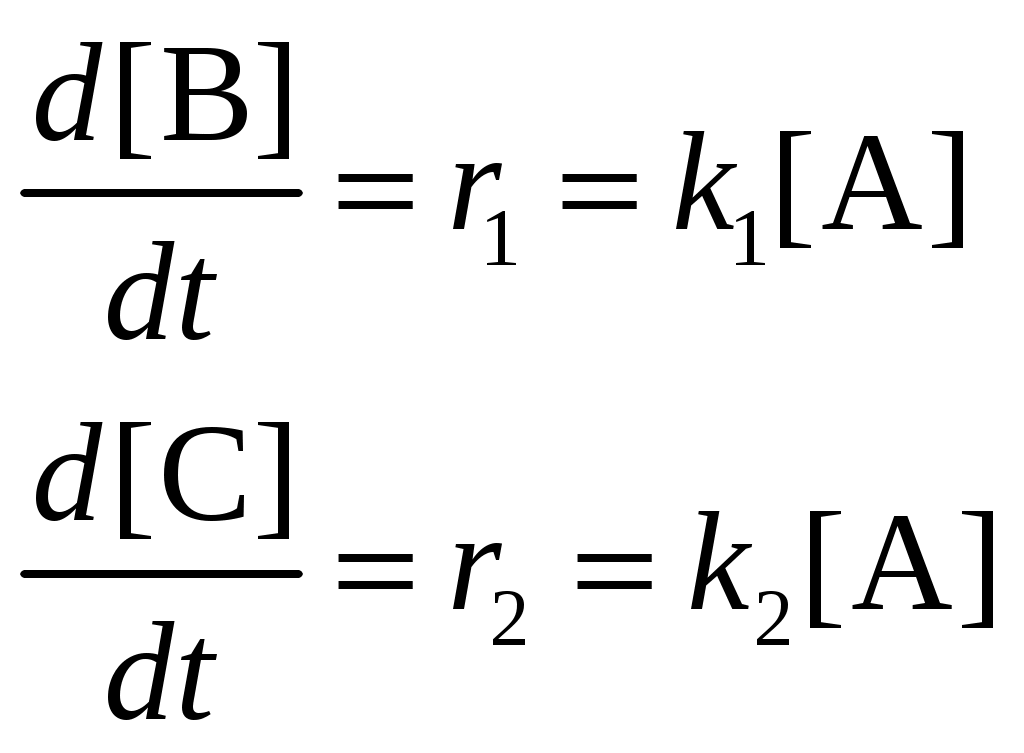 Поделив одно уравнение на другое, убеждаемся, что отношение количеств продуктов в начале реакции определяется константами скорости (кинетический контроль): б) При равновесии концентрации реагентов и продуктов связаны выражениями для констант равновесия: 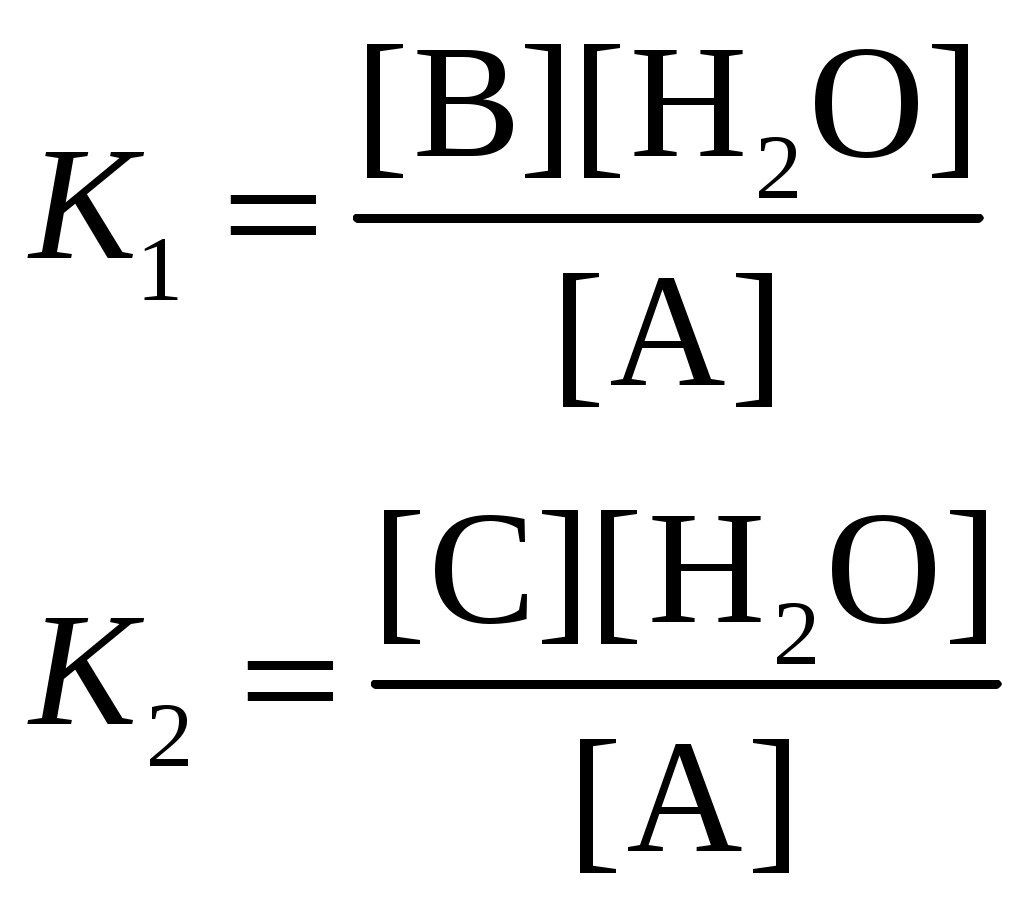 Поделив одно уравнение на другое, находим, что отношение количеств продуктов в конце реакции определяется константами равновесия (термодинамический контроль): 4. Правило Зайцева утверждает, что в реакциях элиминирования преимущественно образуется более замещённый алкен, в данном случае – С. В этой системе правило Зайцева определяется термодинамическим контролем, то есть устойчивостью продуктов реакции. 5. Обозначим энергии активации первой и второй прямых реакций E1 и E2. Из уравнения Аррениуса следует: Запишем это соотношение два раза: при температурах T1 и T2 и вычтем первое из второго. Тогда константа сократится, и получим: 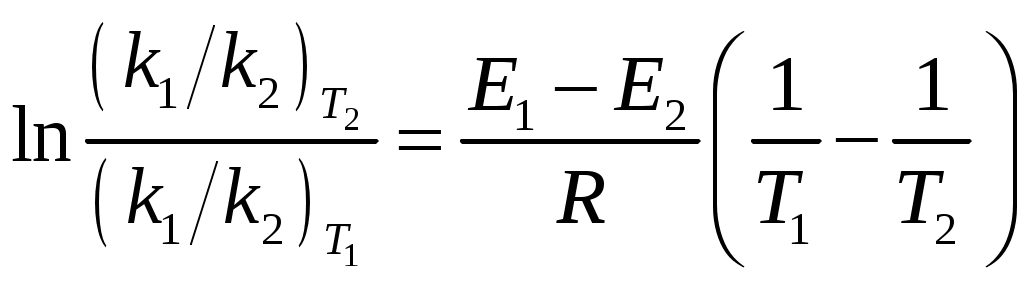 По условию, при T1 = 333 К k1 / k2 = [B] / [C] = 55/45 при T2 = 343 К k1 / k2 = [B] / [C] = 50/50 Подставляя эти значения в последнюю формулу, находим: E1 = E2 – 19 = 61 кДж/моль. Аналогичные расчёты, но с термодинамическими величинами, можно провести для равновесных концентраций. Обозначим энтальпии первой и второй прямых реакций H1 и H2. Из зависимости константы равновесия от температуры следует: Запишем это соотношение два раза: при температурах T1 и T2 и вычтем первое из второго. Тогда константа сократится, и получим: 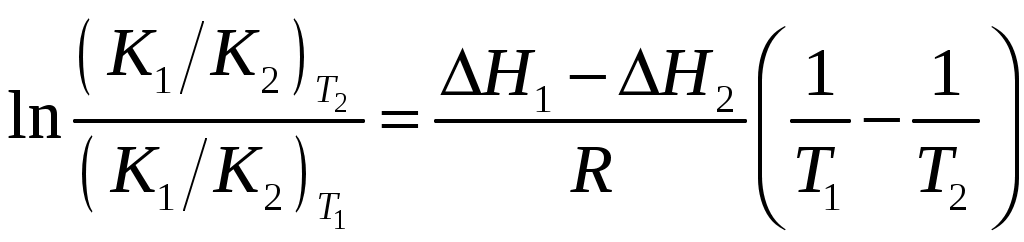 По условию, при T1 = 333 К K1 / K2 = [B] / [C] = 9/91 при T2 = 343 К K1 / K2 = [B] / [C] = 11/89 Подставляя эти значения в последнюю формулу, находим: H= H1 – H2 = 21 кДж/моль. Система оценивания. 1. 3 балла (по 1 за каждую структуру) 2. 2 балла 3. 6 баллов (2 за точные кинетические уравнения, по 2 за пункты (а) и (б)) 4. 3 балла (1 за правильный ответ, 2 – за объяснение) 5. 6 баллов (по 3 балла за энергию активации и энтальпию, из них 2 балла за вывод формулы, еще 1 за расчет) Итого 20 баллов Задача 11-4 (автор Будынина Е. М.) 1. Молярная масса этого соединения равна 61,7 г/моль, если оно содержит одну этильную группу и 123,4 г/моль, если таких групп две. Первый ответ невозможен, т. к. молярная масса цинка больше, чем 61,7. Второй ответ соответствует молекуле диэтилцинка, Et2Zn. 2. Содержание углерода и водорода в Х вместе составляет 81,8 %. Это заставляет предположить, что цинк в молекуле Х отсутствует, а оставшиеся 18,2 % приходятся на кислород. Тогда молекулярная формула Х: С5Н12О. Это соединение образуется из этилового эфира муравьиной кислоты (HCO2C2H5) и диэтилцинка, генерируемого insitu из цинка и этилиодида. Пять атомов углерода в Х могут оказаться двумя путями: а) 3 атома углерода из этилформиата и 2 атома из диэтилцинка; б) 1 атом из этилформиата и 4 атома из диэтилцинка. В первом случае молекула Х должна содержать также два атома кислорода, что не соответствует рассчитанной молекулярной формуле. Второй вариант реализуется, если несущий частичный отрицательный заряд атом углерода из диэтилцинка атакует по несущему частичный положительный заряд карбонильному атому углерода, образовавшийся интермедиат отщепляет алкоголят цинка с образованием пропионового альдегида, который реагирует далее со второй молекулой диэтилцинка. 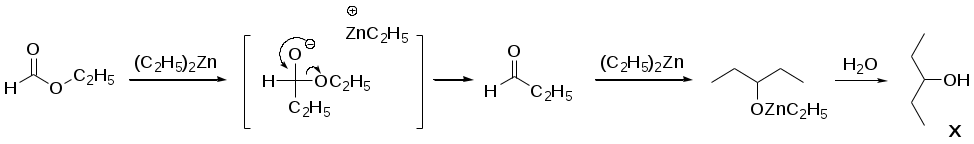 3. Из данных по содержанию в Y разных элементов можно определить молекулярную формулу Y как С9Н16O3. Учитывая ответ на предыдущий вопрос, можно сделать вывод, что диэтилцинк реагирует только по одной сложноэфирной группе: 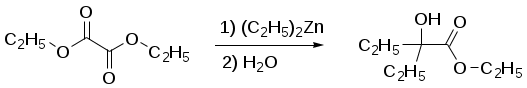 4. Молекулярный пик галогеналкана А проявляется в виде дублета в соотношении 1 : 1. Это говорит о том, что один из атомов, присутствующих в молекуле, имеет два изотопа, причем их содержание в природе равно примерно 1 : 1. Из четырех галогенов, углерода и водорода такое распределение имеет только бром. Молекулярная формула А: СnH2n+1Br. Тогда 12n / (14n + 81) = 0,22. Отсюда n = 2. Вещество А – этилбромид. При его реакции с магнием теоретически может образоваться два продукта: диэтилмагний (аналогично реакции с цинком) или этилмагнийбромид. Как известно, реактивы Гриньяра – это алкилмагнийгалогениды. Это можно определить и из данных по содержанию в В водорода: значение, данное в условии, согласуется с формулой C2H5MgBr, но не с формулой (C2H5)2Mg. Когда реактив Гриньяра вылили на сухой лед, прошла реакция C2H5MgBr с СО2 с образованием C2H5СО2– MgBr+, а после нейтрализации выделили соответствующую кислоту С. Если сухой лед добавлять к избытку C2H5MgBr, образующаяся соль реагирует далее. После гидролиза выделяется диэтилкетон (D). Реакция этилбромида с водной щелочью дает этанол (F), который при нагревании с пропионовой кислотой в присутствии H2SO4 превращается в этилпропионат G. 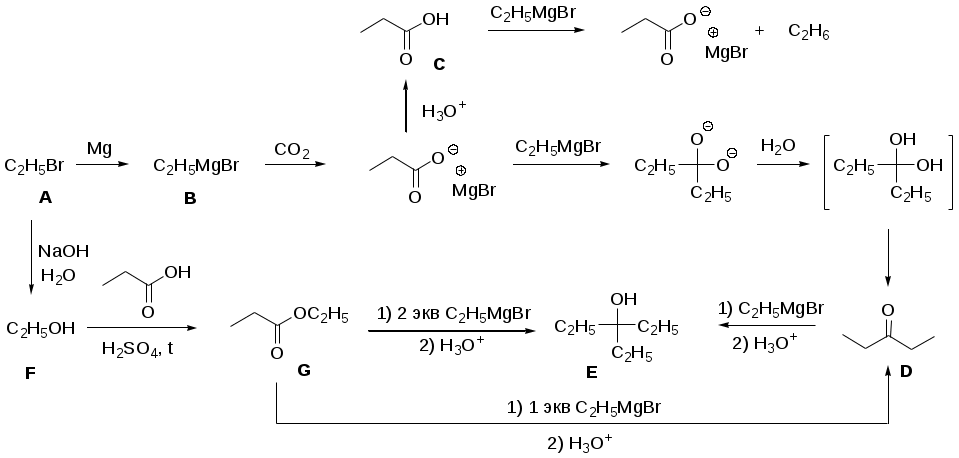 Система оценивания: 1. 2 балла. 2. 2 балла 3. 2 балла 4. 7 структур по 2 балла. Всего 14 баллов. Итого 20 баллов. Задача 11-5 (авторы Белый Т. С., Бачева А. В.) Вопрос 1а. Можно отметить несколько основных факторов, которые реализуются при связывании субстрата ферментом и образования так называемого фермент-субстратного комплекса: это факторы сближения реакционных групп, их фиксации и ориентации. Эти факторы в конечном итоге изменяют путь реакции, так как реакция идет через другие переходные состояния, и понижают энергию активации. Вопрос 1б. Уравнение протекающей реакции: H2O2 H2O + 1/2O2, отношение скоростей можно рассчитать из отношения констант скоростей: k (с платиной) / k(без катализатора) = exp(–12·4,184·103/RT) / exp(–18·4,184·103/RT) = 2,36·104. Поскольку энергия активации находится в показателе степени, следовательно, изменение энергии активации всего на 6 ккал/моль приводит к изменению скорости реакции разложения перекиси более чем на 4 порядка при катализе мелкодисперсной платиной, и еще на k (с ферментом) / k(с платиной) = exp(–5,6·4,184·103/RT) / exp(–12·4,184·103/RT) = 4,62·104, т. е. более чем на 4 порядка при действии фермента. Вопрос 2 Частичный гидролиз будет приводить к разрыву какой-нибудь одной связи в исходном пептиде после аргинина или лизина, таким образом, получатся следующие пептиды: Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys Arg-Ala-Leu-Gly-Lys Ala-Arg-Gly-Gly-Lys Arg-Ala-Leu-Gly-Lys-Ala-Arg Gly-Gly-Lys и аминокислота аргинин. Гидролиз может быть неполным, если его остановить, убрав ферментативную активность. Для этого, например, можно 1) добавить вещество, инактивирующее фермент, или 2) разрушить сам фермент, а) изменив рН добавлением кислоты, либо б) нагреванием. Вопрос 3. Нет, трипсин не будет гидролизовать связи после модифицированного лизина, поскольку в узнавании субстрата ферментом важны именно боковые группы аминокислот, в том числе их размер и заряд. А при модификации изменяется и то, и другое. Вопрос 4. а) реакция лизина с динитрофторбензолом будет протекать как по α-, так и по ε-аминогруппе: 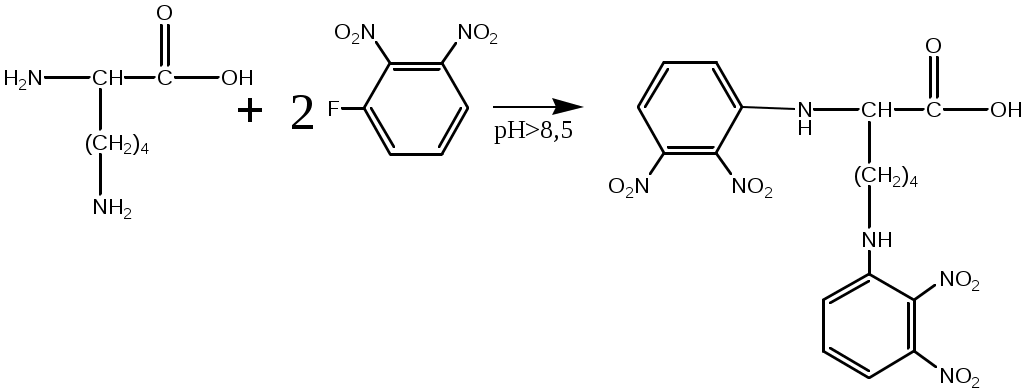 б) реакция лизина с альдегидами приводит к образованию основания Шиффа и тоже протекает по двум аминогруппам: 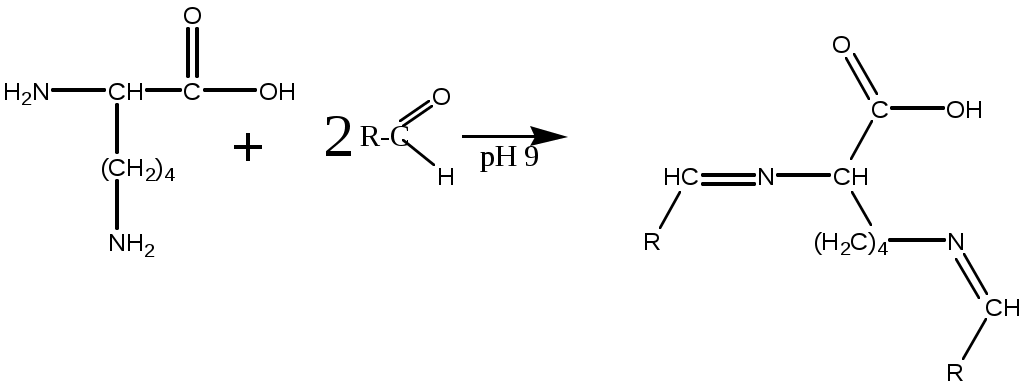 в) реакция с малеиновым ангидридом в слабощелочной среде: 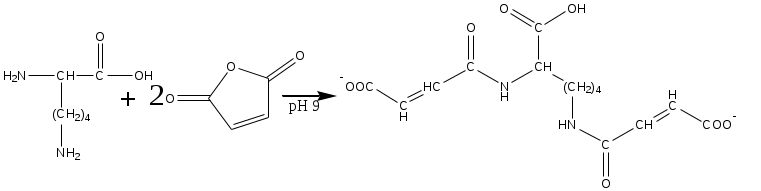 г) реакция с C2H5-S-CO-CF3, S-этил-трифторацетатом: 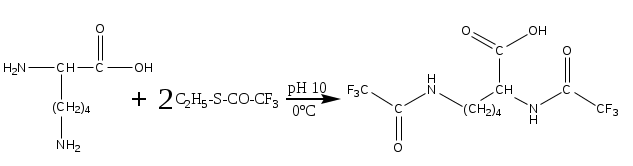 д) реакция карбамоилирования: 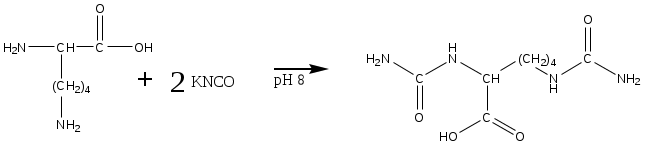 е) реакция гуанидирования: 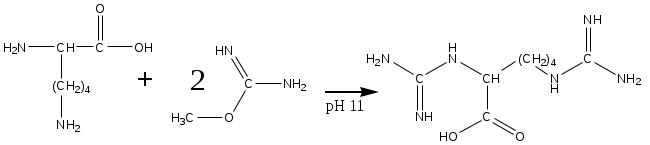 Вопрос 5. После модификации лизинов фермент перестает их «узнавать», поэтому состав полученных пептидов изменится, и будет выглядеть следующим образом: Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys Arg-Ala-Leu-Gly-Lys-Ala-Arg Gly-Gly-Lys и аминокислота аргинин. Вопрос 6. Исходя из того, что трипсин гидролизует связи после аргинина и лизина, в его центр связывания могут входить аспарагиновая кислота или глутаминовая кислота, отрицательно заряженные боковые группы которых будут образовывать электростатические контакты с положительно заряженными боковыми группами субстрата. Вопрос 7. Поскольку вещество А дает реакцию серебряного зеркала, значит это альдегид. С учетом известной доли углерода, и предполагая, что число атомов углерода при реакции не изменилось, можно рассчитать молекулярную массу вещества А: M (A) = 12·8/0,7164 = 134 (г/моль). Следовательно, это не просто альдегид, а дикарбонильное соединение, то есть фенилглиоксаль: 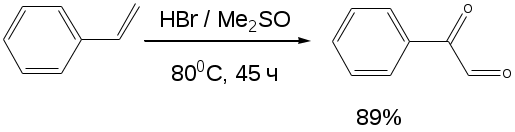 При взаимодействии фенилглиоксаля с аргинином, карбонилы реагируют с гуанидо-группой аргинина: 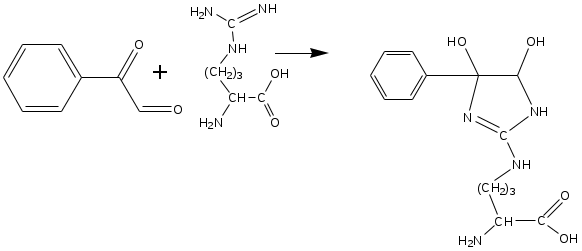 получающееся вещество не очень устойчиво, и его можно стабилизировать добавлением борной кислоты: 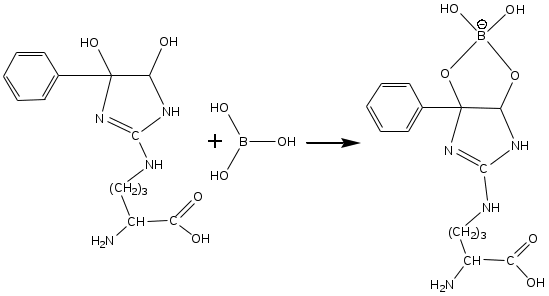 Система оценивания: Вопрос 1а). 1 балл Вопрос 1б). 2 балла Вопрос 2а).2 балла Вопрос 2б). 1 балл Вопрос 3. 1 балл Вопрос 4. 6 баллов, по одному баллу за каждую реакцию Вопрос 5. 2 балла Вопрос 6. 2 балла Вопрос 7. 3 балла Итого 20 баллов |
