итоговые. Задача из раздела 1 1
 Скачать 19.7 Kb. Скачать 19.7 Kb.
|
|
Задача из раздела 2.1.1 №1 1. Из каких основных стадий состоит химико-технологический процесс? В каких стадиях химико- технологического процесса участвуют химические реакции? Химико-технологический процесс представляет собой совокупность операций, позволяющих получить целевой продукт из исходного сырья. Химико-технологический процесс включает три основные стадии: подготовка исходных реагентов к проведению химической реакции; химическое взаимодействие; разделение смеси продуктов (целевых, побочных, попутных) и непрореагировавших реагентов. На первой стадии – проводят операции, необходимые для подготовки исходных реагентов к проведению химической реакции: реагенты нагревают, поскольку скорость химических реакций сильно зависит от температуры; газообразное сырьё подвергают компримированию до определённого давления с целью повышения эффективности процесса и уменьшения размеров аппаратуры; исходное сырьё подвергают очистке от посторонних примесей методами, основанными на различии физических свойств (растворимость в различных растворителях, плотность, температуры конденсации и кристаллизации и т. д.). Используются и химические методы очистки, основанные на химических реакциях, в результате которых ненужные примеси превращаются в легко отделимые вещества. На второй стадии - подготовленные реагенты подвергают химическому взаимодействию, в большинстве случаев, состоящему из нескольких этапов (промежуточных стадий). Например, при производстве серной кислоты: диоксид серы частично окисляют до триоксида 2SO2 +O2 = 2SO3; охлаждают реакционную смесь; извлекают триоксид серы методом адсорбции и т.д. В результате химических реакций получают смесь продуктов (целевых, побочных, попутных) и непрореагировавших продуктов. Именно во второй стадии непосредственно участвуют химические реакции. На третьей стадии - проводят разделение этой смеси путём фильтрования, центрофугирования, ректификации, адсорбции и т.д., применяя гидромеханические, тепло- и массообменные процессы. Продукты реакции направляют на склад готовой продукции или на дальнейшую переработку. Непрореагировавшее сырьё вновь используют в процессе, организуя его рецикл. На всех этих этапах, а особенно на заключительных, проводят переработку вторичных материальных и энергетических ресурсов. Потоки газообразных и жидких веществ, попадающих в окружающую среду, подвергают очистке и обезвреживанию от опасных примесей. Твёрдые отходы либо направляют на дальнейшую переработку, либо размещают для хранения в безопасных для окружающей среды условиях. Задача из раздела 2.2.2 №5 2. Рассчитайте константу равновесия для реакции: СО2 + С = 2CO. Если известно, что для СО2 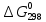 = -394572 и для СО = -394572 и для СО 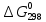 = -137334 Дж/моль. = -137334 Дж/моль.Решение: Рассчитаем энергию Гиббса для всей реакции: Если реакция протекаетв стандартных условиях при температуре 298К, расчёт её энергии Гиббса (стандартной энергии Гиббса реакции) можно производить аналогично расчёту стандартной теплоты реакции. Для нашей реакции формула имеет вид: ΔG°298 = (ΔG°298, o6p) - (ΔG0298, пр); 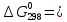 2 2 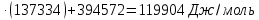 = 119,904 кДж/моль = 119,904 кДж/мольКонстанта химического равновесия зависит от природы реагентов, от температуры и связана с изменением стандартной энергии Гиббса 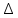 G° химической реакции уравнением: G° химической реакции уравнением: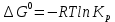 ; ;Отсюда находим, 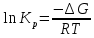 , где R = 8,31 (газовая постоянная), Т = 298К. , где R = 8,31 (газовая постоянная), Т = 298К.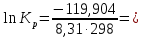 -0,0484 -0,0484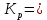 0,952 0,952Ответ: Константа равновесия для реакции: СО2 + С = 2CO, 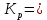 0,952 0,952Задача из раздела 2.3.1 №4 Что такое частный порядок реакции по компоненту J? Как взаимосвязаны частные порядки по разным компонентам и общий порядок реакции? Кинетическое уравнение необратимой элементарной реакции aA + bB → rR +sS в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид: 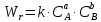 ; (1.1) ; (1.1) Коэффициент пропорциональности k, входящий в кинетическое уравнение (1.1) носит название константы скорости химической реакции. Целочисленные показатели степени a и b у концентраций реагентов А и В в кинетическом уравнении (1.1) для элементарной реакции называются частными порядками реакции по реагентам соответственно А и В, их сумма a+b=n общим порядком реакции. Если реакция описывается стехиометрическим уравнением (1) aA + bB = rR + sS, (I) Характеризуется различающимися частными порядками по компонентам А и В, наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в которой участвуют два реагента, имеет вид 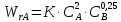 , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двукратное повышение концентрации реагента В приведёт к возрастанию скорости лишь в 1,19 раза , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двукратное повышение концентрации реагента В приведёт к возрастанию скорости лишь в 1,19 раза |
