задачи. Задачи с решениями
 Скачать 11.17 Mb. Скачать 11.17 Mb.
|
|
ОТВЕТ: а) Фактор V и фактор VIII – доменные белки, циркулирующие в крови. Фактор V синтезируется в печени, а фактор VIII – эндотелиальными клетками. Оба фактора активируются частичным протеолизом под действием тромбина (фактор IIа). Факторы Va и VIIIa служат белками-активаторами факторов VIIa и Xa. При связывании с белками-активаторами в результате конформационных изменений активность этих ферментов повышается. б) Существует 2 пути свертывания крови – прокоагулянтный (внешний) и контактный (внутренний). Для инициации реакций внешнего пути необходимо появление тканевого фактора (фактор III) на внешней поверхности плазматической мембраны клеток, соприкасающихся с кровью. Внутренний путь начинается с активации фактора XII при его контакте с поврежденной поверхностью эндотелия сосудов и взаимной активации ферментов прекалликреина и фактора XII. 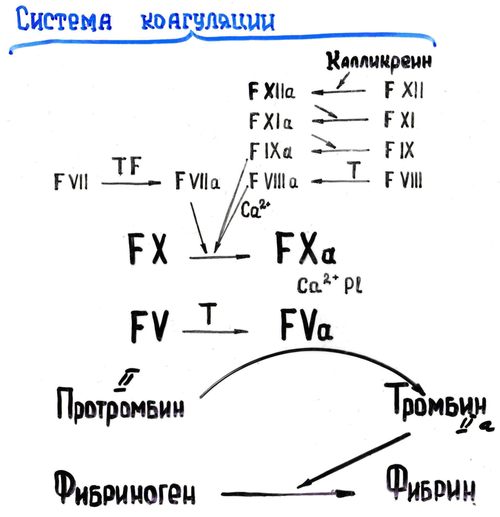 Рис. 82 Система коагуляции В прокоагулянтном и контактном путях свертывания крови последовательное образование мембранных ферментных комплексов активируется фактора Х и образуются протромбиназы. Этапы, одинаковые для обоих путей свертывания крови, называются общим путем свертывания крови. в) Протеин С участвует в процессе антикоагуляции. Тромбин в мембранном комплексе с тромбомодулином и кальцием активирует частичным протеолизом протеин С. Активированный протеин С (Са) образует с белком-активатором S мембраносвязанный комплекс Са-S-Са2+. Протеин Са в составе этого комплекса гидролизует в факторах Va и VIIIa по 2 пептидные связи и инактивирует эти факторы. 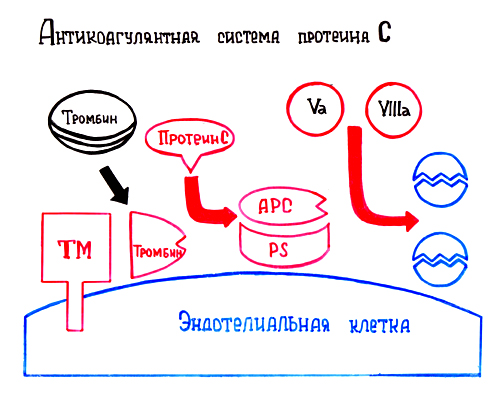 Рис. 83 Антикоагулянтная система протеина С ТМ – тромбомодулин АРС – активированный протеин С PS – протеин S Антикоагулянтная фаза тормозит каскад реакций свертывания крови. Мутация фактора V (лейденовская мутация, резистентность к протеину С) приводит к синтезу фактора V, резистентного к протеину С. Больные с такой генетической мутацией страдают тромбофилией. 36. Для стерилизации медицинских инструментов используют паровые и газовые стерилизаторы, а также воздействие агрессивных веществ (формальдегид, окись этилена и др.). Объясните механизм действия этих веществ на бактериальные клетки, учитывая, что они проникают через мембрану и взаимодействуют с белками. Для этого: а) объясните, что такое денатурация белка, укажите, какие структурные уровни белка изменяются при этом; б) перечислите типы связей, которые разрушаются при денатурации, приведите примеры аминокислот, образующих такие связи; в) назовите, какой участок белка отвечает за его функционирование, дайте определение этому понятию. Объясните, изменится ли биологическая активность ферментов бактерий после их взаимодействия с формальдегидом и почему. ОТВЕТ а) Денатурация – это разрушение слабых химических связей, формирующих пространственную структуру белка (II, III, IV структурные уровни), при воздействиях различных факторов и соединений (высокая температура, ионизирующая радиация, концентрированные кислоты и щелочи, мочевина, спирты, фенол, формальдегид, соли тяжелых металлов и.т.д.). Первичная структура при этом сохраняется, так как стабилизируется ковалентными (прочными) пептидными связями. б) При денатурации разрушаются водородные связи II и III структуры; гидрофобные, ионные, водородные связи между радикалами III и IV структур.  Рис. 1.3. Водородная связь между группами пептидного остова  Рис. 1.7. Гидрофобные взаимодействия между радикалами  Рис. 1.9. Водородные связи между радикалами аминокислот 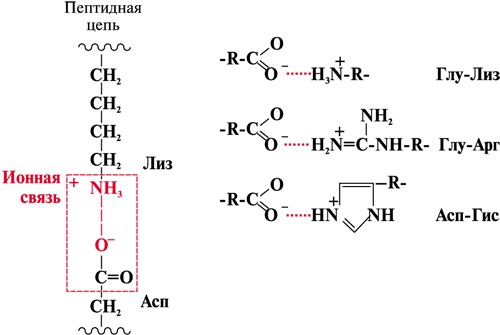 Рис. 1.10. Ионная связь между радикалами лизина и аспарагиновой кислоты (А) и примеры ионных взаимодействий (Б) в) За функцию белка отвечает центр связывания белка с лигандом (активный центр) – участок белковой молекулы, образованный радикалами аминокислотных остатков и функциональных групп, сближенных при формировании третичной структуры. В активном центре происходит специфическое взаимодействие с комплементарным лигандом. Обычно он находится в гидрофобном углублении на поверхности белковой глобулы. При денатурации молекулы белка приобретают случайную конформацию. Биологическая активность при этом полностью утрачивается, так как изменение пространственной структуры (II, III уровней) приводит к разрушению активного центра белка 37. В настоящее время существует уникальный способ диагностики острого инфаркта миокарда на ранних стадиях – определение в крови больных белка тропонина Т. Этот белок присутствует только в сократительных кардиомиоцитах. В норме тропонин Т практически отсутствует в крови (содержание 0 – 1,3 микрограмм на литр), но при повреждении миокарда его концентрация в крови резко увеличивается уже через 2 часа и остается высокой до 14 суток. Объясните, почему сегодня тропонин Т признан маркером 100% чувствительности и используется в диагностике не только острого инфаркта миокарда, но и при неинфарктных повреждениях сердечной мышцы. В чем преимущества теста на тропонин Т перед традиционными тестами на креатинкиназу (КК), лактатдегидрогеназу (ЛДГ) и др.? При ответе на вопрос: а) объясните, что такое энзимодиагностика; б) перечислите требования к ферментам, используемым для энзимодиагностики; в) укажите, какие свойства белка тропонинаТ позволяют использовать его для диагностики заболеваний, сравните их со свойствами ферментов КК и ЛДГ, активность которых определяют при диагностике инфаркта миокарда. ОТВЕТ: а) Энзимодиагностика – раздел учения о ферментах, в котором постановка диагноза заболевания (или синдрома) проводится на основе установления активности определенных ферментов в биологических жидкостях организма. Состав ферментов и их тканевое распределение у взрослого человека в основном постоянны и могут изменяться при заболеваниях. При патологических процессах повреждаются мембраны клеток, и содержащиеся в этих клетках ферменты выходят в кровь. Активность и содержание таких ферментов в крови изменяется и отличается от нормы в течение определенного времени после начала заболевания. б) Ферменты, активность которых определяют при энзимодиагностике, должны удовлетворять требованиям : • органоспецифичность; • в норме активность в крови должна быть невысокой; • при паталогии ферменты должны поступать в кровь. Также важно, чтобы активность фермента была достаточна для его обнаружения. в) При острых воспалительных процессах, механических, химических повреждениях и других паталогических состояниях увеличивается проницаемость или разрушается клеточная мембрана кардиомиоцита и его внутриклеточные ферменты, а также белок тропонин Т, выходят в кровь. Тропонин Т абсолютно органоспецифичен (т.к. содержится только в кардиомиоцитах), в то время как, например, ЛДГ-1 иЛДГ-2 содержатся еще и в ряде других органов. В норме тропонин Т в крови отсутствует, а при паталогии его количество резко и быстро возрастает и держится на высоком уровне достаточно длительное время (до 2 недель). На основании этих свойств тропонина Т возможно его применение в диагностике заболеваний сердечной мышцы. Еще одним главным преимуществом данного белка является быстрое нарастание его концентрации в крови (через 2 часа), в то время как КК достигает максимального значения через 20-30 часов, а ЛДГ через нескольких суток после возникновения патологии. 37. Камптотецин и левомицитин (хлорамфеникол) – ингибиторы матричных биосинтезов, нашедшие применение в двух разных областях медицинской практики. Камптотецин образует комплекс с ДНК-топоизомеразой 1 и нарушает ее активность, а левомицитин присоединяется к 50 S субъединице рибосомы и ингибирует активность пептидилтрансферазы. Предположите, в какой из областей медицины используются каждый из описанных препаратов. Для ответа: а) назовите какие матричные биосинтезы и в каких клетках ингибируют эти препараты; б) изобразите схемы процессов и отметьте стадии, протекание которых блокируется в присутствии указанных препаратов; в) укажите какова степень избирательности и токсичности этих лекарственных веществ. ОТВЕТ: Камптотецин принадлежит к противоопухолевым препаратам и используется в химиотерапии для лечения злокачественных образований, а левомицитин относится к антибактериальным антибиотикам широкого спектра действия. а) Камптотецин останавливает репликацию в опухолевых клетках, а левомицитин – процесс трансляции в прокариотических клетках; б) Будучи ингибитором ДНК-топоизомеразы I камптотецин блокирует протекание стадии инициации репликации. ДНК-топоизомеразы I расщепляет одну из цепей ДНК , обеспечивает раскручивание двойной спирали и включение двух молекул ДНК-хеликаз в область разрыва. Нарушение этой стадии делает невозможной репликацию в быстрорастущих эукариотических клетках. 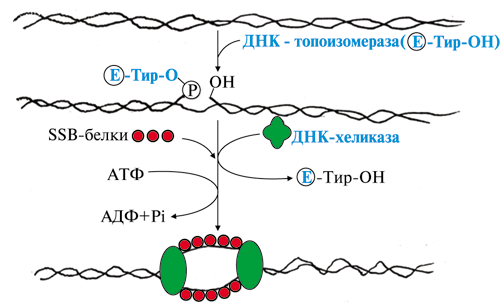 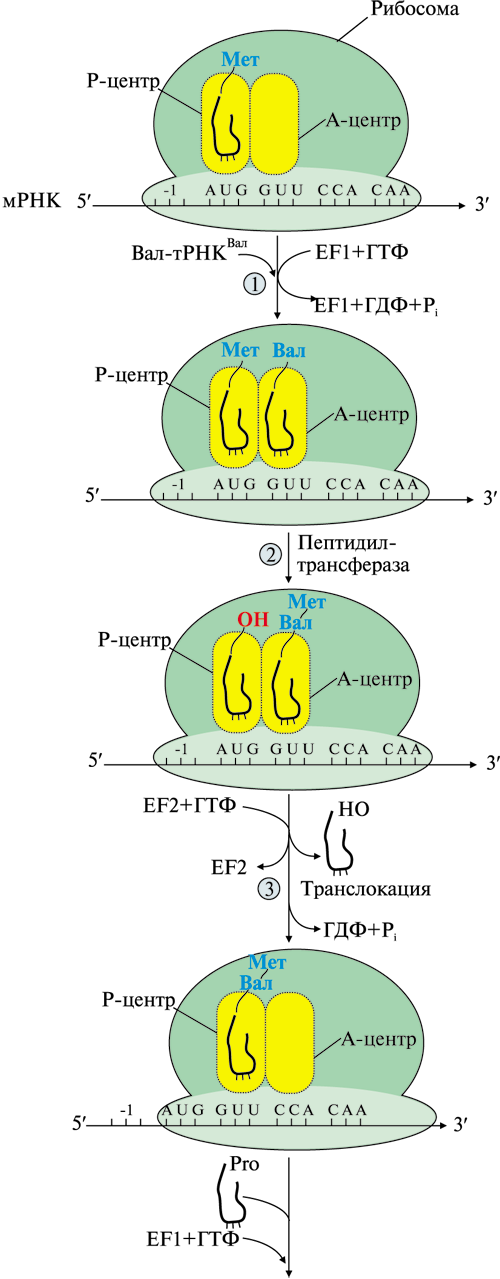 Левомицитин блокирует элонгацию полипептидных цепей на стадии образования новой пептидной связи в А-центре и удлинения пептида на одну аминокислоту. Реакцию катализирует пептидилтрансфераза, активный центр которой образован рРНК, входящей в большую субъединицу рибосомы. в) Избирательность действия камптотецина невелика и обеспечивается более высокой по сравнению с нормальными клетками скоростью синтеза ДНК и РНК, а также повышенной проницаемостью клеточных мембран неопластических клеток. Он достаточно токсичен, так как может прекращать матричные биосинтезы и в здоровых, быстро пролиферирующих клетках организма: фолликулах волос, клетках кроветворной системы и кишечника. Левомицетин же отличается высокой избирательностью и сравнительно мало токсичен для человека. Это объясняется различиями в структуре РНК и белков рибосом в эукариотических и прокариотических клетках. 38. Исследователи каталитического рецептора инсулина установили значительное изменение в гене белка – субстрата инсулинового рецептора. Как нарушение в структуре этого белка скажется на функционировании системы передачи сигнала инсулина? Для ответа на вопрос: а) приведите схему трансмембранной передачи сигнала инсулина; б) назовите белки и ферменты, которые активирует инсулин в клетках-мишенях, укажите их функцию. ОТВЕТ а) Рецептор инсулина построен из двух α- и двух β-субъединиц. α-Субъединицы расположены на наружной поверхности клеточной мембраны, β-субъединицы пронизывают мембранный бислой. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. Каталитический центр рецептора находится на внутриклеточных доменах β-субъединиц. Цитозольная часть рецептора имеет несколько остатков тирозина, подверженных фосфорилированию и дефосфорилированию. 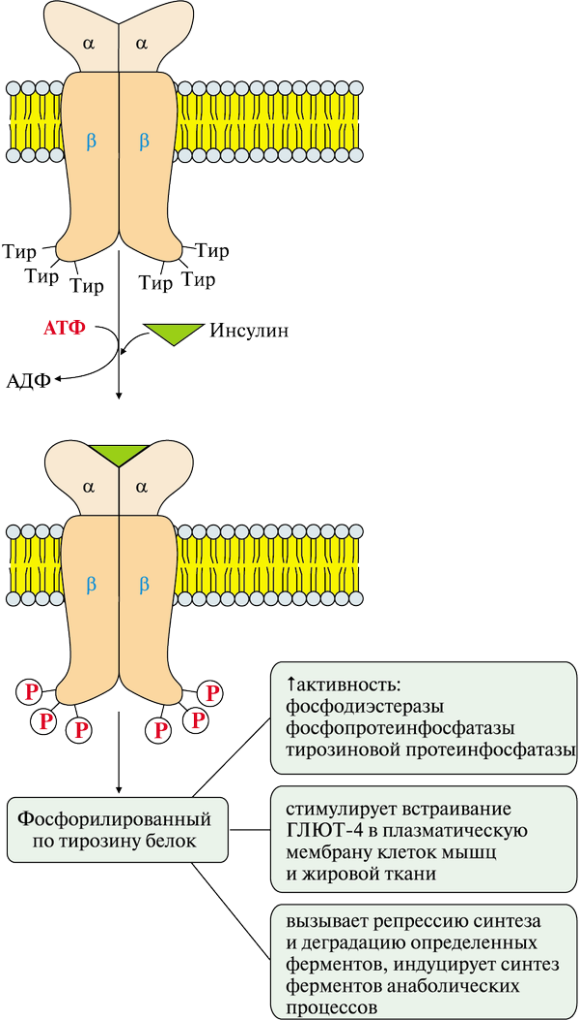 ☼ Присоединение инсулина в центр связывания, образованный α-субъединицами вызывает кооперативные конформационные изменения всех 4-х субъединиц. ☼ Изменение конформации β-субъединиц повышает их каталитическую (тирозинкиназную) активность. Происходит аутофосфорилирование β-субъединиц по нескольким остаткам тирозина. ☼ Фосфорилирование β-субъединиц приводит к изменению заряда, конформации и субстратной специфичности фермента тирозиновой протеинкиназы (Тир-ПК) б) Тир-ПК фосфорилирует определенные клеточные белки по тирозину, которые получили название – субстраты рецептора инсулина. В свою очередь эти белки участвуют в активации: фосфопротеинфосфатазы (ФПФ), которая отщепляет Н3РО4 от фосфорилированных остатков серина и треонина; фосфодиэстеразы, которая превращает цАМФ в АМФ и цГМФ в ГМФ; ГЛЮТ 4 – переносчиков глюкозы в инсулин-зависимых тканях, поэтому повышается поступление глюкозы в клетки мышц и жировой ткани; тирозиновой протеинфосфатазы, которая дефосфорилирует β-субъединицы рецептора инсулина; регуляторных белков ядра, поэтому может повышаться или снижаться экспрессия генов определенных ферментов. Нарушение структуры белка – субстрата инсулинового рецептора приведет в нарушению передачи сигнала гормона на внутриклеточные ферменты и белки. 39. Хрусталик и роговица глаза преломляют свет, поэтому их клетки почти не содержат митохондрий. Каким способом в клетках этих тканей в основном синтезируются молекулы АТФ ? Для ответа на вопрос: а) укажите известные Вам механизмы фосфорилирования АДФ; б) напишите схему процесса, обеспечивающего синтез АТФ без участия митохондриальной цепи переноса электронов и оцените его энергетический эффект. ОТВЕТ а) В аэробных условиях АТФ синтезируется путем окислительного фосфорилирования за счет энергии окисления субстратов при участии митохондриальной цепи переноса электронов. В анаэробных условиях происходит субстратное фосфорилирование, при котором используется энергия, освобождающаяся при разрыве макроэргических связей в субстратах. б) Для тканей, не способных к аэробным процессам, основным источником энергии становится анаэробный гликолиз. 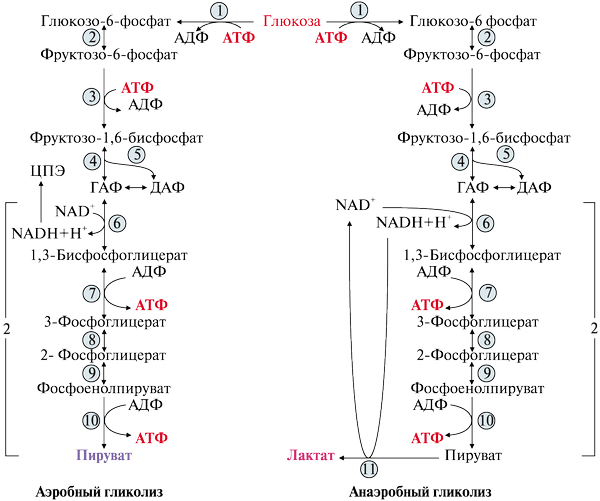 40. Повышенная экскреция двухосновных аминокислот известна под названием лизинурическая непереносимость белка и наследуется как аутосомно-рецессивный признак. У гомозигот нарушен транспорт лизина и аргинина в кишечнике, реабсорбция в почках, захват этих аминокислот клетками печени. В крови больных снижена концентрация лизина, аргинина и орнитина, в раннем возрасте отмечаются гепатоспленомегалия, непереносимость белка и эпизодическая интоксикация аммонием. Клинические проявления обусловлены гипераммониемией. Для лечения этого заболевания используется цитруллин – аминокислота, всасывание в кишечнике и печеночный транспорт которой у больных не нарушены. Объясните, почему при данном заболевании наблюдается гипераммониемия. Для ответа на вопрос: а) напишите схему процесса, нарушение которого приводит к развитию гипераммониемии; б) назовите причины токсического действия аммиака; в) объясните механизм лечебного действия цитруллина; предположите, какую диету врач должен рекомендовать больному при данной патологии. ОТВЕТ а) Гипераммониемия развивается из-за снижения содержания аргинина и орнитина, необходимых для нормального функционирования орнитинового цикла: 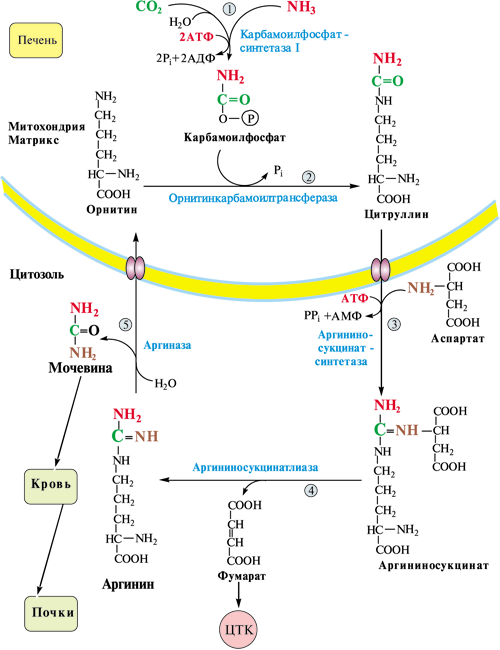 б) Аммиак оказывает токсическое действие на нервную систему и другие ткани, так как: NH3 проходит простой диффузией в любые клетки В клетках NH3 + Н+ → NH4 ↑рН в клетках (алкалоз) В клетках тканей ↑V реакций: 1) восстановительного аминирования α-кГ + NАDH+Н+ → Глу + NАD+ это приводит к снижению в клетке [α-кГ] и АТФ/АДФ 2) образования глутамина Глу + NH3 + АТФ → Глн это приводит к снижению в клетке [Глу] и скорости образования ГАМК Это вызывает нарушение: • функционирования Nа+,К+-АТФазы; • энергетического обмена в клетках; • обмена аминокислот; • синтеза ГАМК в нервной системе; • выведения глутамина и накопление его в клетках. в) Введение цитруллина увеличивает выход в орнитиновом цикле выход орнитина. Это приводит к повышению образования мочевины и снижению концентрации аммиака в крови. На фоне перорального приема цитруллина необходимо ограничить количество белков в пище. 41. У новорожденных до 6 месяцев сильно развита бурая жировая ткань. Она содержит запасы ТАГ и гликогена, много митохондрий, во внутреннюю мембрану которых встроен белок термогенин (разобщитель процессов окислительного фосфорилирования). В отличие от белой жировой ткани, в бурых жировых клетках жирные кислоты, образующиеся в результате липолиза, непосредственно вступают в реакции β-окисления. Объясните, каким образом, бурая жировая ткань обеспечивает термогенез новорожденных. Для этого: а) укажите различие в судьбе продуктов гидролиза ТАГ в белой и бурой жировой тканях; б) напишите схему метаболического пути обмена жирных кислот; рассчитайте выход АТФ для пальмитиновой кислоты; в) представьте схему ЦПЭ, укажите роль этого процесса в поддержании температуры тела человека и вклад разобщителей; г) сделайте вывод, в какой форме происходит выделение жирных кислот в бурой жировой ткани в связи с особенностями ее строения. |
