задачи. Задачи с решениями
 Скачать 11.17 Mb. Скачать 11.17 Mb.
|
|
ОТВЕТ: a) Синтез белка проходит следующие этапы: инициация, элонгация, терминация. 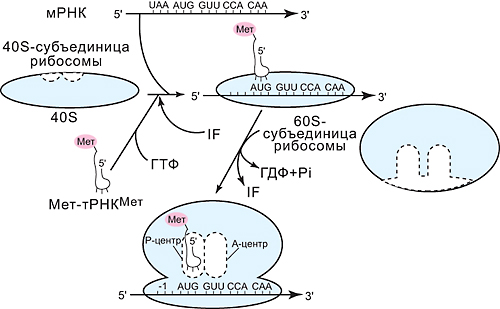 Рис. 12 Инициация 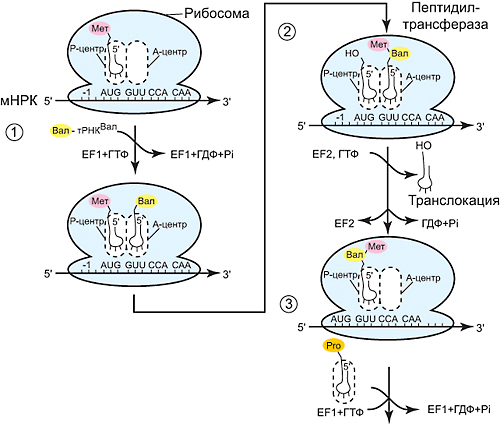 Рис. 13 Элонгация Одна аминокислота в процессе элонгации проходит в 3 стадии: • включение аа-тРНК в А-центр; • образование пептидной связи; • перемещение пептидил-тРНК из А-центра в в Р-центр в результате транслокации рибосомы. 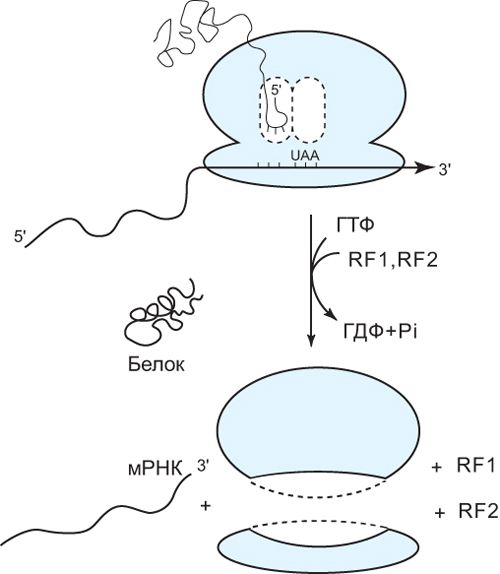 Рис. 14 Терминация б) В ходе синтеза белка участвуют мРНК, тРНК, рРНК (в составе рибосом). 8. МАТРИЧНЫЕ БИОСИНТЕЗЫ. РЕПЛИКАЦИЯ. Цитогенетическим маркером хронического миелолейкоза (ХМЛ) служит Ph-хромосома (Филадельфийская хромосома), которая возникает за счет обмена генетическим материалом между хромосомами 9 и 22. В результате транслокации на 22-й хромосоме возникает новый ген BCR-ABL, кодирующий белок, представляющий собой тирозинкиназу с повышенной активностью. Симптомы заболевания - нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы до миелоцитов и промиелоцитов, спленомегалия, астения, обусловленная повышенным клеточным распадом, который может сопровождаться гиперурикемией. В типичных случаях гематолог легко ставит диагноз ХМЛ, но иногда клинико-гематологическая картина не типична и требуется подтверждение диагноза. Опишите молекулярно-генетический метод, с помощью которого можно подтвердить диагноз ХМЛ. Для этого: а) объясните, как можно получить большое число копий гена в условиях репликации in vitro при очень малых количествах исходной ДНК в образце; приведите схему этого процесса; б) перечислите, какие компоненты содержит реакционная смесь; в) изложите, какова функция праймеров; г) поясните, каким способом можно выявить мутацию в амплифицированном участке ДНК. ОТВЕТ: а) Большое число копий гена можно получить методом ПЦР. 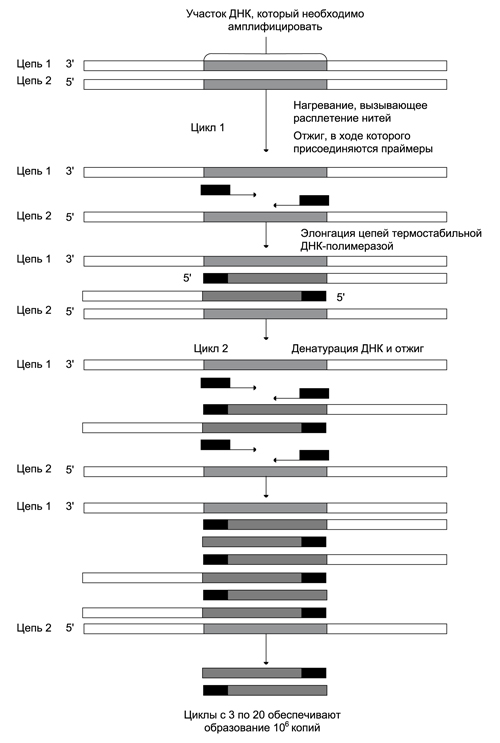 Рис. 15 Схема ПЦР б) Компоненты реакционной смеси: исследуемая ДНК, 4 dNTP, 2 праймера, термостабильная, или Taq-полимераза, буфер, содержащий ионы Mg2+. в) Праймеры – это короткие олигодезоксирибонукеотидные последовательности длиной от 15 до 30 пар нуклеотидов, которые комплиментарны 3’-концам амплифицируемого участка на нитях ДНК. Расстояние между праймерами определяет длину синтезируемых фрагментов молекулы ДНК. г) Образцы с амплифицированным фрагментом ДНК, предположительно содержащим мутацию, наносят на узкие полоски нитроцеллюлозы и обрабатывают меченными олигонуклеотидами (32Р-зондами), содержащими нормальную и мутантную последовательности. Радиоавтографически оценивают, с какими 32Р-зондами связывается ДНК пациента. Гибридизация с радиоактивно меченым зондом ‒ наиболее чувствительный метод индикации. Кроме данного метода, в диагностической практике используют электрофорез в агарозном геле с окрашиванием бромистым этидием и ДНК-гибридизацию с последующей индикацией с помощью ферментативной и люминисцентной меток. 9. ГОРМОНЫ. МЕХАНИЗМЫ ДЕЙСТВИЯ (первое занятие). Важное свойство мембран – способность воспринимать и передавать внутрь клетки сигналы из внешней среды. Около 80% первичных мессенджеров (гормоны, нейротрансмиттеры) взаимодействуют со специфическими рецепторами, которые связаны с эффекторами через G-белки. Последние участвуют в разных трансмембранных системах передачи сигнала. Объясните роль G-белков в этих процессах. Для этого: а) опишите структурную организацию G-белков; б) подумайте, какие специфические центры должна иметь каждая α-субъединица в аденилатциклазной системе; в) напишите схему передачи сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу; г) разъясните, как усиливается сигнал при работе аденилатциклазной системы; д) объясните, почему G-белки называют «внутренние часы клетки». ОТВЕТ: а) G-белки локализованы на внутренней поверхности плазматической мембраны, имеют гетеротримерную структуру. Они состоят из большой α-субъединицы , а также меньших β- и γ-субъединиц. α-субъединица обладает ГТФ-азной активностью, в неактивной (выключенной) форме она связывает молекулу ГДФ на активном сайте. Субъединицы β и γ 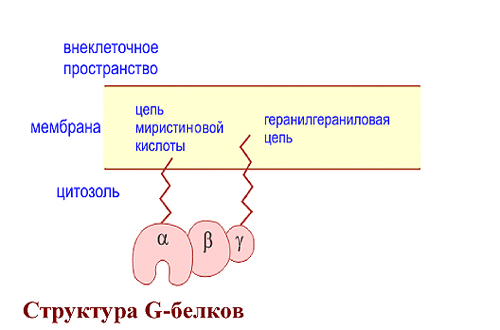 Рис. 16 Структура G-белков связаны между собой и в физиологических условиях не могут быть диссоциированы. В неактивном состоянии βγ-комплекс непрочно связан с α-субъединицей. γ-Субъединица связана с мембраной геранилгераниловой цепью, близкой по структуре к холестерину, а α-субъединица ‒ с помощью миристиновой кислоты. Такие связи обеспечивают удержание комплекса G-белка в плоскости мембраны и способность легко двигаться в этой плоскости. б) Необходимы центры для: • связывания ГТФ или ГДФ; • взаимодействия с рецептором; • связывания с βγ-субъединицами; • взаимодействия с ферментом аденилатциклазой. в) 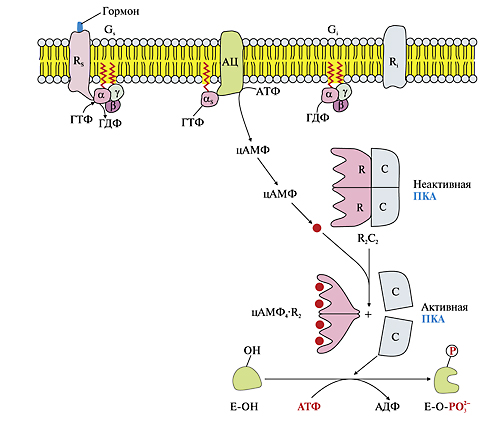 Рис. 17 Аденилатциклазная система г) Каскадный механизм. Одна молекула гормона, активирующая рецептор, может «включать» несколько G-белков, затем каждый активирует несколько молекул аденилатциклаз с образованием тысяч молекул цАМФ и т.д. Таким образом, по механизму каскадного усиления одна молекула гормона способна изменить активность нескольких тысяч молекул. д) Конформационные изменения в комплексе {α-ГТФ}-{АЦ} стимулируют повышение ГТФ-фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов 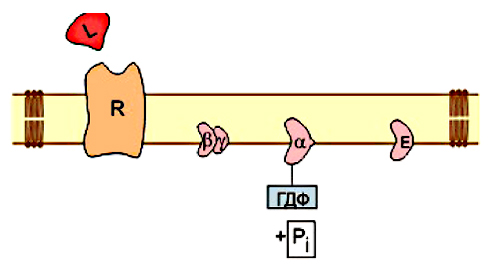 Рис. 18 реакции, неорганический фосфат (Рi), отделяется от α-субъединицы, а комплекс α-ГДФ сохраняется. Образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βγ-субъединицам. G-белок возвращается к неактивной форме. Таким образом, скорость гидролиза ГТФ определяет время, в течение которого система находится в активном состоянии. 10. 1. Липиды: переваривание и всасывание. 2. ВИТАМИНЫ. Пациентка в возрасте 50 лет страдает в течение нескольких лет дискинезией желчного пузыря, что проявляется тупыми болями в правом подреберье. При исследовании кала выявлена стеаторея. В последний месяц у женщины ухудшилось зрение в темноте. Объясните, почему нарушение функции желчного пузыря может привести к ухудшению зрения у данной больной. Изучите последовательность событий, представленных на схеме (рис. А-Г), происходящих в процессе восприятия энергии фотона палочками (рецепторными клетками сетчатки). Для этого: а) назовите витамин, который обозначен буквой (V) на рисунке, являющийся предшественником кофермента родопсина; б) опишите, какие изменения происходят с коферментом, выбранным вами в пункте а) и родопсином при поглощении кванта света (hv); в) какой тип белка вам напоминает трансдуцин и в каких системах вы видели такой тип белка (см. рис. Б); г) какую реакцию катализирует фермент ФДЭ, активированный трансдуцином, напишите эту реакцию и укажите ее значение; д) разъясните, что происходит с Na+/Ca2+-каналом в результате предыдущей реакции и какие изменения происходят при этом (см. рис. Г); е) объясните молекулярные механизмы связи между дискинезией желчного пузыря и нарушением зрения в темноте. 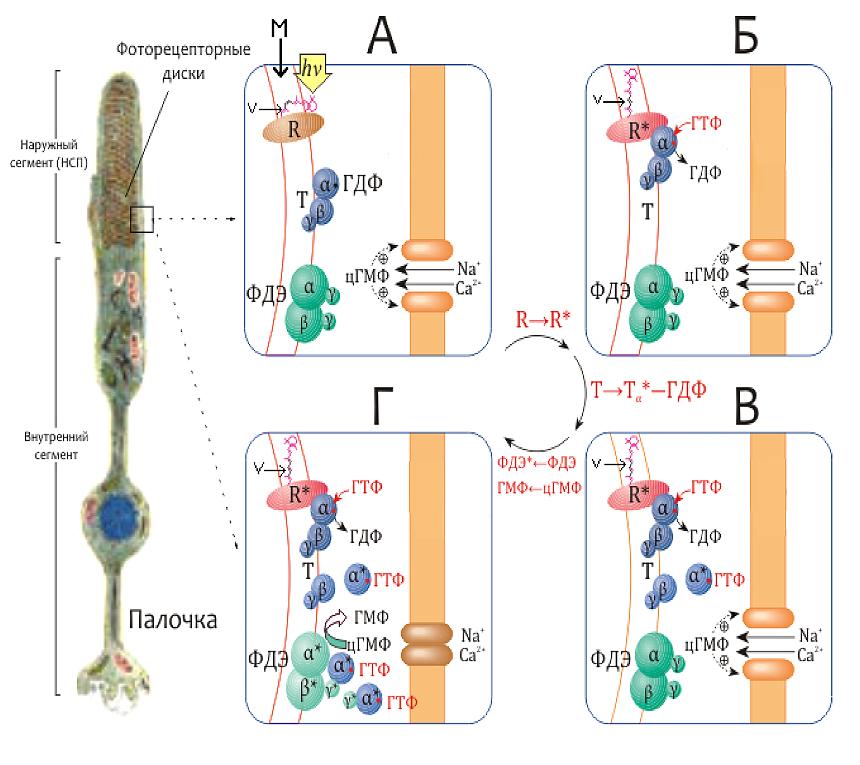 Рис. 19 М – мембрана наружного сегмента палочек; R - белок родопсин,; hv – энергии фотона; Т - трансдуцин; V – витамин. ОТВЕТ: а) Коферментом зрительного белка опсина служит 11-цис-ретиналь, альдегидное производное жирорастворимого витамина А; ретиналь и опсин образуют белок родопсин. б) При восприятии кванта света зрительным рецептором происходит изомеризация в витаминной части зрительных рецепторов: производное витамина А 11-цис-ретиналь превращается в транс-ретиналь. В результате изменяется белковая опсиновая часть рецепторов, родопсин обесцвечивается и переходит в метародопсин II. Метародопсин II взаимодействует с другим белком – трансдуцином. в) Трансдуцин состоит из 3 протомеров. В результате активации системы энергией фотона α протомер трансдуцина обменивает ГДФ, который связан с ним в темновой фазе, на ГТФ. Трансдуцин - разновидность семейства тримерных G-белков. G-белки служат компонентом аденилатциклазной, инозитолфосфатной и других систем передачи сигнала. г) ФДЭ-фосфодиэстераза – фермент, который гидролизует в данном случае молекулу цГМФ до ГМФ. 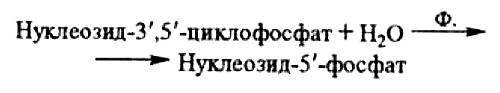 Рис. 20 Значение этой реакции - снижение концентрации цГМФ в цитоплазме наружного сегмента. д) При уменьшении концентрации цГМФ Na+/Ca2+ каналы в плазматической мембране наружного сегмента, которые были открыты в темноте и через которые внутрь рецепторных клеток входили ионы Na+ и Ca2+, закрываются. Уменьшение входа ионов Na+ приводит к гиперполяризации мембраны и возникновению рецепторного потенциала. е) Дискинезия желчного пузыря характеризуется снижением поступления желчи в двенадцатиперстную кишку. Поступление желчных кислот в кишечник замедляется, нарушается эмульгирование, а следовательно, переваривание и всасывание продуктов гидролиза жиров и жирорастворимых витаминов, к которым относится витамин А. Все эти вещества всасываются в составе смешанных мицелл, для формирования которых также необходимы желчные кислоты. Витамин А участвует в восприятии света, при его гиповитаминозе в темноте ухудшается зрение (куриная слепота). Таким образом можно объяснить связь между дискинезией желчного пузыря и ухудшением зрения в темноте. 11. Биологическое окисление. Цикл трикарбоновых кислот - общий путь метаболизма. Энергетический обмен. Окислительное фосфорилирование и транспортные системы митохондрий. Мормоны, проживающие в двух населенных пунктах США – Хилдале (штат Юта) и Колорадо-Сити (Аризона), продолжают придерживаться полигамии и одобряют браки между близкими родственниками. Последнее обстоятельство - причина высокого распространения в общине фумаровой ацидурии. Заболевание вызвано дефицитом фумаразы. Основной биохимический признак заболевания – высокая экскреция с мочой фумаровой кислоты, которая в десятки раз превышает контрольные значения. В моче больных детей в больших количествах могут присутствовать и другие органические кислоты: α-кетоглутаровая, янтарная, лимонная, иногда яблочная, в крови повышено содержание лактата и пирувата. Клинические проявления органических ацидурий, как правило, неспецифичны и заключаются в задержке нервно-психического и двигательного развития, судорожных пароксизмах, резистентных к назначаемым антиконвульсантам и дисметаболических кризах, характеризующихся эпизодами летаргии и рвоты. Почему недостаточная активность этого фермента приводит к таким клиническим проявлениям? Для ответа: а) представьте схему процесса с участием фумаразы; б) опишите его роль в метаболизме клеток; в) объясните причину повышения в крови больных уровня молочной, пировиноградной кислот, представьте соответствующие схемы. ОТВЕТ: 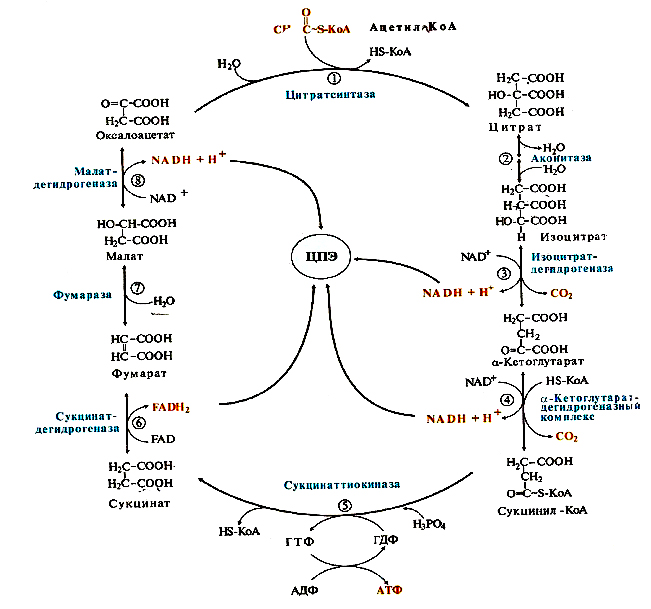 Рис. 21 а) Фумараза служит одним из ферментов цитратного цикла (цикла Кребса). Фермент класса лиаз катализирует присоединение воды к молекуле фумаровой кислоты и образование продукта – яблочной кислоты. б) Цикл Кребса – центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты при распаде углеводов, жиров и белков, до CO2. Освобожденный водород (протоны и электроны) направляется в цепь тканевого дыхания, где участвует в активации окислительного фосфорилирования АДФ и в дальнейшем включается в состав воды. Во всех клетках организма человека (кроме эритроцитов) основное значение процесса – энергетическое. Недостаточность фумаразы снижает скорость этого процесса. Следовательно, все клинические проявления органических ацидурий связаны с развитием гипоэнергетического состояния клеток тканей. в) При дефиците фумаразы снижается скорость ЦТК и окисления ацетил-КоА в этом процессе. Ацетил-КоА служит аллостерическим ингибитором пируватдекарбоксилазы (ПДК) и активатором киназы ПДК, которая фосфорилирует пируватдекарбоксилазу и тормозит процесс. 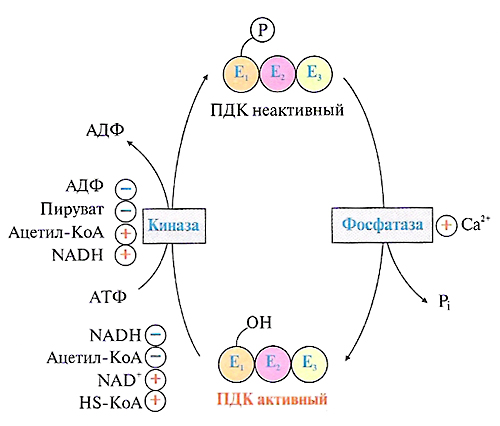 Рис. 22 Регуляция активности ПДК 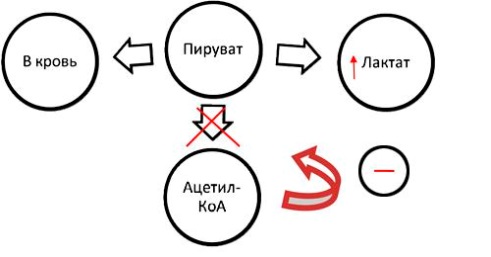 Рис. 23 У больных, страдающих фумаровой ацидурией, молекулы пирувата, не включенные в общий путь катаболизма (ОПК), выходят в кровь, часть из них превращается в лактат, который тоже поступает в кровь. Присутствие в крови больных α-кетоглутаровой, янтарной, лимонной, яблочной кислот изменяет рН крови и развивает ацидоз. 12. Энергетический обмен. Окислительное фосфорилирование и транспортные системы митохондрий. В результате обследования у больной установлена миома матки. Беседуя с пациенткой, врач объяснил ей, что это самая распространенная доброкачественная опухоль и выявляется у 20–50% обследуемых. Долгое время основным методом лечения была надвлагалищная ампутация и экстирпация матки. Однако такое оперативное лечение нарушает репродуктивную функцию, нейроэндокринные процессы. В настоящее время многим больным с миомой матки проводится эмболизация маточных артерий (ЭМА). В ходе операции осуществляется избирательное закрытие сосудов миоматозного узла и перифиброидного сплетения, что приводит к стойкой ишемии только самой миомы, практически не отражаясь на кровоснабжении непораженных участков стенки матки. Прекращение кровотока по ветвям маточных артерий приводит к отмиранию клеткок миомы. Объясните успешный результат этого метода лечения. Для этого: а) назовите основную причину происходящих изменений в клетках миомы; б) опишите, какой обмен нарушается в клетках, к чему этот процесс приводит; в) представьте схему процесса, функционирование которого возможно только при непосредственном участии О2; назовите фермент осуществляющий окислительное фосфорилирование АДФ. ОТВЕТ: а) Проведение ЭМА вызывает гипоксию опухоли, т.е. недостаточность поступления кислорода в клетки миомы. б) Нарушается энергетический обмен, приводящий к недостаточному синтезу АТФ в клетках миомы. 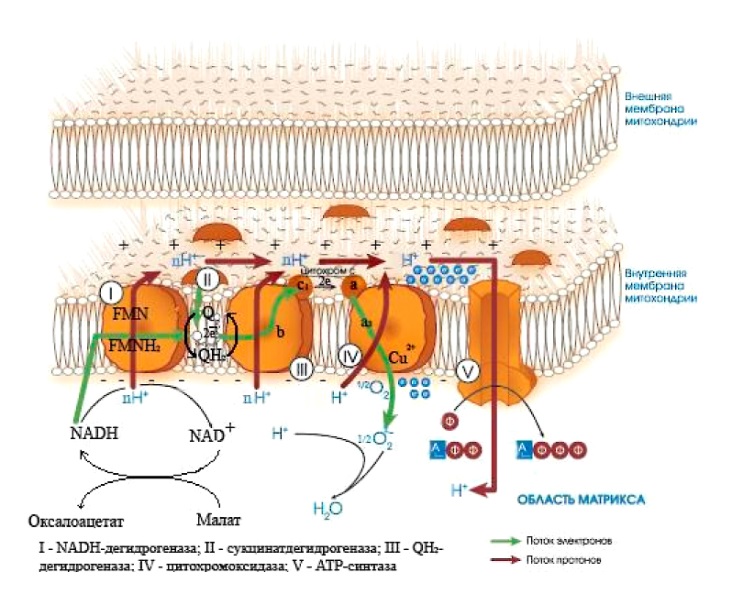 Рис. 24 I – NADH-дегидрогеназа; II – сукцинатдегидрогеназа; III – QH2 – дегидрогеназа; IV – цитохромоксидаза; V – ATP-синтаза В тесной зависимости от внутриклеточного содержания АТФ находится способность клеток поддерживать специфические для нее энергозависимые функции (электрогенную, нейромедиаторную, рецепторную, сократительную, транспорт ионов и трансмембранные потенциалы, синтетические процессы и др.). При снижении внутриклеточного содержания уровня АТФ всего на 15–20% интенсивность всех энергозависимых функций клетки падает на 75–80% от исходной величины, из-за чего сильно нарушаются функции клеток миомы. Совокупность нарушений приводит некрозу – омертвлению клеток миомы без способности к восстановлению. в) Окислительное фосфорилирование АДФ осуществляет фермент АТФ-синтаза. 13. Обмен углеводов. Синтез и распад гликогена. Ранее в медицинской практике использовался диэтиловый эфир для наркоза. При эфирном наркозе возбуждаются симпатические центры, адреналин из мозгового слоя надпочечников поступает в кровь. Почему такой наркоз ухудшал состояние пациентов, страдающих заболеваниями, сопровождающимися увеличением уровня глюкозы в крови? Для этого: а) назовите норму глюкозы в крови; б) укажите источники глюкозы в крови; в) объясните механизм действия адреналина в той ткани, которая обеспечивает сохранение нормального уровня глюкозы в крови при стрессе и кратковременном голодании (не более суток); г) представьте схему метаболического пути, ускорение которого приведет к повышению уровня глюкозы в крови у пациентов при использовании такого наркоза. |
