|
Вопросы и ответы по устному модулю по химии. Задание 1 1 Периодический закон Д. И. Менделеева, его современная формулировка. 2 Структура периодический системы с точки зрения строения атома.
Формулировка. Невозможно осуществить переход тепла от более холодного тепла к более горячему, не выполняя при этом работы.
Энтропи́я — функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы. Другой интерпретацией этого понятия является информационная ёмкость системы. В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру неупорядоченности системы; чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия.
Цель введения термодинамических потенциалов — использование такого набора естественных независимых переменных, описывающих состояние термодинамической системы, который наиболее удобен в конкретной ситуации, с сохранением тех преимуществ, которые даёт применение характеристических функций с размерностью энергии. В частности, убыль термодинамических потенциалов в равновесных процессах, протекающих при постоянстве значений соответствующих естественных переменных, равна полезной внешней работе.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида: 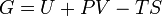 Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Эне́ргияГельмгоцьца — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.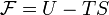
Критерий направления процесса. Для решения вопроса о возможности протекания реакции необходим количественный критерий принципиальной осуществимости процесса. С помощью такого критерия можно определить, насколько далеко идет процесс нельзя ли добиться увеличения степени превращения если данное вещество не реакционноспособно, то можно ли создать условия, при которых оно может взаимодействовать с другими веществами как влияют на течение процесса температура, давление, разбавление инертным газом, варьирование концентрации реагентов можно ли заставить изучаемую реакцию протекать в обратном направлении. В механике большое значение имеет принцип стремления потенциальной энергией к минимуму. Тенденция тела к перемещению сверху вниз определяется разностью уровней в его начальном и конечном положениях независимо от траектории падения. Движение прекращается, когда гравитационный потенциал достигает минимума. Произведение массы тела на изменение гравитационного потенциала равно работе падения тела, которая от пути перемещения не зависит.
Задание 16
Основные понятия химической кинетики. Скорость химической энергии, факторы ее определяющие. Кинетические уравнения. Константа скорости химической реакции. Понятие о порядке реакции. Кинетические уравнения нулевого, первого и второго порядков.
Химическая кинетика – наука, изучающая скорость химической реакции и факторы её определяющие.
Скорость химической реакции определяется как количество молей вещества, реагирующих в единицу времени единица объем.
Факторы, определяющие скорость реакции:
Концентрация реагирующий веществ
Температура
Наличие катализаторов
Увеличение концентрации реагирующих веществ увеличивает скорость реакции.
Кинетическое уравнение выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. Для простой гомогенной реакции скорость пропорциональна произведению концентраций реагирующих веществ и кинетическое уравнение записывается в виде: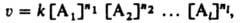
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрировании каждого из реагирующих веществ равной 1 моль/л. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, от катализатора, но не зависит от их концентрации.
Порядок реакции - это сумма показателей степеней у концентрации реагентов в уравнении закона действующих масс. Устанавливается экспериментально. Может равняться нулю или иметь дробное значение. Если химические реакции проходят в одну стадию, то порядок и молекулярность совпадают. Различают реакции нулевого, первого, второго и третьего порядков.
Задание 17
Зависимость скорости кинетической энергии от температуры. Правило Вант-Гоффа. Температурный коэффициент химических и биохимических процессов. Понятие об энергии активации.
Средняя кинетическая энергия поступательного движения молекул не зависит от ее природы и пропорциональна абсолютной температуре газа Т. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Давление газа пропорционально произведению числа молекул в единице объема на его термодинамическую температуру.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C).
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
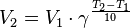
Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры.
В соответствии с эмпирическим правилом Вант-Гоффа скорость большинства реакций увеличивается приблизительно в 2—4 раза при увеличении температуры на 10°С: где у — температурный коэффициент константы скорости реакции.
Температурные коэффициенты скорости большинства реакций довольно близки друг к другу, колеблясь в указанных выше пределах (у = 2 4).
Как всякая химическая реакция, ферментативные реакции зависят от температуры. Влияние температуры на тот или иной процесс принято оценивать величиной температурного коэффициента. Температурный коэффициент показывает, во сколько раз данный процесс ускоряется при повышении температуры па 10°С.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция.
При низкой температуре большинство молекул обладают энергией меньшей, чем энергия активации, и неспособны преодолеть энергетический барьер. Однако в веществе всегда найдутся отдельные молекулы, энергия которых значительно выше средней. Даже при низких температурах большинство реакций продолжают идти. Увеличение температуры позволяет увеличить долю молекул, обладающих достаточной энергией, чтобы преодолеть энергетический барьер. Таким образом повышается скорость реакции.
Задание 18
Обратимые и необратимые реакции. Константа равновесия. Принцип Ле-Шателье.
Обратимые реакции – тип химических реакций, способных протекать в прямом и в обратной направлении.
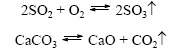
Необратимыми называют реакции, протекающие до конца, то есть до тех пор, пока полностью не израсходуется одно из исходных веществ.
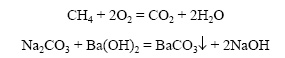
Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Принцип Ле-Шателье. Если на систему, находящуюся в состоянии равновесия, воздействуют внешние факторы, равновесие системы смещается в сторону, сводящую ее к минимуму.
Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому.
Химическое равновесие смещается в ту или иную сторону при изменении любого из следующих параметров:
1) температуры системы, т. е. при её нагревании или охлаждении
2) давления в системе, т. е. при её сжатии или расширении
3) концентрации одного из участников обратимой реакции
Задание 19
Поверхностные явления. Поверхностное натяжения жидкостей. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе. Сорбционные процессы: адсорбция, абсорбция, хемосорбция.
Поверхность энергии – избыточная энергия количества молекул по сравнению с объемом фазы. Зависит от площади. Любая система старается уменьшить свою поверхностную энергию.
Поверхностное натяжение жидкостей – термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемаяработой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными. Поверхностное напряжение численно равно работе, которую необходимо выполнить чтобы образовалась единица поверхности.
По способности изменять поверхностное напряжение в растворе, все вещества можно разделить на:
Поверхностно-активные вещества (ПАВ). Уменьшают поверхность напряжения. Относятся спирты, амины, органические кислоты.
Поверхностно-неактивные вещества (ПНВ). Относятся углеводы (сахароза, фуктоза..)
Поверхностно-инактивные вещества (ПИВ). Относятся неорганические соединения (соли, кислоты, основания).
Правило Дюкло-Траубе (об увеличении активности):
Увеличение длины углеводородного радикала ПАВ на одну CH2-группу увеличивает его поверхностную активность в 3-3,5 раза.
Адсорбция – концентрирование вещества на поверхности раздела фаз по сравнению с объемом фазы.
Абсорбция – концентрирование вещества по всему объему вещества.
Хемосорбция – химическая адсорбция. Вызвана химическими взаимодействиями. Необратима. Специфична. Первая стадия гетерогенной реакции.
Задание 20
Адсорбция на поверхности раздела жидкость-газ и жидкость-жидкость. Уравнение Гиббса. Ориентация молекул в поверхностном слое. Представление о структуре биологических мембран.
Адсорбция – концентрирование вещества на поверхности раздела по сравнению с объемом фазы.
Адсорбент – вещество, на поверхности которого происходит адсорбция. Адсорбтив – вещество, которое адсорбируется на поверхности адсорбента.
При адсорбции веществ на границе раздела фаз поверхностное натяжение может уменьшаться, повышаться или оставаться неизменным.
Вода – наиболее часто применяющийся растворитель. Она обладает большим поверхностным натяжением, поэтому по отношению к ней многие вещества являются поверхностно-активными. Поверхностное натяжение биологических жидкостей меньше воды вследствие наличия в них ПАВ различной природы. В результате эти вещества самопроизвольно накапливаются у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны.
В качестве примера можно привести образование на поверхности воды пленок нефти, бензина, масел. Такие пленки могут быть невидимы невооруженным глазом, проявляться в виде интерференционной картины или могут быть обнаружены как достаточно толстые окрашенные пленки.
Пленки на поверхности жидкости могут образоваться двумя способами:
Адсорбцией веществ из объема раствора на его поверхности. По такому механизму образуются пленки малорастворимых в данном растворителе веществ, которые являются по отношению к нему поверхностно-активными. Возможен также механизм адсорбции веществ из газовой фазы.
Непосредственным нанесением вещества на поверхность жидкости получают пленки нерастворимых веществ. В случае жидкостей пленки формируются з счет самопроизвольного растекания. Твердые вещества наносят либо в виде порошка, либо в виде раствора в легколетучем растворителе, который впоследствии может быть удален испарением.
Уравнение Гиббса. Любая система в соответствии со вторым началом термодинамики стремится самопроизвольно перейти в такое состояние, при котором она обладает минимальным запасом энергии Гиббса. Следовательно, она стремится к минимуму поверхностной энергии Гиббса.
Ориентация молекул в поверхностном слое.
Ориентация молекул поверхностно-активных веществ в адсорбционном слое различна.
Ориентация молекул поверхностно-активных веществ определяет возможность создания и стабилизации как обычных буровых растворов, так и утяжеленных с твердой фазой из частиц неглинистых пород.
Все сказанное об ориентации молекул поверхностно-активного вещества на границе вода-воздух относилось к пленкам, полученным из дифильных молекул, очень мало растворимы в воде. Однако это же относится и к поверхностным пленкам растворимых веществ, образованных в результате адсорбции их молекул. Необходимо лишь помнить, что между количеством веществ на поверхности и в объеме всегда устанавливается известное равновесие. Кроме того, следует учесть, что поверхностные пленки растворимых поверхностно-активных веществ, благодаря сравнительно небольшой длине углеводородных радикалов их молекул, почти всегда бывает газообразными.
Структура биологических мембран.
Биологические мембраны – сложные надмолекулярные структуры, окружающие все живые клетки и образующие в них органеллы.
Все мембраны по своей организации и составу обнаруживают ряд общих свойств:
Они состоят из липидов, белков и углеводов.
Являются плоскими замкнутыми структурами.
Имеют внутреннюю и внешнюю поверхности.
Избирательно проницаемы.
Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойствами амфифильности(содержат как гидрофильные, так и гидрофобные функциональные группы).
По выполняемым функциям белки в составе мембран делятся на:
Структурные
Каталитические
Рецепторные
Транспортные.
Одна из главных функций мембран – участие в переносе веществ. Этот процесс обеспечивается при помощи трех основных механизмов: простой диффузией, облегченной диффузией и активным транспортом.
Задание 21
Адсорбция на поверхности раздела твердое вещество-газ. Факторы, определяющие адсорбцию на поверхности твердого тела. Уравнение Ленгмюра. Физическая и химическая адсорбция.
Адсорбция протекает не на сей поверхности тела, а на поверхности активного центра, участвуя с некомплексированными межмолекулярными взаимодействиями.
Адсорбция является обратимой.
При адсорбции газов на твердых телах описания взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими и химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция (физосорбция) вызывается физическими взаимодействиями. Она обратима, неспецифична. Пример: адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) вызвана химическими взаимодействиями. Она необратима, специфична. Является первой стадией гетерогенной реакции. Пример: адсорбция кислорода на вольфраме или серебре на высоких температурах.
Следует подчеркнуть, что явления физической и химической адсорбции четко различаются в очень редких случаях. Обычно осуществляется промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируется по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум.
|
|
|
 Скачать 138.97 Kb.
Скачать 138.97 Kb.