Кремний
|
Соединения кремния
|
Оксид кремния (IV)
|
Кремниевая кислота
|
1. Обладает полупроводниковыми свойствами.
2. Горит в кислороде:
Si+O2=SiO2+Q
Получение
- Восстановление оксида кремния (IV) углеродом (в промышленности):
SiO2+2C=Si+2CO
- порошком магния (в лаборатории):
SiO2+2Mg=Si+2MgO
|
1. Твердое бесцветное прозрачное вещество, легко затвердевающее в виде стекла.
2. В воде не растворяется и с водой не реагирует.
3. Как кислотный оксид взаимодействует с:
а) щелочами:
SiO2+2NaOH=Na2SiO3+H2O;
б) основными оксидами:
SiO2+CaO=CaSiO3
4. Вытесняет из солей летучие кислоты (реакции, лежащие в основе варки стекла):
SiO2+Na2CO3=Na2SiO3+CO2↑
SiO2+CaCO3=CaSiO3+CO2↑
|
1. Очень слабая двухосновная не растворимая в воде кислота состава
mSiO2·nH2O(H2SiO3)
2. Разлагается уже при несильном нагревании:
H2SiO3=SiO2+H2O
3. Соли кремниевой кислоты (силикаты) подвергаются гидролизу:
4Na++2SiO32−+2H2O⇄4Na++Si2O52−+2OH–
2SiO32−+2H2O⇄Si2O52−+2OH–
Получение
Действие кислот на растворимые силикаты:
Na2SiO3+2HCl=2NaCl+H2SiO3↓
|
Водород
|
Углерод
|
Кремний
|
Азот
|
I. C неметаллами
1) с О2: 2H2 + О2 = 2H2О
2) с S: H2 + S = H2S
3) с N2: 3H2 + N2 = 2NH3 аммиак
4) с галогенами (F2 Cl2 Br2 I2)
H2 + F2 = 2HF H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr H2 + I2 = 2HI
5) с углеродом (С) C + 2H2 = CH4
II. C металлами
1) с щелочными металлами (металлами I группы А- подгруппы:
Li Na K Rb Cs Fr)
2Na + H2 = 2 NaH – гидрид натрия
2) с щелочно-земельными металлами
Ca Sr Ba Ra Сa + H2 = СaH2
III. C оксидами металлов при нагревании (гидротермия)
CuO + H2 = Cu + H2О
WO3 + 3H2 = W + 3 H2О
|
I. C неметаллами
1) с О2: C + О2 = CО2 углекислый газ
2) с F2 (с другими галогенами не реагирует)
C + 2F2 = C F4
3) с серой (S): C +2S = CS2 сероуглерод
4) с кремнием (Si): C + Si = SiC карборунд
5) с водородом (H2) C + 2H2 = CH4
II. C металлами
1) Сa + 2C = СaC-1 2 – карбид кальция
2) 4Al + 3 C = Al4C-4 3 – карбид алюминия
III. C оксидами металлов при нагревании (карботермия) 2CuO + C = 2Cu + CО2
IV. C оксидом углерода (IV)
CО2 + C = 2 CО – угарный газ
V. с водой (H2О) при t C + H2О = CО + H2
VI. с кислотами-окислителями (H2SO4 конц. и НNO3)
C + 2 H2SO4 конц. = CО2 + 2 SО2 + H2О
C + 4 НNO3 конц. = CО2 + 4 NO2 + 2H2О
|
I. C неметаллами
1) с О2: Si + О2 = SiО2 - кремнезём
2) с F2 (с другими галогенами не реагирует)
Si + 2F2 = SiF4
3) с углеродом (С): C + Si = SiC карборунд
4) с азотом (N2): 3Si + N2 = Si3N4
5) с водородом (H2) не реагирует
II. C металлами (Mg, Cu, Fe)
1) 2Mg + Si = Mg2 Si – силицид магния
III. C оксидами металлов при нагревании
2 FeO + Si = 2Fe + SiО2
IV. Реагирует с плавиковой кислотой (HF)
Si + 4 HF = SiF4 + 2 H2
V. Реагирует с щелочами
Si + 2 NaОH + H2О = Na2 SiО3 + 2 H2
|
I. C неметаллами
1) с О2 при грозе: N2 + О2 = 2 NО
2) с F2 (с другими галогенами не реагирует) N2 + 3 F2 = 2 NF3
3) с кремнием (Si): N2 + 3Si = Si3N4
4) с водородом (H2): N2 + 3H2 = 2NH3
II. C металлами
1) с литием (остальные щелочные металлы не образуют устойчивых нитридов) 6Li + N2 = 2 Li3 N
2) с магнием и кальцием
3Mg + N2 = Mg3 N2 – нитрид магния
|
Фосфор
I. C неметаллами
1) с О2: 4P + 5 О2 = 2P2О5
2) с галогенами (F2 Cl2 Br2 I2)
2P + 5 Cl2 = 2 PCl5
3) с серой (S): 2P +3S = P2 S3
II. C металлами (почти со всеми)
3Na + P = Na3 P – фосфид натрия
3 Сa + 2 P = Сa3 P2
III. с кислотами-окислителями (H2SO4 конц. и НNO3)
3P +5 НNO3 разб.+2H2О = 3H3PО4+ 5NО
P +5 НNO3 конц. = H3PО4 + 5NО2 +H2О
2P+ 5H2SO4 конц =2H3PО4 +5SО2 +2H2О
IV. Реагирует с щелочами
4P+3KОH + 3H2О= PH3 + 3KH2PО2
|
Сера
I. C неметаллами
1) с О2: S + О2 = SО2 – сернистый газ
2) с с водородом (H2 : H2 + S = H2S
3) с галогенами (F2 Cl2 Br2 I2)
S + 3F2 = S F6
S + 2Cl2 = SCl4
4) c фосфором 2P +3S = P2 S3
5) с углеродом C +2S = CS2 сероуглерод
II. C металлами (почти со всеми)
2Na + S = Na2 S
III. с кислотами-окислителями (H2SO4 конц. и НNO3) S + 2H2SO4 конц. = 3SО2 + H2О
S + 6НNO3 конц. = 6 NО2 + H2SO4 + 2H2О
IV. Реагирует с щелочами
3 S + 6KОH = 2K2 S + K2SО3 + 3 H2О
|
Кислород
I. C неметаллами
1) с водородом (H2): 2H2 + О2 = 2H2О
2) с углеродом (С): C + О2 = CО2
3) с кремнием (Si): Si + О2 = SiО2
4) с азотом (N2): : N2 + О2 = 2 NО
5) c фосфором 4P + 5 О2 = 2P2О5
6) с серой (S): S + О2 = SО2 – сернистый газ
II. C металлами
1) с железом:
3Fe + 2О2 =Fe3О4 железная окалина
2) с щелочными металлами
2Na + О2 = Na 2O2-1 – пероксид натрия
2К + О2 = 2К 2O4 супероксид
(К−О-1−О0−О0−О-1−К)
3) с малоактивными металлами, кроме Au Pt: 2Cu + О2 = 2Cu О
III. C оксидами и гидроксидами, в которых степень окисления элемента промежуточная
2SО2 +О2=2SО3; 4Fe(ОН)2+О2+2H2О=4Fe(ОН)2
IV. с водородными соединениями
4 NH3 +5 О2 = 4 NО + 6 H2О
V. С органическими веществами (горение)
|
Хлор ( и другие галогены)
I. C неметаллами
1) с О2 не реагируют
2) с водородом (H2) H2 + Cl2 = 2HCl
3) c фосфором 2P + 5 Cl2 = 2 PCl5
4) с серой (S): S + 2Cl2 = SCl4
II. C металлами
1) с активными 2Na + Cl2 = 2 NaCl
2) средней активности
2Fe + 3Cl2 =2FeCl3
III. с водой (H2О)
Cl2+НОН =HCl + HClО
2F2 +2 H2О = 4 HF + О2
IV. с щелочами
Без t0 Cl2+2KОН =KCl + KClО + H2О
С t0 3Cl2+ 6KОН = 5KCl + KClО3 + 3H2О
2F2 +2KОН = 2 КF + F2О + H2О
V. вытесняют друг друга из растворов
(кроме F2) 2KBr + Cl2 = 2KCl + Br2
VI. С одноимёнными галогенидами, если элемент имеет промежуточную с.о.
2FeCl2 + Cl2 = 2 FeCl3
VII. с органическими веществами
СН4 + Cl2 = СН3Cl + HCl
С кислотами H2SO3 + I2 + H2O → H2SO4 + 2 HI
HNO2 + Cl2 + H2O → HNO3 + 2 HCl
|
1. Какие два из перечисленных веществ вступают в реакцию с оксидом серы(VI)?
1) нитратом натрия
2) хлором
3) оксидом алюминия
4) оксидом кремния
5) гидроксидом натрия
2. Какие два из перечисленных веществ вступают в реакцию с оксидом серы(IV)?
1) гидроксидом натрия
2) углеродом
3) кислородом
4) хлоридом железа(II)
5) сульфидом меди(II)
3. Какие два из перечисленных веществ вступают в реакцию с оксидом железа(III)?
1) гидроксидом меди(II)
2) хлоридом магния
3) серной кислотой
4) гидроксидом натрия
5) оксидом алюминия
4. Какие два из перечисленных веществ вступают в реакцию с оксидом меди(II)?
1)

2)

3)

4)

5)
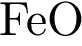 5.
5. Какие два из перечисленных веществ вступают в реакцию с оксидом фосфора(V)?
1) оксид углерода(II)
2) оксид натрия
3) сера
4) вода
5) оксид углерода(IV)
6. Из предложенного списка выберите две пары оксидов, между которыми возможна реакция
1)

и
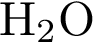
2)

и

3)
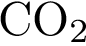
и

4)
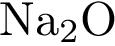
и

5)
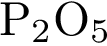
и
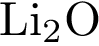 7.
7. Из
предложенного списка выберите две пары веществ, с каждым из которых оксид цинка реагирует при нормальных условиях:
1)
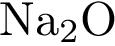
и
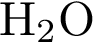
2)

и

3)

и
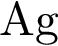
4)

и

5)
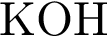
и
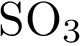
 Скачать 3.86 Mb.
Скачать 3.86 Mb.