задание 8 ОГЭ химия теория практика. 8 задание Химические свойства простых веществ металлов и немет. Задание 8 Химические свойства щелочных металлов (Na,K) Щелочные металлы
 Скачать 3.86 Mb. Скачать 3.86 Mb.
|
|
Водород (Н) — самый легкий газ из всех газообразных веществ. Имеет самую высокую теплопроводность и самую низкую температуру кипения (после гелия). Малорастворим в воде. При температуре –252,8°С и атмосферном давлении водород переходит в жидкое состояние. 1. Молекула водорода очень прочная, что делает ее малоактивной:H2=2H–432 кДж$. 2. При обычных температурах водород вступает в реакцию с активными металлами:Ca+H2=CaH2, образуя гидрид кальция, и с F2, образуя фтороводород:F2+H2=2HF. 3. При высоких температурах получают аммиак:N2+3H2=2NH3 и гидрид титана (металл в порошке):Ti+H2=TiH2. 4. При поджигании водород реагирует с кислородом: 2H2+O2=2H2O+484кДж. 5. Водород обладает восстановительной способностью: CuO+H2=Cu+H2O. Химические свойства галогенов: хлор, бром, йод. У галогенов наиболее ярко выражены свойства неметаллов. Г 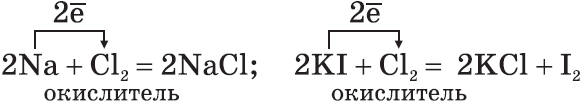 алогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой. алогены — вещества молекулярного строения. Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы этих веществ. Хлор — газ желто-зеленого цвета, бром — красно-коричневая жидкость, йод — твердое вещество серо-фиолетового цвета. Водные растворы галогенов в воде называют хлорной, бромной и йодной водой.1. Галогены — сильные окислители. Они окисляют простые и сложные вещества: 2. По окислительной активности каждый вышестоящий в Периодической таблице галоген является более сильным по отношению к нижестоящему. Поэтому каждый галоген вытесняет любой нижестоящий из его соединений: 3. Галогены активно реагируют с неметаллами: 4. Галогены реагируют с водой, образуя атомарный кислород: H2O+Cl2=2HCl+O;O+O=O2. 5. Галогены очень активны в присутствии воды. Так, сухой хлор хранят в железных баллонах, а во влажном хлоре железо быстро ржавеет (совместное действие с водой продуктов реакции — кислоты и атомарного кислорода). Водный раствор хлороводорода HCl называют соляной, или хлороводородной, кислотой. Соляная кислота принимает участие в пищеварении живых организмов. Химические свойства кислорода. Кислород (O) — самый распространенный элемент на Земле. Он находится в атмосфере (21% по объему), в земной коре (92%), в гидросфере (89%). O2-это газ без запаха, цвета и вкуса. Кислород малорастворим в воде. Тем-ра кип. равна –183°С; при этой температуре и давлении 1 атм. кислород превращается в жидкость голубого цвета. Кислород является одним из самых активных веществ, легко вступающих в химические реакции. Взаимодействие веществ с кислородом называется реакцией окисления этих веществ. Кислород принимает участие в таких окислительных процессах: горение, дыхание, ржавление металлов, гниение растительных и животных останков. Реакции окисления, сопровождающиеся выделением теплоты и света, называются реакциями горения: а) горение простых веществ: - неметаллов: C+O2=CO2;S+O2=SO2;4P+5O2=2P2O5;- металлов: 3Fe+2O2=Fe3O4, или FeO·Fe2O3. Эти процессы горения происходят быстро. Возможно и медленное горение — окисление:2Cu+O2=2CuO; б) горение сложных веществ: 2C2H2+5O2→4CO2+2H2O ацетилен У кислорода есть аллотропная модификация — озон O3. Он образуется под воздействием солнечного излучения или электрического разряда: Озон обладает запахом свежести. Разный состав молекул кислорода и озона определяет их разные свойства. Молекула озона очень непрочная, легко вступает в химические реакции. Озон проявляет сильные окислительные свойства, разрушает органические вещества (резину), окисляет металлы (Au,Pt,Ag):Ag+O3=AgO+O2↑(с кислородом серебро не реагирует) Химические свойства серы. Атомы серы, как и атомы кислорода, имеют на внешнем энергетическом уровне 6ē, два из них — неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют восстановительные свойства, образуя соединения со степенями окисления +2,+4,+6. По отношению к водороду и металлам сера проявляет окислительные свойства со степенью окисления –2. Сера (S) — твердое кристаллическое вещество желтого цвета, имеет молекулярную кристаллическую решетку, легко плавится, в воде нерастворима. Для серы характерна аллотропия. Ромбическая сера S8 — стабильная модификация. Образует кристаллы октаэдрической формы лимонно-желтого цвета с t°пл=112,8°С. Моноклинная сера имеет игольчатые кристаллы с t°пл=119,3°С, легко переходит в ромбическую. Пластическая сера имеет линейное строение молекул, темно-коричневый цвет. Ее получают при выливании расплавленной при 160°С серы в холодную воду — образуется резиноподобная темно-коричневая масса. Сера и ее соединения.
Химические свойства азота. Азот (N) — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три — неспаренные. Значит, атомы азота могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степени окисления –3 в соединениях с водородом (аммиак NH3) и с металлами (нитриды Li3N,Mg3N2). Отдавая свои внешние электроны более электроотрицательным элементам (фтору, кислороду), атомы азота приобретают степени окисления +3 и +5. Атомы азота проявляют восстановительные свойства в степенях окисления +1,+2,+4. Азот существует в свободном состоянии в виде молекулы N2, атомы связаны прочной ковалентной связью N≡N. Азот — бесцветный газ без запаха и вкуса, в атмосфере его содержится 78%. Азот — составная часть живых организмов. Важнейшими соединениями азота являются аммиак, азотная кислота и ее соли. Азотная кислота и аммиак производятся в промышленности в больших объемах, т.к. соли (NH4NO3,KNO3) являются удобрениями. Азотная кислота используется для получения красителей, пластмасс, взрывчатых веществ, лекарств. Азот — жизненно важный элемент, поэтому круговорот азота в природе обеспечивает им атмосферу, почву, растительные и живые организмы. Азот и его соединения.
| |||||||||||||||||||

 . Схема электронного строения иона аммония:
. Схема электронного строения иона аммония: