Краткая теория к заданиям ОГЭ по химии. Задание Атомы и молекулы. Химический элемент. Простые и сложные вещества
 Скачать 99.24 Kb. Скачать 99.24 Kb.
|
|
Краткая теория к заданиям ОГЭ по химии Задание 1.Атомы и молекулы. Химический элемент. Простые и сложные вещества Названия химического элемента и простого вещества в большинстве случаев совпадают, поэтому следует различать эти два понятия. Химический элемент — это определённый вид атомов. Атомы химического элемента могут входить в состав простых и сложных веществ. Можно охарактеризовать распространённость и формы нахождения химического элемента в природе, а также свойства его атомов (массу, размеры, строение). Простое вещество образовано атомами одного химического элемента. Это одна из форм существования химического элемента в природе. Простое вещество характеризуется определённым составом, строением, физическими и химическими свойствами. Его применяют для получения других веществ.
Задания 2, 6. Строение атома. Строение электронных оболочек атомов Порядковый номер элемента численно равен заряду ядра его атома, числу протонов в ядре N и общему числу электронов в атоме. Число электронов на последнем (внешнем) слое определяется по номеру группы химического элемента. Число электронных слоев в атоме равно номеру периода. Массовое число атома A (равно относительной атомной массе, округленной до целого числа) - это суммарное количество протонов и нейтронов.
Количество нейтронов N определяют по разности массового числа А и числа протонов Z. Изотопы – атомы одного химического элемента, имеющие в ядре одинаковое число протонов, но разное число нейтронов, т.е. одинаковый заряд ядра, но разную атомную массу. Задание 3. Периодический закон и Периодическая система элементов Задание 4. Валентность и степень окисления химических элементов Степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Правила определения степени окисления элемента в соединении: С.О. свободных атомов и простых веществ равна нулю. Сумма степеней окисления всех атомов в сложном веществе равна нулю. Металлы имеют только положительную С.О. С.О. атомов щелочных металлов (I(А) группа) +1. С.О. атомов щелочноземельных металлов (II(А) группа)+2. С.О. атомов бора, алюминия +3. С.О. атомов водорода +1 (в гидридах щелочных и щелочноземельных металлов –1). С.О. атомов кислорода –2 (исключения: в пероксидах –1, в OF2 +2). С.О. атомов фтора всегда - 1. Степень окисления одноатомного иона совпадает с зарядом иона. Высшая (максимальная, положительная) С.О. элемента равна номеру группы. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIIIгруппы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор. Низшая (минимальная, отрицательная) С.О. для элементов неметаллов определяется по формуле: номер группы -8. * С.О. – степень окисления Валентность атома – это способность атома образовывать определенное число химических связей с другими атомами. Валентность не имеет знака. Валентные электроны располагаются на внешнем слое у элементов А - групп, на внешнем слое и d – подуровне предпоследнего слоя у элементов В - групп. ( Валентности некоторых элементов (обозначаются римскими цифрами).
Примеры определения валентности и С.О. атомов в соединениях:
Задание 5. Строение молекул. Химическая связь 1) Ковалентная неполярная – атомы в молекуле одинаковы:N2, O2, O3, CI2,Br2, I2,F2 (ЭО одинакова) 2)Ковалентная полярная - атомы в молекуле состоят из разных атомов неметаллов – ЭО отличается незначительно, появляется смещение электронной пары к более ЭО элементу - кислотные оксиды, например: N2O5, P2O5, SO2, Н2О , все кислоты Н2S, HCl 3)Ионная связь- между ионами: металла и неметалла- ЭО резко отличается, металл отдает электрон неметаллу (основные оксиды СаО, щелочи, н-р NaOH, соли н-р, NaCI , нитриды , фосфиды, карбиды, силициды металлов, при гидролизе которых образуются соответственно аммиак (NH3), фосфин (PH3) , метан CH4 (Al4C3) или ацетилен C2H2 (CaC2) и силан (SiH4).Ионная связь в солях аммония! (NH4Cl, NH4NO3 и т.д.) 4) Металлическая связь ионы металла Кристаллические решетки: 1)атомные – в узлах атомы, это вещества с ковалентной связью, с высокой температурой плавления, твердые- алмаз, графит (С), SiO2 2)молекулярные- в узлах молекулы, это газы, жидкости, низкая тем. пл. и кипения, хрупкие (иод), твердые - сера 3) ионные, с высокой темпер. плавления, твердые –это соли 4) металлические в узлах ионы металлов Задание 7. Простые и сложные вещества. Классы неорганические соединений 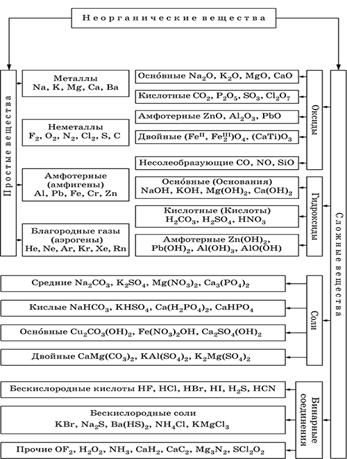 Задания 8, 9, 10. Химические свойства простых веществ: металлов и неметаллов Химические свойства классов неорганических соединений Свойства металлов
С кислотами взаимодействуют только металлы, которые находятся в ряду активности левее водорода. Т.е. неактивные металлы Cu, Hg, Ag, Au, Pt с кислотами не реагируют. Исключение составляют HNO3 (конц, разбавл.), H2SO4 (конц.) HNO3 (конц.), H2SO4 (конц.) пассивируют Fe, Al, Сr (при н.у.) Cu,Hg, Ag восстанавливают кислоты до следующих продуктов:
Химические свойства неметаллов Неметаллы реагируют с металлами и между собой. 1) H2+Ca →CaH2 2) N2+ 3Ca → Ca3N2 3) N2+ O2 ↔ 2NO 4) S + O2 → SO2 5) N2+ 3H2 → 2NH3 6) 2P + 3Cl2 → 2PCl3 или 2P + 5Cl2 → 2PCl5 Свойства галогенов можно объединить: 1) реагируют со щелочами: Cl2 + 2NaOH → NaCl + NaClO + H2O (в холодном растворе) 3Cl2 + 6NaOH → NaCl + 5NaClO3 + H2O (в горячем растворе) 2) более активный галоген (вышестоящий в группе, кроме фтора, так как он реагирует с водой) вытесняет менее активные галогены из растворов галогенидов. Cl2 + 2KBr →Br2 + 2KCl, но Br2 + KCl ≠ 3) 2F2 + O2 → 2O+2F2 (фторид кислорода) 4) Запомнить: 2Fe + 3Cl2 → 2Fe+3Cl3 и Fe + 2HCl → Fe+2Cl2 + H2 Окислительные свойства галогенов усиливаются по группе снизу вверх. Химические свойства классов неорганических веществ
Генетическая связь неорганических соединений Металл- основной оксид- основание- соль (Na -Na2O –NaOH – Na2SO3) Неметалл – кислотный оксид – кислота – соль ( S – SO2 – H2SO3 - Na2SO3) Амфотерные соединения Растворяются и в кислотах, и в щелочах!
Задание 11. Типы химических реакций. По числу и составу исходных и полученных веществ различают реакции: Соединения А+В = АВ (справа одно соеинение) Разложения АВ = А+ В (слева одно соединение) Замещения А + ВС = АС + В (слева одно простое, одно сложное вещество) Обмена АВ + СD = AD + CB (слева и справа сложные вещества) Реакции обмена между кислотами и основаниями – реакции нейтрализации. Задания 12, 17. Признаки реакций Качественные реакции на ионы в растворе.
Задания 13, 14. Электролитическая диссоциация, ионный обмен Индикаторы – вещества, меняющие цвет в присутствии кислот и щелочей.
Электролиты – вещества, которые в водных растворах и расплавах распадаются на ионы, вследствие чего их водные растворы или расплавы проводят электрический ток.
1.Кислоты – электролиты, при диссоциации которых в водных растворах в качестве катионов образуется только катионы Н+. Многоосновные кислоты диссоциируют ступенчато. 2.Основания – электролиты, при диссоциации которых в качестве анионов образуется только гидроксид-анионы ОН-. Многокислотные основания диссоциируют ступенчато. 3.Соли средние – электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка. Средние соли диссоциируют нацело. 4.Катионы имеют положительный заряд; анионы – отрицательный. 5.Диссоциация описывается уравнением диссоциации. 6.Существуют сильные и слабые электролиты (по степени диссоциации) Реакции с участием электролитов, протекающие в растворах (вещества находятся в виде ионов), называются ионными. 1.Реакции ионного обмена идут до конца, если образуется осадок, газ или малодиссоциирующее вещество, например вода. 2.В ионных уравнениях вещества-электролиты записывают в виде ионов, в неизменном виде надо оставлять формулы неэлектролитов, нерастворимых веществ, слабых электролитов, газов (например, H2S, H2O+CO2, H2O+SO2, HF, H3PO4, H2SiO3, CH3COOH, NH3+H2O) Правила составления ионных уравнений: составить молекулярное уравнение реакции (коэффициенты!); проверить возможность протекания реакции; отметить вещества (подчеркнуть), которые будут записываться в молекулярном виде (простые вещества, оксиды, газы, нерастворимые вещества, слабые электролиты); записать полное ионное уравнение реакции; вычеркнуть из левой и правой части одинаковые ионы; переписать сокращённое ионное уравнение. Задания 15, 20. Окислительно -восстановительные реакции Окислительно-восстановительные реакции (ОВР), в процессе которых происходит изменение степеней окисления химических элементов. Если в реакции участвует простое вещество – это всегда ОВР!!! Реакции замещения – это всегда ОВР!!! Не окислительно-восстановительные реакции, в процессе которых не происходит изменения степеней окисления химических элементов. Реакции обмена всегда не ОВР!!! 1.Окислитель принимает электроны, происходит процесс восстановления. С.О. элемента при этом уменьшается. 2.Восстановитель отдает электроны, происходит процесс окисления. С.О. элемента возрастает. 3. Атомы с минимальными значениями степени окисления могут быть только восстановителями. 4. Атомы с максимальными значениями степени окисления могут быть только окислителями. 5. Атомы с промежуточными значениями степени окисления могут быть и окислителями, и восстановителями. Важнейшие восстановители:металлы; водород H2; уголь C; оксид углерода(II) CO; сероводород H2S, сульфиды K2S; галогеноводороды HI, HBr; аммиак NH3. Важнейшие окислители: галогены F2, Cl2; кислород O2, озон O3; соединения марганца KMnO4; азотная кислота HNO3 и её соли KNO3; концентрированная серная кислота H2SO4; ионы металлов. Задание 16. Безопасность в лаборатории. Смеси. Химическое загрязнение Чистые вещества и смеси. Чистое вещество имеет определенный постоянный состав или структуру, физические свойства (соль, сахар). Смесь – это система, состоящая из двух и более компонентов (чистых веществ). Вещества в смесях сохраняют свои свойства, поэтому смеси можно разделить, используя различия в этих свойствах. Смеси могут быть однородными (нельзя обнаружить частицы веществ даже вооруженным глазом) и неоднородными. Разделить смеси можно, используя их физические свойства: Железо, сталь притягиваются магнитом, остальные вещества – нет. Песок и др. нерастворим в воде. Измельченная сера, опилки всплывают на поверхность воды. Несмешивающиеся жидкости можно разделить с помощью делительной воронки. Однородную смесь жидкостей разделяют дистилляцией. Получение и собирание некоторых газов О2 - разложение перманганата калия при нагревании: 2КМnO4= К2МnO4 +MnO2 + О2 (выт-ем воздуха или воды, в сосуд, расположенный вниз дном, проверка- тлеющая лучина загорается). Водород получают: цинк + кислота, пробирка перевернута вверх дном, Н2 горит со звуком «па» Zn+ 2HCl= ZnCI2 +Н2 Аммиак NH3 получают, собираяв пробирку вверх дном, нагревая соль аммония и твердую щелочь, выт-ем воздуха, лакмус синеет, среда щелочная 2NH4CI+Ca(OH)2=CaCI2+2NH3+2H2O; Углекислый газ СО2 мрамор + кислота СаCO3+ 2HCl=CaCI2+ H2O+СО2 лучина гаснет, пробирка вниз дном, помутнение известковой воды
Некоторые правила безопасной работы в лаборатории: Работать с едкими веществами надо в перчатках. Получение таких газов, как SO2, Cl2, NO2, NH3 надо проводить только под тягой. Нельзя нагревать легковоспламеняющиеся вещества на открытом огне. При нагревании жидкости в пробирке, надо сначала прогреть всю пробирку и держать ее под углом 30-450 C. Правила безопасности при работе с бытовой химией: Применять химические товары нужно, используя индивидуальные средства защиты - повязку и перчатки. «Химию» необходимо применять только по назначению. Химическую продукцию нельзя подвергать воздействию прямых солнечных лучей или открытого пламени. При использовании бытовой химии рекомендации по дозировке и периодичности применения являются обязательными к соблюдению. Химические средства с просроченным сроком годности категорически запрещено использовать. Не оставляйте бытовую химию без присмотра или в доступном для детей месте. Не используйте и не храните бытовую химию в непосредственной близости с пищевыми продуктами. Проблемы химического загрязнения планеты. Некоторые из этих проблем: Кислотные осадки (SO2, NO2, CO2) Парниковый эффект (CH4, CO2) Общее загрязнение атмосферы, воды, почвы (соли Pb2+, Cd2+, Cu2+, Hg2+ и чистая ртуть) Озоновая дыра (фреоны) Радиоактивное загрязнение. Задания 21, 23, 24.Химические свойства простых и сложных веществ. Экспериментальная задача. Лабораторная работа Алгоритм выполнения заданий. 1. Составить цепочку взаимных превращений веществ, отражая генетическую связь. Для составления цепочки превращений целесообразно отталкиваться от формулы вещества, которое необходимо получить («начать с конца»). Затем подобрать в списке исходных веществ то, которое могло бы являться «родоначальником» цепочки. Проанализировать, какие вещества способны к взаимодействию с предполагаемым исходным веществом. Причем, продукт этого взаимодействия мог бы послужить реагентом для получения конечного продукта. 2. Записать соответствующие уравнения реакций, расставить в них коэффициенты, указать тип реакций, условия их протекания (например, выделение газа или выпадение осадка). 3. В произвольной форме охарактеризовать (записать) вещества-реагенты и вещества-продукты реакции (класс веществ) и указать признаки реакций. 4. Составить сокращенное ионное уравнение в соответствии с заданием. 5. Провести эксперимент в лаборатории, комментируя свои действия. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
