29.Скорость химической реакции. Закон действующих масс. Константа скорости.Скорость гомогенной (однофазной) реакции зависит от природы реагирующих веществ, их концентрации и температуры.Скорость гетерогенных (многофазных) процессов зависят от размеров и состояния поверхности раздела фаз.Примечание. Гетерогенные – процессы, происходящие на поверхности раздела соприкасающихся фаз. (горение топлива, окисление металлом кислородом воздуха).Закон действующих масс.Справедлив для гомогенных реакций.Формулировка: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Константа скорости обозначается как  Пример. Пример.   в квадратных скобках концентрации веществ. в квадратных скобках концентрации веществ.   «к» не зависит от концентрации в каждый момент времени. «к» не зависит от концентрации в каждый момент времени.
30.Молекулярность и порядок реакции.Реакции с точки зрения частиц классифицируются по признаку молекулярности или по признаку порядка последних.Молекулярность определяется по числу молекул, одновременное соударение которых приводит к химическому воздействию.Одномолекулярная реакция.   с – концентрация исходного вещества. Двухмолекулярная реакция. с – концентрация исходного вещества. Двухмолекулярная реакция.  
Трехмолекулярная реакция.  
Порядок реакции =сумме показателей степеней у концентраций в уравнении, выражающем зависимость скорости реакции от концентраций реагирующих веществ.Реакция  формально 3хмолекулярна, но фактически яв-ся 2хмолекулярной, так как реакция протекает в 2 стадии: формально 3хмолекулярна, но фактически яв-ся 2хмолекулярной, так как реакция протекает в 2 стадии: 
|
31.Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.По степени сложности реакции подразделяются на изолированные, параллельные, сопряженные, последовательные (многоступенчатые), обратимые и необратимые.Изолированные – при их протекании образуются продукты только одного типа.Параллельные – в ходе них взятые вещества одновременно реагируют в двух или более направлениях (образуются разные продукты).Пример. Разложение бертолетовой соли Скорость реакции: Скорость реакции:  Сопряженные – совместные реакции типа: Сопряженные – совместные реакции типа:  Вторая реакция протекает лишь совместно с первой.А – актор реакции, B – индуктор реакции, С – акцептор.Последовательные. Вторая реакция протекает лишь совместно с первой.А – актор реакции, B – индуктор реакции, С – акцептор.Последовательные.  В – промежуточный продукт.Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции: В – промежуточный продукт.Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции:  Различают практически необратимые и совершенно необратимые реакции.Практически необратимые – реакции, в результате которых образуется осадок.Совершенно необратимые – протекают только в одном направлении. Пример. Различают практически необратимые и совершенно необратимые реакции.Практически необратимые – реакции, в результате которых образуется осадок.Совершенно необратимые – протекают только в одном направлении. Пример.  Более подробно рассмотрим обратимую реакцию: Более подробно рассмотрим обратимую реакцию: 
  
|
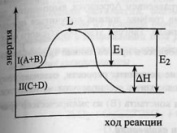 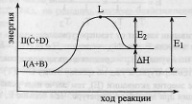 32.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.Согласно правилу Вант-Гоффа, повышение темп-ры на каждые 100 увеличивает ск-ть реакции в 2-4 раза. 32.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.Согласно правилу Вант-Гоффа, повышение темп-ры на каждые 100 увеличивает ск-ть реакции в 2-4 раза. темп-ный коэфф-т ск-ти р-и. темп-ный коэфф-т ск-ти р-и. Пример. Пример. и и  тогда тогда  С ростом темп-ры происходит перераспределение эн.м/у мол-лами так, что резко возрастает число акт-х молекул, обладающих некоторым избытком эн-и (эн. активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.С. Аррениус установил опытным путем зависимость: С ростом темп-ры происходит перераспределение эн.м/у мол-лами так, что резко возрастает число акт-х молекул, обладающих некоторым избытком эн-и (эн. активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.С. Аррениус установил опытным путем зависимость:  к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции. к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции. .Физич.смысл эн.активации. Рассмотрим график изменения эн. в процессе протекания экзотермической реакции. Уровень L отвечает наименьшему запасу энергии у молекул, которые необходим для их результативного столковения.Разность L и I – энергия активации прямой реакции, L и II – обратной.По пути из исходного состояния в конечное система должна пройти через некоторый энергетический барьер. И только акт-е молекулы могут его преодолеть. Рассмотрим график изменения эн-и в процессе протекания эндотерм-й реакции..Проведем небольшие преобразования: .Физич.смысл эн.активации. Рассмотрим график изменения эн. в процессе протекания экзотермической реакции. Уровень L отвечает наименьшему запасу энергии у молекул, которые необходим для их результативного столковения.Разность L и I – энергия активации прямой реакции, L и II – обратной.По пути из исходного состояния в конечное система должна пройти через некоторый энергетический барьер. И только акт-е молекулы могут его преодолеть. Рассмотрим график изменения эн-и в процессе протекания эндотерм-й реакции..Проведем небольшие преобразования:   - эмпирическое ур-е Аррениуса. - эмпирическое ур-е Аррениуса.
|
33.Энергия активации химической реакции. Аналитический и графический метод расчета.С ростом температуры происходит перераспределение энергии между молекулами так, что резко возрастает число активных молекул, облаающих некоторым избытком энергии (энергией активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.С. Аррениус установил опытным путем зависимость:  где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции. где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции. (энергия активации, постоянная – 8,31).Графический расчет энергии активации.По опытным данным строят график зависимости (энергия активации, постоянная – 8,31).Графический расчет энергии активации.По опытным данным строят график зависимости  от обратной температуры. Если закон выполняется, на графике должна получиться прямая линия. Тангенс угла, образуемого Ох и прямой, от обратной температуры. Если закон выполняется, на графике должна получиться прямая линия. Тангенс угла, образуемого Ох и прямой,  Аналитический расчет энергии активации.Полагая, что в небольшом интервале Аналитический расчет энергии активации.Полагая, что в небольшом интервале  энергия постоянна, можно написать: энергия постоянна, можно написать:    Энергия активации зависит от температуры.Чем меньше энергия, тем легче идет реакция и тем больше скорость реакции при данной температуре.Реакции с энергией меньше Энергия активации зависит от температуры.Чем меньше энергия, тем легче идет реакция и тем больше скорость реакции при данной температуре.Реакции с энергией меньше  протекают практически мгновенно. протекают практически мгновенно.
|
34.Ск-ть гетерогенной хим.реакции. Особенности ее протекания.Гетерогенные (многофазные) реакции происходят на поверх-ти раздела соприкасающихся фаз. относятся: горение топлива, окисление металлов кислородом, растворение газа в жидкостях.Ск-ть реакций зависит от размеров и состояния поверхности раздела фаз. Гетерогенные процессы многостадийны. Кроме осн-го процесса,обязательны стадии подвода к этой поверх-ти исходных веществ и отвода от нее продуктов реакции.Если определяющей стадией является хим.реакция на поверхности раздела фаз, то процесс описывается законами хим.кинетики Если, как это обычно бывает, наиболее медленно совершается подвод и отвод, то процесс описывается законами диффузии . Повышение темп-ры на каждые 100 увеличивает коэффициент диффузии на 20%, тогда как скорость реакции увеличивается в 2-4 раза.Диффузия оказывает большое влияние на протекание гетерогенных процессов.1й закон диффузии.Масса веществ  переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени  и градиенту концентрации и градиенту концентрации   Ск-ть диффузии Ск-ть диффузии   Знак «-» указывает, что процесс диффузии направлен в сторону понижения концентрации. Знак «-» указывает, что процесс диффузии направлен в сторону понижения концентрации. Е – энергия активации.2й закон диффузии выражает зависимость изменения концентрации в объеме одной из соприкасающихся фаз от времени: Е – энергия активации.2й закон диффузии выражает зависимость изменения концентрации в объеме одной из соприкасающихся фаз от времени:  Стационарная диффузия.При СД концентрация меняется только с расстоянием (х), от времени – нет. Стационарная диффузия.При СД концентрация меняется только с расстоянием (х), от времени – нет.  => =>   а – градиент концентрации.Эффективный путь диффузии.при а – градиент концентрации.Эффективный путь диффузии.при      толщина диффузионного слоя.Ур-е стационарной диффузии. толщина диффузионного слоя.Ур-е стационарной диффузии.  коэффициент массопередачи коэффициент массопередачи  Ск-ть растворения тв.тела в жидкостях.Поверхность тв. тела – S, концентрация насыщенного раствора - Ск-ть растворения тв.тела в жидкостях.Поверхность тв. тела – S, концентрация насыщенного раствора - конц-я в объеме раствора - конц-я в объеме раствора -  толщина диффузионного слоя - толщина диффузионного слоя -  Ск-ть растворения значительно больше ск-ти диффузионного переноса вещества в объем раствора.Кол-во вещества, растворяющегося в единицу времени, - L.Фактически ск-ть процесса Ск-ть растворения значительно больше ск-ти диффузионного переноса вещества в объем раствора.Кол-во вещества, растворяющегося в единицу времени, - L.Фактически ск-ть процесса  k – константа скорости, k – константа скорости, 
Ур-е стационарной диффузии: 
|
35.Инициирование химической реакции. Катализ. Сущность гомогенного и гетерогенного катализа. Инициирование-наиб.энергоемкая стадия цепной реакции,ее эн.ативации опрэнергией разрываемой хим.св.. Катализ-Изменение скорости реакции под действием некоторых веществ (катализаторов) Различают положит.катализ и антикатализ. При катализе ск-ть реакции увелич-ся, при антикатализе - уменьшается. Вещества, увеличивающие скорость реакции-катализаторы,уменьшающ.- ингибиторы. Как правило катализатор при реакции не расходуется, ингибитор расходуется.Существует также и автокатализ - в роли катализатора вытсупают продукты реакции.Пример: FeO+H2=Fe+H2O Катализаторы не влияют на (изменение св.эн.системы) реакции, следовательно и на константу равновесия. Катализатор лишь ускоряет наступление равновесия реакции, но не смещает его.Для катализаторов присуща определенная избирательность. Различают гомогенный и гетерогенный катализ. В первом случае реагирующие вещества и катализатор составляют одну фазу.Пример: (изменение св.эн.системы) реакции, следовательно и на константу равновесия. Катализатор лишь ускоряет наступление равновесия реакции, но не смещает его.Для катализаторов присуща определенная избирательность. Различают гомогенный и гетерогенный катализ. В первом случае реагирующие вещества и катализатор составляют одну фазу.Пример:  Ск-ть реакции прямо пропорциональна количеству катализатора.Механизм можно объяснить образованием промежуточных нестойких соединений. Реакции идут с меньшей энергией активации => быстрее.Пример: Ск-ть реакции прямо пропорциональна количеству катализатора.Механизм можно объяснить образованием промежуточных нестойких соединений. Реакции идут с меньшей энергией активации => быстрее.Пример:  Основная причина ускоряющего действия – уменьшение эн.активации.Во втором случае – разные фазы.Пример: Основная причина ускоряющего действия – уменьшение эн.активации.Во втором случае – разные фазы.Пример:  Имеет значение не количество катализатора, а состояние его поверхности.Катализатор чаще всего находится в твердой фазе.Твердые катализаторы – оксиды, сульфиды, металлы и соли.Иногда достаточно простого контакта для огромного увеличения скорости. Пример. Имеет значение не количество катализатора, а состояние его поверхности.Катализатор чаще всего находится в твердой фазе.Твердые катализаторы – оксиды, сульфиды, металлы и соли.Иногда достаточно простого контакта для огромного увеличения скорости. Пример.  при добавлении при добавлении  Твердые катализаторы могут терять свою активность под действием каталитических «ядов» - соединений мышьяка, фосфора, цианидов, сероводорода, ацетилена, кислорода.Поскольку малые количества ядов способны отравлять большие массы катализатора. Это говорит о том, что работает не весь катализатор, а лишь его активные центры.Согласно теории мультиплетов, сущ.определенные закономерности, связывающие расстояния между атомами и расстояния между активными центрами катализатора. Мультиплет – активный центр на поверхности катализатора, состоящий из нескольких атомов или ионов, имеющий правильную конфигурацию, зависящую от строения всей кристаллической решетки катализатора.Для протекания определенной реакции молекула должна расположиться особым образом относительно двух активных центров.Отрицательный катализ вызывается ингибиторами. Они могут расходоваться при протекании процесса. Их действие заключается в том, что они связывают положит. катализаторы либо мешают положительному катализу.С помощью ингибиторов защищают металл от коррозии в жидких средах, тормозят окислительные процессы в маслах и топливе. Твердые катализаторы могут терять свою активность под действием каталитических «ядов» - соединений мышьяка, фосфора, цианидов, сероводорода, ацетилена, кислорода.Поскольку малые количества ядов способны отравлять большие массы катализатора. Это говорит о том, что работает не весь катализатор, а лишь его активные центры.Согласно теории мультиплетов, сущ.определенные закономерности, связывающие расстояния между атомами и расстояния между активными центрами катализатора. Мультиплет – активный центр на поверхности катализатора, состоящий из нескольких атомов или ионов, имеющий правильную конфигурацию, зависящую от строения всей кристаллической решетки катализатора.Для протекания определенной реакции молекула должна расположиться особым образом относительно двух активных центров.Отрицательный катализ вызывается ингибиторами. Они могут расходоваться при протекании процесса. Их действие заключается в том, что они связывают положит. катализаторы либо мешают положительному катализу.С помощью ингибиторов защищают металл от коррозии в жидких средах, тормозят окислительные процессы в маслах и топливе.
|
36.Дисперсные системы. Коллоидные растворы.Д.с.Это система из двух и более в-в,которые практически не смешиваются и не реагируют друг с другом. Состоят из двух и более фаз(тел)с сильно развитой поверхностью раздела.в грубодисперсных системах частицы имеют размер от 10-4и выше,в коллоидных системах от 10-7 до 10-5-10-4. Дисп.сист.: эмульсии(масло в воде), сустензии(глина в воде),коллоидные растворы.
Коллоидные растворы -высокодисперсные системы частицы интенсивно участвуют в броуновском движении,заполняя вечь объем дисперсной системы. Коллоидные частицы способны рассеивать свет.
|
|
 Скачать 0.77 Mb.
Скачать 0.77 Mb.