|
Закон Авогадро. В равных vах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул|
|
46.Произведение растворимости.
произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
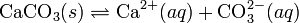
Константа этого равновесия рассчитывается по уравнению: 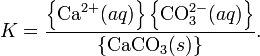
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
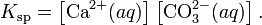
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению: 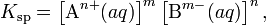
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
|
47.Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.Любая ОВР состоит из процессов окисления и восстановления.Окисление – отдача электронов веществом, т.е повышение степени окисления элемента.Пример.  Вещества, отдающие электроны, называют восстановителями.Типичные восстановители: водород, металлы, углерод.Восстановление – смещение электронов к веществу или понижение степени окисления.Пример. Вещества, отдающие электроны, называют восстановителями.Типичные восстановители: водород, металлы, углерод.Восстановление – смещение электронов к веществу или понижение степени окисления.Пример.  Вещества, принимающие электроны, называют окислителями.Типичные окислители: галогены, водород, соединения кислорода Вещества, принимающие электроны, называют окислителями.Типичные окислители: галогены, водород, соединения кислорода  Существуют реакции межмолекулярные (окислители и восстановители – разные вещества) и внутримолекулярные (окислители и восстановители – атомы одной молекулы). Существуют реакции межмолекулярные (окислители и восстановители – разные вещества) и внутримолекулярные (окислители и восстановители – атомы одной молекулы).
Пример.
 
|
48.Возникновения скачка потенциала на границе раздела «металл-расствор». Равновесный электродный потенциал.Электрохимия – область физической химии, охватывающая химические процессы, сопровождающиеся возникновением электрического тока, либо вызванные действием электрического тока.Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. В объеме металла устанавливается подвижное равновесие: Ме=Men++ n*ē. При погружении электрода в воду катионы металла гидратируются полярными молекулами воды и переходят в раствор, Men++ mH2O=Meрn+m*H2O. Поверхность электрода заряжается отрицательно за счет оставшихся электронов, из-за этого перешедшие в раствор катионы не могут отойти от электрода. Катионы и электроны создают двойной электрический слой (его толщина зависит от концентрации раствора, температуры, заряда металла). Пограничный слой жидкости заряжается положительно, поверхность металла отрицательно, возникает скачок электрического потенциала – электродный потенциал.Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения – равновесный потенциал.Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости – положительно.Данный скачок можно охарактеризовать реакцией:  Рассмотрим погружение в раствор активного и неактивного металла.1. Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.2. Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя. Рассмотрим погружение в раствор активного и неактивного металла.1. Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.2. Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя.
|
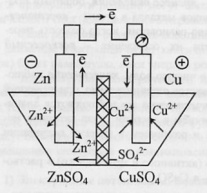 49.Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.Рассмотрим систему, в которой медь и цинк в виде пластинок помещены в растворы своих солей, разделенных перегородкой – диафрагмой. При разомкнутой цепи электроды приобретают равновесные потенциалы, которые отличаются по знаку и по величине. При ее замыкании электроны от цинкового электрода перемещаются к медному. На электродах нарушается равновесие: 49.Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.Рассмотрим систему, в которой медь и цинк в виде пластинок помещены в растворы своих солей, разделенных перегородкой – диафрагмой. При разомкнутой цепи электроды приобретают равновесные потенциалы, которые отличаются по знаку и по величине. При ее замыкании электроны от цинкового электрода перемещаются к медному. На электродах нарушается равновесие:  Получают развитие две реакции: на катоде – окисление Zn=Zn2++2ē, на аноде – восстановление Cu2++2ē=Сu0.Суммарная реакция: Получают развитие две реакции: на катоде – окисление Zn=Zn2++2ē, на аноде – восстановление Cu2++2ē=Сu0.Суммарная реакция:  Гальванический элемент на основе такой реакции был предложен русским ученым Якоби. Создателем является и ученый Даниэль.В связи с восстановлением катионов у медного электрода накапливается избыток анионов SO22-, а у цинкового электрода их недостаток. Эти анионы начинают перемещаться через полупроницаемую перегородку, замыкая цепь.Причина возникновения тока – разность потенциалов на электродах. ЭДС элемента – максимальная разность потенциалов, отвечающая обратимым условиям работы гальванического элемента. Она равна алгебраической сумме отдельных скачков потенциалов на границах раздела фаз, образующих элемент. Очевидно, чем больше ЭДС, тем быстрее протекает реакция окисления-восстновления.Гальваническая цепь – последовательная совокупность скачков потенциалов на поверхностях раздела, отвечающих данному гальваническому элементу. В данном случае цепь записывается: Гальванический элемент на основе такой реакции был предложен русским ученым Якоби. Создателем является и ученый Даниэль.В связи с восстановлением катионов у медного электрода накапливается избыток анионов SO22-, а у цинкового электрода их недостаток. Эти анионы начинают перемещаться через полупроницаемую перегородку, замыкая цепь.Причина возникновения тока – разность потенциалов на электродах. ЭДС элемента – максимальная разность потенциалов, отвечающая обратимым условиям работы гальванического элемента. Она равна алгебраической сумме отдельных скачков потенциалов на границах раздела фаз, образующих элемент. Очевидно, чем больше ЭДС, тем быстрее протекает реакция окисления-восстновления.Гальваническая цепь – последовательная совокупность скачков потенциалов на поверхностях раздела, отвечающих данному гальваническому элементу. В данном случае цепь записывается:   1 и 3 – скачки на границах «электрод-электролит», 2 – на границе электролита, 4 – на границе двух металлов.Величиной 1 и 3 – скачки на границах «электрод-электролит», 2 – на границе электролита, 4 – на границе двух металлов.Величиной  можно пренебречь. можно пренебречь.
|
50.Зависимость ЭДС гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная ЭДС.Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.Влияние природы реагирующих веществ.Пусть протекает реакция:  Максимальная полезная работа: Максимальная полезная работа: 
  Реакция2: Реакция2:   Вывод. В зависимости от природы веществ, ЭДС будет меняться.Влияние температуры.Согласно уравнению Гиббса-Гельмгольца, работа реакции. При наличии исходных термохимических данных можно рассчитать ЭДС. 2)Зависимость от температуры: Вывод. В зависимости от природы веществ, ЭДС будет меняться.Влияние температуры.Согласно уравнению Гиббса-Гельмгольца, работа реакции. При наличии исходных термохимических данных можно рассчитать ЭДС. 2)Зависимость от температуры:  Сделаем подстановки: Сделаем подстановки:     Qp – теплота реакции, которая выделяется или поглощается при ее необратимом проведении. Если реакция протекает обратимо, то часть энергии реакции превращается в работу А, а часть q остается в виде теплоты в элементе, q характеризует связанную энергию.Определив градиент ЭДС, можно вычислить изменение энтропии для реакции.Если q<0, Qp – теплота реакции, которая выделяется или поглощается при ее необратимом проведении. Если реакция протекает обратимо, то часть энергии реакции превращается в работу А, а часть q остается в виде теплоты в элементе, q характеризует связанную энергию.Определив градиент ЭДС, можно вычислить изменение энтропии для реакции.Если q<0,  т.е. ЭДС уменьшается с ростом температуры.Если q>0, т.е. ЭДС уменьшается с ростом температуры.Если q>0,  т.е. ЭДС растет с ростом температуры.Для гальванических элементов q подбирают малом, чтобы т.е. ЭДС растет с ростом температуры.Для гальванических элементов q подбирают малом, чтобы  Влияние концентрации.Пусть реакция Влияние концентрации.Пусть реакция  Изотерма реакции: Изотерма реакции:  Преобразуем и получим: Преобразуем и получим:  Обозначим первое слагаемое за Обозначим первое слагаемое за  Это стандартная ЭДС, она отвечает случаю равенства единице концентраций всех участвующих веществ, т.е. стандартному изменению свободной энергии реакции Это стандартная ЭДС, она отвечает случаю равенства единице концентраций всех участвующих веществ, т.е. стандартному изменению свободной энергии реакции 
|
51.Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.В настоящее время невозможно рассчитать или экспериментально определить абсолютное значение потенциала на отдельно взятом электроде (абсолютный электродный потенциал).Поэтому значение потенциала на электроде всегда определяется по отношению к эталонному электроду, потенциал которого условно принимается за нуль.В электрохимии таким электродом является нормальный водородный элемент.Его устройство: в стеклянный сосуд сложной формы залит раствор серной кислоты такой концентрации, что  В него опущена платиновая пластинка, покрытая платиновой чернью. Снизу в сосуд подается газообразный водород. Насыщенная им пластина ведет себя как водородный электрод. То есть имеет место равновесие: (губчатая пластина) – платиновый электрод, Р=1атм. Водород омывает платину, растворяется в ней. Насыщенная водородом платина начинает вести себя как водородный электрод, т.е. В него опущена платиновая пластинка, покрытая платиновой чернью. Снизу в сосуд подается газообразный водород. Насыщенная им пластина ведет себя как водородный электрод. То есть имеет место равновесие: (губчатая пластина) – платиновый электрод, Р=1атм. Водород омывает платину, растворяется в ней. Насыщенная водородом платина начинает вести себя как водородный электрод, т.е.  Скачок потенциала на границе Скачок потенциала на границе  имеет определенную величину, которую принимают за 0.За условную величину, характеризующую потенциал электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и НВЭ.Стандартный потенциал металла – ЭДС гальванического элемента, состоящего из данного электрода, погруженного в раствор, где активность ионов металла равна 1, и из СВЭ. Уравнение Нернста (T=298К): имеет определенную величину, которую принимают за 0.За условную величину, характеризующую потенциал электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и НВЭ.Стандартный потенциал металла – ЭДС гальванического элемента, состоящего из данного электрода, погруженного в раствор, где активность ионов металла равна 1, и из СВЭ. Уравнение Нернста (T=298К):  Если расположить все металлы в ряд по алгебраической величине их стандартных потенциалов, получим ряд напряжений.Отрицательный потенциал принадлежит электродам, которые заряжаются отрицательно по отношению к НВЭ.Положительный – электрод заряжается положительно по отношению к НВЭ. Если расположить все металлы в ряд по алгебраической величине их стандартных потенциалов, получим ряд напряжений.Отрицательный потенциал принадлежит электродам, которые заряжаются отрицательно по отношению к НВЭ.Положительный – электрод заряжается положительно по отношению к НВЭ.
|
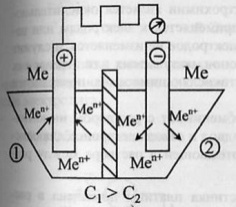 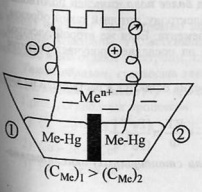 52.Типы электродов. Окислительно-восстановительный электроды.Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. Три типа: электроды первого, второго и третьего рода.Электроды 1-го рода.Металлы, погруженные в растворы своих солей.солей: 52.Типы электродов. Окислительно-восстановительный электроды.Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. Три типа: электроды первого, второго и третьего рода.Электроды 1-го рода.Металлы, погруженные в растворы своих солей.солей:  Электроды 2-го рода.Металл погружен в насыщенный раствор своей малорастворимой соли, к которой добавлена другая соль с тем же анионом,но хорошо растворимая.Пример. Электроды 2-го рода.Металл погружен в насыщенный раствор своей малорастворимой соли, к которой добавлена другая соль с тем же анионом,но хорошо растворимая.Пример.  Процессы на электроде: Процессы на электроде:  Электроды 3-го рода (газовые электроды).Известны водородный, кислородный и хлорный электроды. Потенциал газового электрода зависит как от активности ионов, так и от давления газа.Кроме электродов существуют цепи (концентрационные и альмагамные). Концентрационная цепь.В сосуд помещены 2 одинаковых электрода и залиты раствором, содержащим ионы металла.При замыкании цепи получают развитие процессы, приводящие к выравниванию концентрации всех растворов.ЭДС элемента: Электроды 3-го рода (газовые электроды).Известны водородный, кислородный и хлорный электроды. Потенциал газового электрода зависит как от активности ионов, так и от давления газа.Кроме электродов существуют цепи (концентрационные и альмагамные). Концентрационная цепь.В сосуд помещены 2 одинаковых электрода и залиты раствором, содержащим ионы металла.При замыкании цепи получают развитие процессы, приводящие к выравниванию концентрации всех растворов.ЭДС элемента:  Альмагамные цепи.Альмагама – сплав металла со ртутью, остающийся жидким при комнатной температуре.В сосуд залиты альмагамы с различной концентрацией металла и электролит, содержащий ионы металла.При работе элемента: окисление в первом отделе, восстновление – во втором.Процессы продолжаются до выравнивания концентраций электролитов и альмагам.В принципе любой электрод окислительно-восстановительный, но этот термин применяется только в том случае, если материал электродов не изменяется, а служит лишь источником или приемником электронов.Эти электроды, таким образом, обеспечивают отвод/подвод электронов.Имеются таблицы стандартных окислительно-восстановительных потенциалов. Альмагамные цепи.Альмагама – сплав металла со ртутью, остающийся жидким при комнатной температуре.В сосуд залиты альмагамы с различной концентрацией металла и электролит, содержащий ионы металла.При работе элемента: окисление в первом отделе, восстновление – во втором.Процессы продолжаются до выравнивания концентраций электролитов и альмагам.В принципе любой электрод окислительно-восстановительный, но этот термин применяется только в том случае, если материал электродов не изменяется, а служит лишь источником или приемником электронов.Эти электроды, таким образом, обеспечивают отвод/подвод электронов.Имеются таблицы стандартных окислительно-восстановительных потенциалов.
|
53.Электролиз. Последовательность разряда ионов на катоде и аноде. Электролиз - это окислительно-восстановительный процесс, протекающий при прохождении постоянного тока через раствор или расплав электролита.Сущность электролиза: на катоде(-) идет процесс восстановления, на аноде(+) – процесс окисления.Пример.  Различают первичные (электронный) и вторичные (химический) процессы.Последовательность разряда ионов в водных растворах.Вода частично ионизирована. Различают первичные (электронный) и вторичные (химический) процессы.Последовательность разряда ионов в водных растворах.Вода частично ионизирована.  На катоде в первую очередь восстанавливается тот катион, потенциал которого более положителен.Все металлы можно разделить на 3 группы.1-я группа – с наименьшей алгебраической величиной На катоде в первую очередь восстанавливается тот катион, потенциал которого более положителен.Все металлы можно разделить на 3 группы.1-я группа – с наименьшей алгебраической величиной  от Li до Al (включительно). При электролизе водных растворов, содержащих ионы металлов 1-й группы на катоде идет только процесс восстановление катионов Н+.2-я группа - со средней алгебраической величиной от Li до Al (включительно). При электролизе водных растворов, содержащих ионы металлов 1-й группы на катоде идет только процесс восстановление катионов Н+.2-я группа - со средней алгебраической величиной  от Mn до Fe (Fe3+). При электолизе водных растворов, содержащих ионы Ме 2ой группы на катоде идут 2 процесса: Men++nē®Me°, H++ē®H. от Mn до Fe (Fe3+). При электолизе водных растворов, содержащих ионы Ме 2ой группы на катоде идут 2 процесса: Men++nē®Me°, H++ē®H.  - выход по току, отношение практически полученного на катоде вещества к теоретически возможному, которое должно было бы выделиться по закону Фарадея.3-я группа – с наибольшей алгебраической величиной - выход по току, отношение практически полученного на катоде вещества к теоретически возможному, которое должно было бы выделиться по закону Фарадея.3-я группа – с наибольшей алгебраической величиной  все Ме, расположенные в ряду напряжений после водорода. На катоде – только восстановление катионов Ме, Меn++nē®Ме°. Порядок окисления анионов на аноде: на аноде в 1-ю очередь окисляется анион, все Ме, расположенные в ряду напряжений после водорода. На катоде – только восстановление катионов Ме, Меn++nē®Ме°. Порядок окисления анионов на аноде: на аноде в 1-ю очередь окисляется анион,  которого более отрицателен.В случае нерастворимого анода (графит, уголь, Pt, Au, Ir) в первую очередь окисляются анионы бескислородных кислот. Если этих ионов нет, то если среда щелочная, окисляются анионы гидроксила. Если среда кислая или нейтральная, то имеет место прямое окисление воды.В случае растворимого анода, имеет место процесс: которого более отрицателен.В случае нерастворимого анода (графит, уголь, Pt, Au, Ir) в первую очередь окисляются анионы бескислородных кислот. Если этих ионов нет, то если среда щелочная, окисляются анионы гидроксила. Если среда кислая или нейтральная, то имеет место прямое окисление воды.В случае растворимого анода, имеет место процесс: 
|
54.Законы Фарадея. Выход по току.Первый закон: при электролизе данного электролита количества веществ, выделяющихся на электродах, прямо пропорционально количеству электричества, прошедшему через электролит. q – электрохимический эквивалент.Второй закон: при электролизе различных электролитов одинаковые количества электричества выделяют на электродах такие количества веществ, которые прямо пропорциональны их химическим эквивалентам.Пример. При прохождении 1 фарадея (96500 Кл) электричества на электродах выделяется 1 г-экв вещества.В формулу первого закона следует ввести поправочный сомножитель – выход по току.Закон Фарадея: q – электрохимический эквивалент.Второй закон: при электролизе различных электролитов одинаковые количества электричества выделяют на электродах такие количества веществ, которые прямо пропорциональны их химическим эквивалентам.Пример. При прохождении 1 фарадея (96500 Кл) электричества на электродах выделяется 1 г-экв вещества.В формулу первого закона следует ввести поправочный сомножитель – выход по току.Закон Фарадея:  Электрический эквивалент q – количество вещества в мг, выделяющееся на электродах при прохождении 1 Кл электричества.Вторая формулировка. Электрический эквивалент q – количество вещества в г, выделяющееся на электродах при прохождении 1 А*ч электричества.q=Э/Ф, Э – г-экв.Удельный расход энергии при электролизе: W=U*I*t/m=U/(q*η), [Вт*ч/г]. Электрический эквивалент q – количество вещества в мг, выделяющееся на электродах при прохождении 1 Кл электричества.Вторая формулировка. Электрический эквивалент q – количество вещества в г, выделяющееся на электродах при прохождении 1 А*ч электричества.q=Э/Ф, Э – г-экв.Удельный расход энергии при электролизе: W=U*I*t/m=U/(q*η), [Вт*ч/г].
| | |
|
|
 Скачать 0.77 Mb.
Скачать 0.77 Mb. 49.Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.Рассмотрим систему, в которой медь и цинк в виде пластинок помещены в растворы своих солей, разделенных перегородкой – диафрагмой. При разомкнутой цепи электроды приобретают равновесные потенциалы, которые отличаются по знаку и по величине. При ее замыкании электроны от цинкового электрода перемещаются к медному. На электродах нарушается равновесие:
49.Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.Гальванический элемент – любое устройство, дающее возможность получать электрический ток за счет проведения той или иной химической реакции.Рассмотрим систему, в которой медь и цинк в виде пластинок помещены в растворы своих солей, разделенных перегородкой – диафрагмой. При разомкнутой цепи электроды приобретают равновесные потенциалы, которые отличаются по знаку и по величине. При ее замыкании электроны от цинкового электрода перемещаются к медному. На электродах нарушается равновесие: 
 52.Типы электродов. Окислительно-восстановительный электроды.Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. Три типа: электроды первого, второго и третьего рода.Электроды 1-го рода.Металлы, погруженные в растворы своих солей.солей:
52.Типы электродов. Окислительно-восстановительный электроды.Электрод – проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока. Три типа: электроды первого, второго и третьего рода.Электроды 1-го рода.Металлы, погруженные в растворы своих солей.солей: 