1. Основные газовые законы. Определение молекулярных масс газообразных веществ.
К осн. газовому з. относится уравнение состояния газа (уравнение Менделеева-Клапейрона): 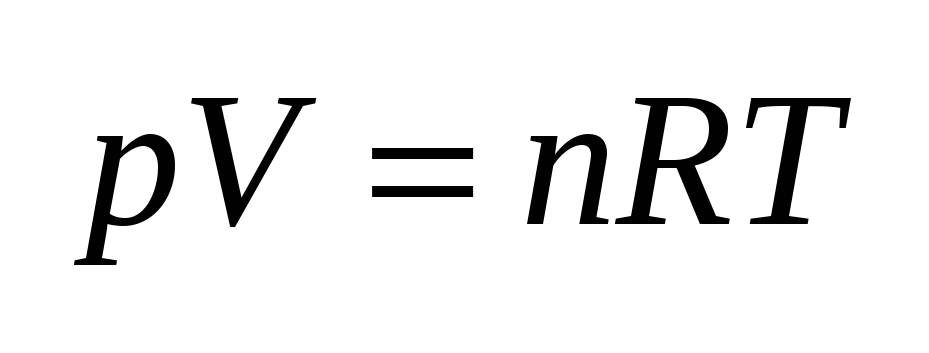
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных V-ах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Следствие1: одинаковое число молекул различных газов при одинаковых усл-х занимают одинаковый объем
В одном моле содержится  При норм.усл. моль газа занимает 22,4 л.Универсальный газовый з. При норм.усл. моль газа занимает 22,4 л.Универсальный газовый з.
Для опр.отн.молекулярной массы в-ва обычно находят численно =ую ей мольную массу в-ва.
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Масса газообразных веществ опр.по з.Авогадро и уравнению Менделеева-Клапейрона.
|
2. Основные стехиометрические законы.
1. З.постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. З.эквивалентов: в-ва вступают в хим. взаимодействие и замещают друг друга в соед.в весовых количествах пропорциональным хим. эквивалентам этих веществ.Хим.эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. З. простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа.Пример: H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. З. сохранения массы и энергии: в изолированной сист. сумма m-c и E-й постоянна.
5. З. Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится 
|
3.З.хим.экв-ов. Молярные экв-ные массы сложных в-в.
3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Пример. 
Эквивалентная масса элемента - это масса 1 эквивалента элемента.
Эквивалентная масса вещества - это масса 1 эквивалента вещества.
Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Пример. 
Закон химических эквивалентов. Массы реаг.вещ-в пропорциональны их экв.массам.
|
4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали.
Атомные частицы обладают одновременно и корпускулярными, и волновыми св-ми.
Луи де Бройль p=mv длина волны h/mv h-постоянная Планка 6.6 *1034 Дж*с.
Волновые св-ва: дифракция и интерференция.
Корпускулярные св-ва: электрон действует как частица, как единое целое. Движ.–пульсирующее. Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s.Гл.кв.ч.характеризует общий уровень эн.эл-на. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q).Эл-е уровни подразделяются на подуровни. Эл-ны одного и того же подуровня различны по величине момента кол-ва дв-я mvr ( r – радиус орбиты).Число подуровней=числу уровн(макс.ч.подуровней–4).Побочное (орбитальное)кв.число хар-ет энергетич.сост. электрона на подуровне (l=n-1).Магн.к.ч.опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3).Спиновое к.ч. характеризует напр.вр-я электрона. (+1/2 и -1/2). Наиб.ч. эл-ов на подуровне вычисл.по формуле 2n2.макс.число – 32. Распр.эл-ов по уровням и подуровням изобр. с помощью электронных формул или ячеек. Пример: Mg-1s22s22p63s2.
|
5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч.
У двух электронов могут быть попарно одинаковыми 3 числа, но они обязаны различаться по четвертому.
Наибольшее число электронов Z в оболочке с главным квантовым числом. 
Максимальное число электронов на одном уровне известных ныне электронов – 32.
Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P.
То есть максимально возможное число электронов на внешнем уровне отвечает конфигурации  (8 электронов). (8 электронов).
На s-2, на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов.
|
6. Связь периодич-го з. со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. ячейки. Правило Хунда.
Д. Менделеев открыл закон в 1869 году, сформулировав его: «Св-ва простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов эл-ов.»В 1869 было известно всего 63 эл-та, в наст.вр.– 109.
Периодич.сист.– по сути изобр.периодич.закона.
Период – послед-ть атомов с одинаковым числом эл.слоев.Электроны заполняют при застройке оболочек наиболее выгодные в эн-м отношении подуровни.
1-ое правилу Клечковского, последовательное заполнение электрон.орбиталей происходит от орбиталей с меньшим знач.суммы n+1 к большим знач.этой суммы.
2-ое правило Клечковского: при одинаковом знач.суммы заполнение происх.в напр.увелич. «n».Порядок заполнения атомных орбиталей:
1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-5d1-4f14-5d2-10-6p6-7s2-6d1-5f14-6d2-10-7p6.
Периодич.сист.полностью отражает прядок заполнения эл-ми эн.уровней атомов любых эл-ов.Правило Гунда: суммарный спин данного подуровня должен быть макс., т.е. электроны стремятся занять макс.число св.кв.сост..
|
7.Периодич.з.Д.И.Менделеева и периодич.сист. эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та.
в 1869 сформулировав его: «Св-ва простых тел, а также формы и св-ва соед.эл-ов находятся в периодич.зависимости от величины атомных весов эл-ов.» В 1869 было известно всего 63 элемента, в настоящее время – 109.
Периодич.сист.– по сути изобр.периодич.з..
В наст.вр.предложено несколько вариантов сист.,но мы рассмотрим более традиционную, предложенную Менделеевым.Она имеет 3 малых периода (1-3) и 4 больших (4-7).
Период – последовательность атомов с одинаковым числом эл-ных слоев.Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активн.ме,по мере продвиж. ус-ся неметалл.св-ва, а завершаются галогеном и инертным газом.Эл-ты, которые осущ. переход от ме к неме,наз-ся переходными. Эл-ты группы проявляют одинаковую макс.валентность по кислороду, равную номеру группы.Элементы гл.подгрупп проявляют опр.валентность по водороду. В главных подгруппах по мере движ.вниз металл.св-ва усиливаются, побочных – ослабевают.
|
8.Периодич.изм.св-в хим.эл-ов. Радиус атомов, ср-во к эл-ну, эн. ионизации, электроотриц-ть. Период – последовательность атомов с одинаковым числом эл-ных слоев.
Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активного ме, по мере продвижения усиливаются неме св-ва,а завершаются галогеном и инертным газом. Эл-ты, которые осущ.переход от ме к неме,наз-ся переходными.Радиус атома - расстояние м/у атомным ядром и самой дальней из стабильных орбит электронов в эл.оболочке этого атома. Увелич.с увелич.порядкового номера элемента. Эн.ионизации – эн.которую необх. затратить на отрыв электрона с нормального уровня и удаление его на далекий уровень. Атом при этом превращ.в положит.ион.можно счит.мерой металличности: чем меньше энергия, тем ярче проявляются металлические свойства, и наоборот.Эн.сродства к электрону – эн., которая выделяется при присоед.лектрона к нейтральному атому.Она очень мала и становится заметной с элементов 5-й группы.Электроотр.–эн.ионизации +энергии сродства. Чем она больше, тем вероятнее превращение атомов в отрицат.ионы. 
|
9.Образование химической связи. Энергия и длина связи.
При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв.
При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
Потенциальная эн. образующейся молекулы меньше суммарной потенциальной эн.исходных свободных атомов.Для характеристики химической связи используются следующие термины:Длина связи - межъядерное расстояние в невозбуждённой молекуле (обычно 1-2 Ангстрема, 1А=  см).Эн.связи – энергия, выделяющаяся при образовании данного вида связи (150-1000 кДж/моль). см).Эн.связи – энергия, выделяющаяся при образовании данного вида связи (150-1000 кДж/моль).
|
10.Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
К.с. возникает м/у элементами с одинаковым или близким знач-ми эн.сродства к электрону. Валентность атомов в соединениях с к.св.опр.по числу электронных пар(1пара–1ед.валентности).Для оценки отн.зарядности элемента в ков.соед-х (на самом деле никаких зарядов в этих соед-х нет) прибегают к приему: мысленно связь разорвать ,при разрыве связи в пределах периода электрон смещается от левее стоящего элемента к правее стоящего, а в пределах гл.подгр.от ниже стоящему к выше.2 метода объяснения механизма возн-ния ков.св.: метод валентных связей (МВС) и метод молекулярных орбиталей (МО).В основе МВС лежит 3 положения: 1. Химическая связь образуется двумя электронами с противоположно направленными спинами. При этом имеет место взаимное перекрытие электронных орбиталей. М/у атомами возникает зона повышенной электронной плотности, к которой притягиваются ядра с остальными электронами. 
2. Связь имеет ориентацию в направлении, обеспечивающем макс.возможное перекрывание орбиталей.3.Чем больше взаимное перекрывание эл-ных орбиталей, тем прочнее связь.Валентными являются неспаренные электроны. Их число можно изобр.c помощью эл-ной конфигурации атомов.При возб-и атомов (за счет притока эн.извне) имеет место «распаривание» электронов и переход электрона на более удалённый подуровень в пределах одного уровня. Распаривание одной электронной пары может увеличить валентность на 2 единицы.
|
11. Направленность ков.св.. Сигма и пи-связи. Гибридизация атомных орбиталей.К.с. возникает м/у элементами с одинаковым или близким знач-м эн.сродства к эл-ну.Перекрывание облаков при обр-нии к.с. возможно только при опред.их взаимной ориентации в пространстве – отсюда направл-ть связей, приводящая к опред. форме молекул. При этом обл. перекрывания расп-ся опр-м обр-м по отн-ю к взаимодейств-м атомам. 1.Молекулы типа AA, BB, АВ.Характерен для водорода, галогенов и соед. «галоген+водород». Молекулы имеют линейчатую структуру. Хим.св. действ.по кратчайш.расстоянию(сигма-связь).2.Молекулы типа A2B.Характерен для соед., образ-х элем-ми главной подгруппы 6-ой группы: Н2О, Н2S,H2O-валентный угол 1050H2S-валентный угол92033’ 3. Молекулы типаA3B. Характерен для соед., образ-х элем-ми гл.подгр.5-й группы (N, P, As, Sb, Bi).Мол-ла аммиака (NH3) имеет форму пирамиду с треуг-м основании.4.Молекулы типа A4B. Гл.подгр.4-й гр.(Si,C,Ge,Sn, Pb)Молекула метана имеет форму тетраэдра (по вершинам – атомы водорода, атом углерода –в центре).5. Молекулы типа AB3.Гл.подгруппа 3-ей гр.(B,Al,Ga,In, Tl). Мол-лаBCl3имеет вид равностор.треуг-ка.6.Мол-лы типа AB2.Хар-рен для некоторых соед., образ-ми элем-ми гл.подгруппы 2гр.. ВеCl2(линейн.структура, угол–180).Если в мол-ле имеется кратная связь м/у атомами (2-ная или 3-ная),то только одна связь яв-ся прочной-пи-связь.Остальные–сигма-связи. Пример.Рассм. мол-лу этилена (С2Н4). неполная гибридизация   М/у атомами углерода одна из связей «пи». Все остальне– «сигма». М/у атомами углерода одна из связей «пи». Все остальне– «сигма».
|
12.Ионная (электронная связь).
В случае возникновения ионной связи между атомами или группами атомов преобладает электростатическое взаимодействие. Она возникает между атомами элементов, значительно отличающихся по величине электроотрицательности.
Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
|
13.Представление о методе молекулярных орбиталей.Основаны на том, что для каждого из электронных состояний молекулы как многоэлектронной системы полная волновая ф-ция составляется из произведений волновых ф-ций электронов (мол. орбита-лей) в соответствии с электронной конфигурацией системы, т. е. с учетом чисел заполнения (1 или 2). Числа заполнения при этом показывают, сколько электронов-один или два-занимают данную орбиталь, так что данная орбиталь входит в произведение один или два раза. Поскольку, согласно Паули принципу. полная волновая ф-ция системы электронов должна быть антисимметрична относительно перестановок индексов (номеров) электронов, ее представляют в виде определителя (или линейной комбинации неск. определителей), построенного из мол. спин-орбиталей и называемого о п р е д е л и т е л е м С л е й т е р а (Слэтера).
|
14.Полярность связи. Полярность молекул и дипольный момент.Предположим, что мы имеем соединение АB. Оба элемента с большими знач-миэлектроотрицательности ( ).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральность нарушается,в мол-ле появл-ся полож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.–полярная.Осн.харак-ка диполя–дипольный момент. ).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральность нарушается,в мол-ле появл-ся полож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.–полярная.Осн.харак-ка диполя–дипольный момент.   -напряж.поля,созд.диполем. -напряж.поля,созд.диполем.
l–плечо диполя.Примеры полярных молекул-диполей:  и др.Чем больше плечо, тем полярнее молекула. и др.Чем больше плечо, тем полярнее молекула. можно представить как произведение некоторой величины D (единицы Дебая) на можно представить как произведение некоторой величины D (единицы Дебая) на  Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц.Полярность св.– вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов. Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц.Полярность св.– вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов.
|
15.Донорно-акцепторный механизм ков.св.. Комплексные соединения.Донорно-акцепторная связь (ДАС) – разновидность ковалентной связи. Выделяют соед.1-го порядка(или валентно-насыщенные соед.) Пример: H2O, AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя друг с другом дают соед.высшего порядка (или компл.соед.). 
 В компл.соед-х проявляются ДАС. Рассмотрим пример: В компл.соед-х проявляются ДАС. Рассмотрим пример: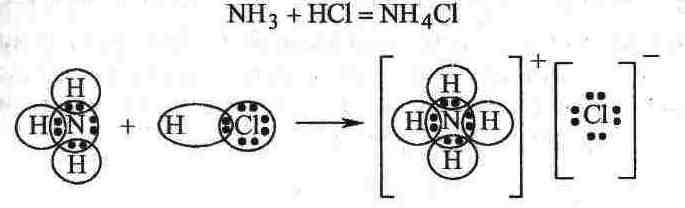
Азот в NH3 – донор, водород в HCl–акцептор. Компл.соед.–соед.высшего порядка, возн-е из соед-й1-го порядка без образования новых электронных пар, а за счет проявления хотя бы одной ДАС. Предложено 2 теории возникн-я компл.соед-й.1-я–Полин–теория вал-х св-й. Комлексообразователь,координирующий лиганды вокруг себя, имеет вакантные орбитали.Т.е.образ-е компл.соед-1–результат проявления ДАС,Вторая–Бете теория кристаллического поля.Связь в комплексах–электростатич-я,т.е. взаимод. типа «ион-ион»или«ион-диполь». Конст.равновесия (нестойкости) К Конст.равновесия (нестойкости) К Чем<значение Кн,тем прочнее компл-й ион. Чем<значение Кн,тем прочнее компл-й ион.
| |
 Скачать 0.77 Mb.
Скачать 0.77 Mb.