|
|
Закон Авогадро. В равных vах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул
67.Поверхностные явления. Понятие поверхностного натяжения.Поверхностное натяжение – избыток свободной энергии в поверхностном слое, отнесенный к  поверхности поглощающего тела. поверхности поглощающего тела.  Поверхностное растяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Поверхностное натяжение как функция концентрации растворенного вещества при Т-const - изотерма поверхностного натяжения. Поверхностное растяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Поверхностное натяжение как функция концентрации растворенного вещества при Т-const - изотерма поверхностного натяжения.  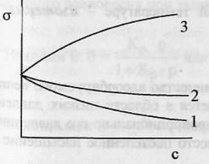 1 и 2 – поверхностно-активные вещества (ПАВ).3 – поверхностно-инактивные вещества (ПИАВ).Разность с в поверхностном слое – поверхностный избыток вещества Г (гамма).Для ПАВ Г>0, для ПИАВ Г<0.Поверхность твердых тел, как и жидкостей, обладает избыточной свободной энергией Гиббса. Твердые тела не могут (в отличие от жидкостей) самопроизвольно изменять площадь поверхности. 1 и 2 – поверхностно-активные вещества (ПАВ).3 – поверхностно-инактивные вещества (ПИАВ).Разность с в поверхностном слое – поверхностный избыток вещества Г (гамма).Для ПАВ Г>0, для ПИАВ Г<0.Поверхность твердых тел, как и жидкостей, обладает избыточной свободной энергией Гиббса. Твердые тела не могут (в отличие от жидкостей) самопроизвольно изменять площадь поверхности.
68.Адсорбция и абсорбция.
Адсорбция-процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном- это повышение концентрации одного вещества у поверхности раздела двух фаз, из которых одна обычно является твердым телом.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция.
Абсорбция- поглощения сорбата всем объёмом сорбента. Абсорбция — частный случай сорбции.
Абсорбция, как правило, означает поглощение газов в объёме жидкости или реже твёрдого тела. Поглощение твёрдым абсорбентом, например, водорода палладием, называют окклюзией. Для процесса поглощения молекул газа или жидкости поверхностью твёрдого тела в русском языке используется термин адсорбция.
На практике абсорбции подвергают не отдельные газы, а газовые смеси, составные части которых поглощаются жидкостью. Эти составные части смеси называют абсорбируемыми компонентами (абсорбат), а непоглощаемые части — инертным газом.
|
69.Поверхностное натяжение растворов. Изотерма адсорбции.Поверхностное натяжение – избыток свободной энергии в поверхностном слое, отнесенный к  поверхности поглощающего тела. поверхности поглощающего тела.  Поверхностное растяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Поверхностное натяжение как функция концентрации растворенного вещества при Т-const - изотерма поверхностного натяжения. Поверхностное растяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Поверхностное натяжение как функция концентрации растворенного вещества при Т-const - изотерма поверхностного натяжения.   1 и 2 – поверхностно-активные вещества (ПАВ).3 – поверхностно-инактивные вещества (ПИАВ).Разность с в поверхностном слое – поверхностный избыток вещества Г (гамма).Для ПАВ Г>0, для ПИАВ Г<0.Поверхность твердых тел, как и жидкостей, обладает избыточной свободной энергией Гиббса. Твердые тела не могут (в отличие от жидкостей) самопроизвольно изменять площадь поверхности.Величина адсорбции зависит от природы адсорбента и адсорбата, от давления газа, температуры.Зависимость адсорбируемого количества газа от давления адсорбата при постоянной температуре – изотерма адсорбции. 1 и 2 – поверхностно-активные вещества (ПАВ).3 – поверхностно-инактивные вещества (ПИАВ).Разность с в поверхностном слое – поверхностный избыток вещества Г (гамма).Для ПАВ Г>0, для ПИАВ Г<0.Поверхность твердых тел, как и жидкостей, обладает избыточной свободной энергией Гиббса. Твердые тела не могут (в отличие от жидкостей) самопроизвольно изменять площадь поверхности.Величина адсорбции зависит от природы адсорбента и адсорбата, от давления газа, температуры.Зависимость адсорбируемого количества газа от давления адсорбата при постоянной температуре – изотерма адсорбции.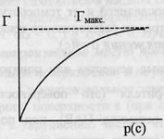 С ростом давления увеличивается количество адсорбируемого вещества.Лэнгмюр при выводе уравнения изотермы сделал следующие допущения: 1. все места адсорбента одинаковы. 2. взаимодействие между частицами пренебрежимо мало. 3. адсорбционный слой состоит из одного слоя молекул, адсорбция локализованная – нет перемещения адсорбционного комплекса вдоль поверхности адсорбента.Степень заполнения адсорбента адсорбатом: С ростом давления увеличивается количество адсорбируемого вещества.Лэнгмюр при выводе уравнения изотермы сделал следующие допущения: 1. все места адсорбента одинаковы. 2. взаимодействие между частицами пренебрежимо мало. 3. адсорбционный слой состоит из одного слоя молекул, адсорбция локализованная – нет перемещения адсорбционного комплекса вдоль поверхности адсорбента.Степень заполнения адсорбента адсорбатом:  Скорость адсорбции: Скорость адсорбции:   константа скорости адсорбции.Скорость десорбции: константа скорости адсорбции.Скорость десорбции:   константа скорости десорбции.Адсорбционное равновесие наступает при константа скорости десорбции.Адсорбционное равновесие наступает при  Уравнение изотермы хорошо передает зависимости в области низких и области высоких давлений, но не всегда оправдывается в промежуточной области.Процесс адсорбции экзотермичен: поглощение вещества протекает с выделением теплоты, десорбция – с поглощением теплоты.Если адсорбируются несколько газов: Уравнение изотермы хорошо передает зависимости в области низких и области высоких давлений, но не всегда оправдывается в промежуточной области.Процесс адсорбции экзотермичен: поглощение вещества протекает с выделением теплоты, десорбция – с поглощением теплоты.Если адсорбируются несколько газов:  Для адсорбции на неоднородной поверхностибыло предложено эмпирическое уравнение Фрейндлиха. Для адсорбции на неоднородной поверхностибыло предложено эмпирическое уравнение Фрейндлиха.   к и n – коэффициенты, постоянные для данного адсорбента и газа при данной температуре.Уравнение Фрейндлиха, наоборот, не отражает особенностей изотермы в области высоких и низких давлений, но для области промежуточных давлений согласуются с опытными данными. к и n – коэффициенты, постоянные для данного адсорбента и газа при данной температуре.Уравнение Фрейндлиха, наоборот, не отражает особенностей изотермы в области высоких и низких давлений, но для области промежуточных давлений согласуются с опытными данными.
|
1.Основные газовые законы. Определение молекулярных масс газообразных веществ.
2.Основные стехиометрические законы.
3.Законы химических эквивалентов. Молярные эквивалентные массы сложных веществ.
4.Волновые свойства электрона. Квантовые числа, s-, p-, d-, f- состояния электронов. Электронные орбитали.
5.Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
6.Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Хунда.
7.Периодический закон Д.И.Менделеева и периодическая система элементов: ряды, периоды, группы, подгруппы, порядковый номер элемента.
8.Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
9.Образование химической связи. Энергия и длина связи.
10.Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
11.Направленность ковалентной связи, о- и л-связи. Гибридизация атомных орбиталей.
12.Ионная (электронная связь).
13.Представление о методе молекулярных орбиталей.
14.Полярность связи. Полярность молекул и дипольный момент.
15.Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
16.Межмолекулярное взаимодействие. Водородная связь.
17.Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
18.Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
19.Стандартная энтальпия образования. Следствия из закона Гесса.
20.Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа).
21.Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
|
22.Объединенная формула первого и второго начала термодинамики.Свободная энергия Гиббса и Гельмгольца.23.Зависимость F и G от температуры (уравнения Гиббса-Гельмгольца).24.Условия самопроизвольного протекания химических реакций.
25.Изотерма химической реакции. Стандартное изменение свободной энергии.
26.Константа химического равновесия. Расчет Кр, Кс, Км-
27.Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
28.Принцип Ле-Шателье.
29.Скорость химической реакции. Закон действующих масс. Константа скорости.
30.Молекулярность и порядок реакции.
31.Кинетическая классификация по степени сложности. Обратимые и необратимые реакции.
32.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
33.Энергия активации химической реакции. Аналитический и графический метод расчета.
34.Скорость гетерогенной химической реакции. Особенности ее протекания.
35.Инициирование химической реакции. Катализ. Сущность гомогенного и гетерогенного катализа.
36.Дисперсные системы. Коллоидные растворы.
37.Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные). Растворимость. Способы выражения концентрации растворов.
38.Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
39.Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
40.Законы Рауля.
41.Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
42.Константа диссоциации. Закон разведения Оствальда.
43.Сильные электролиты. Понятие активности и коэффициента активности.
44.Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
|
45.Гидролиз солей. Константа и степень гидролиза.46.Произведение растворимости.
46.Произведение растворимости.
47.Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
48.Возникновения скачка потенциала на границе раздела «металл-расствор». Равновесный электродный потенциал.
49.Медно-цинковый гальванический элемент Якоби-Даниэля. Процессы на электродах. Понятие ЭДС.
50.Зависимость ЭДС гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная ЭДС.
51.Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжений.
52.Типы электродов. Окислительно-восстановительный электроды.
53.Электролиз. Последовательность разряда ионов на катоде и аноде.
54.Законы Фарадея. Выход по току.
55.Химическая и концентрационная поляризация при электролизе. Понятие перенапряжения.
56.Классификация химических источников тока.
57.Коррозия металлов. Химическая и электрохимическая коррозия.
58.Основные методы борьбы с коррозией.
59.Кристаллическое состояние вещества. Химическая связь в кристаллах.
60.Составные части системы и компоненты. Правило фаз.
61.Сущность термографического анализа. Кривые нагревания и охлаждения.
62.Диаграмма плавкости однокомпонентной системы на примере воды.
63.Основные принципы построения диаграммы плавкости бинарных систем.
64.Эвтектическая диаграмма плавкости (без образования твердых растворов).
65.Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
66.Диаграмма плавкости бинарной системы с образованием химических соединений.
67.Поверхностные явления. Понятие поверхностного натяжения.
68.Адсорбция и абсорбция.
69.Поверхностное натяжение растворов. Изотерма адсорбции.
|
|
|
|
 Скачать 0.77 Mb.
Скачать 0.77 Mb.