ик. Закон Бугера ламберта бера спектроскопические методы анализа
 Скачать 353.5 Kb. Скачать 353.5 Kb.
|
|
Анализ многокомпонентных смесей. Если полосы поглощения двух или более веществ, находящихся в одном растворе, не перекрываются, то анализ смеси сводится к определению каждого компонента в отдельности. Оптическая плотность смеси веществ Аλ определяется законом аддитивности оптических плотностей: Аλ = ΣАλ i = l Σ ελ ici, (1.6) где Аλ i – парциальная оптическая плотность i-го вещества. В случае перекрывания полос (рис.1.1) для анализа смеси используют методы, также основанные на законе аддитивности оптических плотностей. Из них наиболее известен метод Фирордта, заключающийся в измерении оптической плотности смеси при нескольких длинах волн и составлении системы уравнений, включающих неизвестные концентрации компонентов смеси. Пусть для смеси двух компонентов с концентрациями с1 и с2 измерены оптические плотности А1 и А2 при длинах волн λ1 и λ2, соответственно (рис.1.1). Тогда А1 = ε1,λ1 c1 l+ ε2,λ1 c2 l (1.7) А2 = ε1,λ2 c1 l+ ε2,λ2 c2 l (1.8) система уравнений с двумя неизвестными решается обычными приемами: с1 = ε2,λ2 А1 - ε2,λ1 А2/( ε1,λ1 ε2,λ2 - ε1,λ2 ε2,λ1) l (1.9) с2 = ε1,λ1 А2 – ε1,λ2 А1/( ε1,λ1 ε2,λ2 - ε1,λ2 ε2,λ1) l (1.10) Ответственным моментом при использовании метода Фирордта является выбор длин волн λ1 и λ2, называемых аналитическими. В качестве их можно использовать длины волн с максимальными значениями разностей коэффициентов поглощения веществ. Найденные значения λ1 и λ2 могут не совпадать с максимумами поглощения компонентов смеси, лежать в неудобных для измерений областях спектра (крутовосходящие, крутоспадающие участки спектральных кривых) или наблюдаться в таких областях спектра, где значения ε1,λ или ε2,λ малы и измеряются с малой точностью. Поэтому при окончательном выборе аналитических длин волн следует учитывать факторы, обеспечивающие повышение чувствительности и точности анализа двухкомпонентных смесей. Чтобы относительная погрешность определения концентраций компонентов Δс/с была наименьшей, значения А1 и А2 должны лежать в интервале 0.1-1.0. Метод Фирордта может быть распространен и на многокомпонентные смеси. Нередко в аналитической практике возникает необходимость определения одного вещества в сложной смеси, не прибегая к его выделению. Все остальные компоненты системы называют примесями, составляющими фон. В этом случае можно провести спектрофотометрический анализ без отделения примесей, используя различные методы. 1. Когда содержание определяемого вещества в смеси велико, а поглощением посторонних компонентов можно пренебречь, то содержание определяемого вещества можно рассчитать по уравнению основного закона светопоглощения: C = A λ/ ελ l, (1.11) 2. Если вблизи максимума поглощения определяемого вещества поглощение посторонних компонентов смеси аппроксимируется линейной зависимостью от длины волны А = ао +а1λ, концентрацию определяемого вещества можно рассчитать, используя метод базовой линии. Для этого на кривой светопоглощения анализируемого раствора между двумя минимумами по обеим сторонам от полосы поглощения определяемого вещества проводят прямую линию (рис.1.2) и считают, что отрезок ВD в выбранном масштабе равен оптической плотности определяемого вещества, а отрезок DE – оптической плотности посторонних компонентов смеси. Концентрацию определяемого вещества рассчитывают по формуле: с= BD / εl (1.12) 3. При линейном характере поглощения посторонних компонентов от длины волны концентрацию определяемого вещества в сложной смеси можно определить методом Брайса - Швайна. Для этого измеряют оптическую плотность анализируемого раствора при трех равноотстоящих длинах волн в области максимума поглощения определяемого вещества (рис.1.2). Концентрацию определяемого вещества рассчитывают по формуле: с = 2 А λ2 - А λ1 - А λ3 /( 2ελ2 - ελ1 – ε31)l (1.13) 11. Взаимодействие вещества с ИК-излучением. Схема и основные узлы ИК-спектрофотометра. 12. Качественный и количественный анализ в методе ИК-спектроскопии. Среди многообразных физических методов, которые применяются при исследовании химических соединений, количественного и качественного анализа в химии, большой интерес представляет взаимодействие вещества с электромагнитным излучением. Электромагнитное излучение при взаимодействии с веществом может вызывать в нем процессы разнообразной физической природы. Общий характер этих процессов зависит от энергии фотонов. Весь диапазон энергий электромагнитного излучения можно разделить на области, соответствующие тому или иному физическому процессу. энергию фотонов, характер соответствующих физических процессов и объектов анализа. Колебательные спектры молекул экспериментально изучаются методами инфракрасной (ИК) спектроскопии и спектроскопии комбинационного рассеяния (КР) света. Эти спектры связаны с переходами между колебательными энергетическими состояниями, т.е. колебаниями атомных ядер относительно равновесных положений. Любая молекула имеет свой, только ей присущий колебательный спектр, состоящий из набора полос разной частоты и интенсивности. Поэтому колебательный спектр вещества является его индивидуальной характеристикой (часто ИК - спектры называют даже «отпечатком пальцев» молекулы) и может использоваться для идентификации вещества. Колебательная спектроскопия занимает важное место в исследовании молекулярной структуры химических соединений. Этот метод позволяет установить характер атомных группировок, их содержание, получить данные о содержании функциональных групп, особенно тех, которые не могут быть охарактеризованы химическими методами, установить природу химической связи, изучать кинетику химических реакций, выяснить природу водородных связей и др. Достоинством методов колебательной спектроскопии является то, что они допускают исследование практически любого неорганического или органического вещества в любом агрегатном состоянии – газе, жидкости, растворах, кристаллах или аморфной фазе. По нижнему пределу количественного определения методы ИК и КР спектроскопии в обычном аппаратурном оформлении уступают некоторым другим физическим методам, но использование новейших Фурье – спектрометров позволяет повысить концентрационную чувствительность во много раз. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ИК – СПЕКТРОСКОПИИ 1. Основные понятия Совокупность всевозможных энергетических переходов в молекуле, сопровождаемых поглощением (излучением) электромагнитного излучения образует спектр. Электромагнитное излучение может быть охарактеризовано либо волновыми, либо энергетическими параметрами. Волновой параметр выражается длиной волны или частотой колебания, которые связаны между собой уравнением: (с-1) = где с - скорость света, - длина волны. 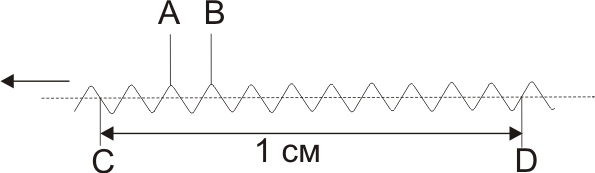 Рис. 1. Длина волны соответствует расстоянию АВ; волновое число – число волн, приходящееся на 1 см, CD; частота – число волн, проходящих через фиксированную точку С в единицу времени Часто употребляют волновое число (называемое также частотой), измеряемое в обратных сантиметрах (см-1): (см-1) = Наглядно связь использующихся в ИК-спектроскопии величин представлена на рис. 1. При описании полос поглощения пользуются различными единицами. Волновое число , используемое чаще всего, имеет размерность см-1 и определяется уравнением (2); также выражается в разных единицах. Они связаны между собой следующим образом: 1см = 108 Å (ангстремы) = 107 нм (нанометры) = 104 мкм (микрометры) = 107 ммкм (миллимикрометры) Инфракрасная область спектра подразделяется на несколько диапазонов согласно применяемым оптическим материалам, которые должны быть прозрачны в данной области спектра: область 1) 0,8-2 мкм - ближняя инфракрасная область, материал оптики кварц и стекло 2) область 2-40 мкм - средняя (фундаментальная) инфракрасная область, используется солевая оптика (LiF, NaCl, KBr,CsI), область имеет чрезвычайно большое значение при исследовании органических соединений (в современных приборах солевая оптика заменена дифракционными решетками); 3) область до 200 мкм - далекая инфракрасная область, область имеет значение при исследовании неорганических соединений. Исследуется при помощи дифракционных решеток. При исследовании химических соединений обычно используют поглощение инфракрасного излучения в области 2-50 мкм (5000-200 см-1). 2. Поглощение ИК-излучения веществом В двухатомной молекуле АВ атомы А и В удерживаются в определенном положении весьма прочно, однако не совсем жестко. В молекуле могут происходить следующие типы движений 1) поступательное движение молекулы как целого, которое может рассматриваться как движение центра масс; 2) вращение молекулы вокруг центра масс; 3) колебание отдельных атомов, происходящие таким образом, что положение центра масс не изменяется и молекула не вращается; 4) движение электронов в молекуле; 5) вращение электронов и ядер атомов вокруг своих осей (спины электронов и ядер). 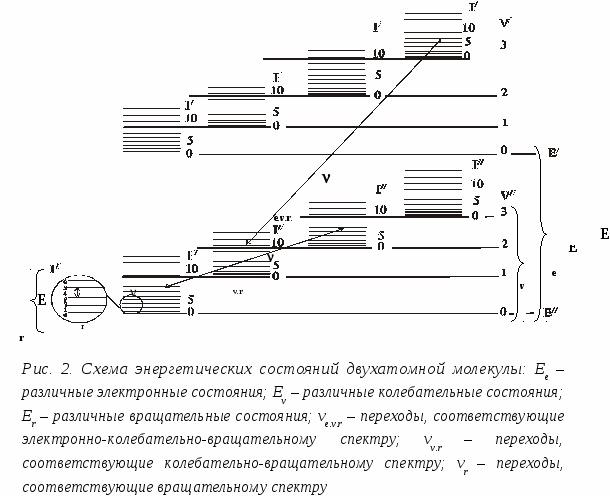 Таким образом, полная энергия молекулы является суммой поступательной, вращательной, колебательной и электронной энергий: Поступательная энергия мало влияет на молекулярные спектры. Относительные энергии трех различных молекулярных состояний для двухатомной молекулы представлены на рис. 2. Разница между вращательными уровнями составляет сотые доли эВ, между колебательными уровнями - десятые доли эВ и между электронными уровнями - единицы эВ. Молекула, состоящая из nатомов, имеет 3nстепеней свободы, три из которых относятся к поступательному, три к вращательному (две – в случае линейных молекул), а остальные 3n– 6 (или 3n– 5 в линейных молекулах) – к колебательному движению. Колебательные движения в молекуле называются нормальными (собственными или фундаментальными) колебаниями или нормальными модами. Эти колебания совершаются при отсутствии внешнего воздействия за счёт первоначально накопленной энергии (вследствие наличия начального смещения или начальной скорости). Они представляют собой независимые повторяющиеся смещения атомов, при которых положение центра масс не меняется, причем все атомы колеблются в фазе с одной и той же частотой. Нормальные колебания совершаются с некоторой частотой ,определяемой массами обоих атомов и упругими силами связей: где с – скорость света; - силовая постоянная (сила связи или порядок связи, соответствующая упругой постоянной Гука); m и M – массы атомов. Амплитуда колебаний увеличивается при поглощении молекулой энергии. ИК–излучение, вследствие малой энергоемкости, не затрагивает электроны в молекуле, поэтому с ИК–спектроскопией напрямую связаны случаи вращательного и колебательного движения. Причем чисто колебательных спектров не существует, так как молекулы в основном и возбужденном колебательном состояниях распределены по ряду вращательных состояний, и при переходе молекулы из одного колебательного состояния в другое одновременно происходит изменение их вращательных состояний. Поэтому при рассмотрении колебательных переходов необходимо учитывать вращательные состояния. Способность вещества поглощать энергию ИК–излучения зависит от суммарного изменения дипольного момента молекулы при вращении и колебании, т.е. поглощать ИК–излучение может лишь молекула, обладающая электрическим дипольным моментом, величина или направление которого изменяется в процессе колебания и вращения. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в молекуле, т. е. электрическую асимметрию молекулы. Таким образом, не все молекулы способны поглощать инфракрасное излучение. Молекулы, имеющие центр симметрии, например молекулы типа H2, Cl2, O2 и им подобные, лишены дипольного момента и не приобретают его в процессе колебания и, следовательно, в инфракрасном спектре не активны. Энергетические уровни молекулы строго квантованы (т.е. имеют определенные дискретные значения, соответствующие устойчивым (стационарным) состояниям системы) и поэтому молекула поглощает только те частоты ИК–излучения, энергия которых соответствует разностям между двумя уровнями энергии связи. Следовательно, возрастание амплитуды колебания происходит не постепенно, а скачкообразно. Разность энергий состояний, между которыми происходит переход, равна согласно соотношению Бора: где h- постоянная Планка (6,62310-27 эргс/молекула); - частота измерения (с-1); - волновое число (см-1); Е2 и Е1 - энергии системы в конечном и начальном состояниях (эрг/молекула). Уравнение (5) справедливо не только для ИК-области, а для всех областей электромагнитного спектра. Таким образом, колебательно-вращательный спектр вещества наблюдается при поглощении им ИК - излучения, когда в результате взаимодействия с фотонами hпроисходят изменения колебательно-вращательных состояний, т.е. увеличиваются амплитуды колебания связей, при этом молекулы переходят на другиеуровни энергии. Колебательно-вращательный спектр определяется строением молекулы и состоит из отдельных полос. Число и частоты полос в спектре зависят: а) от числа образующих молекулу атомов; б) масс атомных ядер; в) геометрии и симметрии равновесной ядерной конфигурации; г) потенциального поля внутри молекулярных сил. Интенсивность полос в спектре определяется электрическими свойствами молекулы: электрическим дипольным моментом и поляризуемостью, а также их изменением в процессе колебаний. Экспериментальные исследования большого числа молекул, обладающих одними и теми же химическими группами, показали, что, независимо от изменений в остальной части молекулы, эти одинаковые группы поглощают в узком интервале частот. Такие частоты получили название характеристических или групповых. Существование характеристических частот можно объяснить следующим образом. Колебания определенной группы атомов или связей могут быть слабо связаны с колебаниями атомов остальной части молекулы. В этом случае частота колебаний этой группы или связи зависит только от их строения и мало зависит от окружающих атомов и связей. Вследствие этого различные молекулы, содержащие данную группу атомов или связей, будут характеризоваться различными колебательными спектрами, однако в каждом из них будет присутствовать одна или несколько одинаковых или почти одинаковых частот. Установление характеристических частот позволяет, не производя никаких расчетов, определять по спектру присутствие в молекуле различных групп и связей и тем самым установить строение молекулы. 3. Качественный и количественный анализ по ИК спектрам Определение состава смесей органических и неорганических соединений (качественный анализ) и установление концентраций компонентов смеси (количественный анализ) являются одними из важных задач ИК–спектроскопии. Для проведения как качественного, так и количественного анализа по ИК–спектрам необходимо иметь спектры чистых компонентов. При сравнении спектра со спектром вещества, присутствие которого предполагается, находят в спектре смеси все полосы поглощения эталонного вещества. Если спектр анализируемого образца содержит все полосы поглощения эталонного вещества, можно полагать, что вещество действительно содержится в образце. В настоящее время имеются атласы и автоматизированные картотеки спектров, с помощью которых можно отождествить любое соединение, если оно было раньше известно и для него получен колебательный спектр. В случае ИК-спектров, так же как и в случае ультрафиолетовых (УФ) и видимых спектров (ВИ) поглощения, соотношение между пропусканием света системой и концентрацией поглощающих веществ выражается законом Ламберта-Бугера-Бера: D=lg1/T=lg I0/I=сd (6) где D - оптическая плотность; I0 - интенсивность падающего света; I-интенсивность прошедшего света; с - молярная концентрация; d- толщина поглощающего слоя; - молярный коэффициент поглощения для данного волнового числа и температуры. Если закон Бугера – Ламберта – Бера выполняется, что бывает далеко не всегда, то при фиксированной толщине слоя оптическая плотность линейно зависит от концентрации вещества, что и позволяет легко проводить количественный анализ. Отклонения от линейной зависимости бывают связаны или с межмолекулярными взаимодействиями компонентов смеси (раствор), включая специфические (ассоциация, водородная связь) и химические взаимодействия или с инструментальными причинами. Играют роль также эффекты отражения, рассеяния излучения и т.д. Поэтому всегда проводится проверка выполнения закона светопоглощения и чаще всего для проведения количественного анализа строятся градуировочные графики по эталонам. Для снижения ошибок количественных измерений рекомендуется работать с пропусканием в пределах 20 … 60% (оптическая плотность в пределах 0,1 … 1,0) или, по крайней мере, не выходить за пределы 10 … 80% пропускания, когда ошибки резко возрастают. При большом поглощении необходимо уменьшать либо толщину слоя, либо концентрацию. Принципиальна схема спектрофотометра приведена на рисунке 2.2. 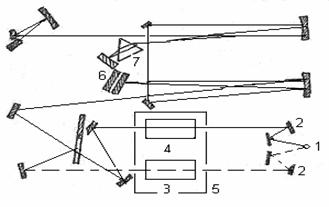 1 – источник излучения; 2 – система зеркал; 3 – образец исследуемого вещества; 4 – эталон; 5 – кюветное отделение; 6 – дифракционная решетка; 7 – призма. Рисунок 2.2 – Оптическая схема инфракрасного спектрофотометра Излучение, которое проходит из источника (1), с помощью системы зеркал (2) идут на исследуемую и эталонную пробы в кюветное отделение (5) спектрофотометра. Дальше оба излучения соединяются и направляются системою зеркал на вход монохроматора. Основной частью монохроматора есть дифракционная решетка (6) и призма (7), которые выделяют из общего излучения компонент с соответствующей длиной волны. Потом лучи попадают на термоэлемент, который в комплекте с усилительной системой производит сигнал, руководствующий движением пера самописца. В зависимости от угла поворота дифракционных решеток и призмы на приемник попадает монохроматическое излучение с разною длиною волн. Вращая решетку и призму, например, с помощью электродвигателя, можно обеспечить непрерывную развертку излучения по длинам волн. С помощью приёмника можно измерить интенсивные излучения, что прошло через образец, как функцию длины волны, которая и есть ИК-спектром. |
