|
Лекции_НМ_СП. Лекции 1,2 по курсам Основы спектральных методов анализа (НМ2) и Атомноэмиссионный анализ
Лекции 1,2
по курсам «Основы спектральных методов анализа» (НМ2)
и «Атомно-эмиссионный анализ» (СП)
(НМ2–28/2/32; СП–20/4/36)
СПЕКТРАЛЬНЫЙ АНАЛИЗ — это метод качественного и количественного определения состава веществ, основанный на исследовании их спектров испускания, поглощения, отражения и люминесценции.
Различают атомный и молекулярный спектральный анализ, задачи которых состоят в определении соответствующего элементного и молекулярного состава вещества. Эмиссионный спектральный анализ проводят по спектрам испускания атомов, ионов или молекул, возбужденных различными способами, абсорбционный спектральный анализ — по спектрам поглощения электромагнитного излучения анализируемыми объектами. В зависимости от цели исследования, свойств анализируемого вещества, специфики используемых спектров, области длин волн и др. факторов ход анализа, аппаратура, способы измерения спектров и метрологические характеристики результатов сильно различаются. В соответствии с этим спектральный анализ подразделяют на ряд самостоятельных методов (Атомно-абсорбционный анализ, Атомно-флуоресцентный анализ, Инфракрасная спектроскопия, Комбинационного рассеяния спектроскопия, Люминесцентный анализ, Молекулярная оптическая спектроскопия, Спектроскопия отражения, Спектрофотометрия, Ультрафиолетовая спектроскопия, Фотометрический анализ, Фурье-спектроскопия, Рентгеновская спектроскопия).
Часто под спектральным анализом понимают только атомно-эмиссионный спектральный анализ (АЭСА) — метод элементного анализа, основанный на изучении спектров испускания свободных атомов и ионов в газовой фазе в области длин волн 150-800 нм. Пробу исследуемого вещества вводят в источник излучения, где происходят ее испарение, диссоциация молекул и возбуждение образовавшихся атомов (ионов). Последние испускают характеристическое излучение, которое поступает в регистрирующее устройство спектрального прибора.
В целом спектроскопические методы анализа основаны на взаимодействии электромагнитного излучения с веществом. Это взаимодействие сопровождается явлениями, из которых наиболее важны испускание, поглощение и рассеяние излучения. Возникающие сигналы несут качественную и количественную информацию о веществе. Качественную информацию несет частота сигнала (интенсивное свойство), связанная с природой вещества, количественную—интенсивность сигнала (экстенсивное свойство), зависящая от его количества.
Чтобы понять, как возникает спектроскопический сигнал и как он связан с природой и количеством вещества, разберем природу электромагнитного излучения и строения вещества.
1. Электромагнитное излучение
Электромагнитное поле, создаваемое электрическими и магнитными силами (так же, как и другие физические поля), является одним из видов материи. Для него, как и для обычных материальных (химических) тел, справедливы общие законы сохранения материи и энергии. Материальные тела и физические поля имеют и существенные отличия. Если обычно материальные тела дискретны (корпускулярны), то материя физического поля непрерывна. Напротив, в определенных условиях материальные тела могут проявлять непрерывный характер, а физические поля—дискретную структуру. Одни виды материи могут переходить в другие. В частности, материя электрона может перейти в материю электромагнитного поля и наоборот.
Одно из свойств материи — движение, мерой которого является энергия. Так, колебательное движение электромагнитного поля — один из видов энергии, называемый электромагнитным излучением или светом. Так же, как и материя, один вид энергии может в определенных условиях переходить в другой. Например, энергия электрона может перейти в энергию электромагнитного поля.
1.1. Природа электромагнитного излучения
Экспериментальные факты привели к представлениям о двойственной природе электромагнитного излучения, которое в одних проявлениях имеет волновую природу, т. е. ведет себя как физическое поле с непрерывными свойствами, в других— корпускулярную, т. е. представляет собой поток дискретных частиц (фотонов). Если на пути электромагнитного излучения встречаются материальные тела, то наблюдаются такие явления, как преломление, интерференция, дифракция, отражение, рассеяние, описываемые на основе волновой природы излучения, a такие явления, как отклонение под действием притяжения или поглощение и испускание атомами и молекулами,—на основе корпускулярной природы излучения.
Волновые свойства. Электромагнитную волну можно представить в виде двух переменных полей, перпендикулярных друг другу и к направлению движения волны (рис. 1). Электромагнитную волну можно охарактеризовать несколькими параметрами.
Частота υ — число колебаний электрического поля в секунду, см-1.
Длина волны λ—расстояние между двумя максимумами.
Волновое число ῦ— число волн в 1 см.
Амплитуда а—максимальное значение вектора электрического поля.
С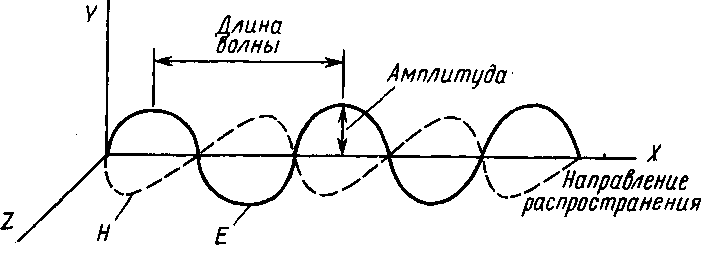 корость сi— скорость распространения излучения в определенной среде, в вакууме она максимальна (с = 2,99792∙1010 см∙с-1 корость сi— скорость распространения излучения в определенной среде, в вакууме она максимальна (с = 2,99792∙1010 см∙с-1 300000 км∙с–1). В любой другой среде ci = c/n, где n—коэффициент преломления.
Рис. 1. Электромагнитная волна:
Н—магнитная составляющая; Е—электрическая составляющая
Интенсивность I—энергия излучения в 1 с, приходящаяся на единицу телесного угла; она пропорциональна квадрату амплитуды (на практике часто за интенсивность принимают значение аналитического сигнала в произвольных единицах, например число делений шкалы прибора).
Мощность Р—энергия излучения, попадающая на данную поверхность за 1 с. Часто термин «мощность» подменяют термином «интенсивность».
Плоскостъ поляризации—плоскостьXY, в которой колеблется электрическое поле. Световой поток, состоящий из множества плоскостей поляризации, называют неполяризованным, а световой поток, в котором все электрические поля лежат в одной плоскости,— плоскополяризованным.
Длина волны, частота и скорость излучения связаны соотношением
Частота в зависимости от длины волны не зависит от скоростиci.
Корпускулярные свойства. Излучение состоит из потока дискретных \частиц (квантов света, или фотонов), движущихся со скоростью света. Фотон — материальная частица с определенными массой и импульсом, отклоняющаяся от прямолинейного пути под действием силы тяжести, но в отличие от других материальных тел движущаяся только со скоростью света. Каждый фотон обладает энергией, связанной с его массой и частотой или длиной волны соотношениями:
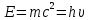 или или 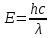
гдеh — постоянная Планка, равная 6,624∙10-27 эрг∙с = 6,6∙10-34 Дж∙с = 4,1∙10-15 эВ∙с.
Итак, каждый фотон можно при необходимости охарактеризовать частотой или энергией.
Двойственная (волновая и корпускулярная) природа свойственна всем материальным телам и физическим полям. Между массой, скоростью и длиной волны любого тела существуют такие же соотношения, как и для фотона.
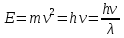 , ,
где v — скорость движения тела. Отсюда
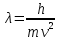
В зависимости от массы и скорости тела доминирует волновое или корпускулярное свойство. При больших массах и малых скоростях (гораздо меньших скорости света) длины волн материальных тел столь малы, что их волновые свойства нельзя обнаружить с помощью современной измерительной техники. При скоростях, близких к скорости света, и при очень малых массах материальных тел (электрон, позитрон) проявляется их волновая природа. При взаимодействии потока фотонов, т. е. электромагнитного излучения, со всем веществом (преломление на границе двух сред, отражение от поверхности, дифракция) доминирует волновая природа, при взаимодействии с отдельными атомами или молекулами — корпускулярная.
1.2. Спектр электромагнитного излучения
Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. Интервал длин волн от 10-10 до 10-1 м разбивают на области (рис. 2): ультрафиолетовая (УФ) область охватывает диапазон
10 — 380 нм; инфракрасная (ИК) область 750—105 нм; видимый свет, используемый в наиболее распространенных методах анализа, занимает узкую область 380 —750 нм.
Поток фотонов с одинаковой частотой называют монохроматическим, с разными частотами—полихроматическим. Обычный наблюдаемый поток излучения от раскаленных тел, в частности солнечный свет, является полихроматическим.

Рис. 2. Области электромагнитного спектра
2. Строение вещества и происхождение спектров
Из всего многообразия вопросов, связанных со строением вещества (структура кристаллических и некристаллических тел, теория химической связи, строение атомов, молекул и ядер), остановимся лишь на тех, которые имеют непосредственное отношение к спектроскопическим методам анализа,— это строение атомов и молекул.
2.1. Строение атома и происхождение атомных спектров
Атом—дискретная частица вещества размером
10-8 см, состоящая из положительно заряженного ядра радиусом
10-12 см и движущихся вокруг него отрицательно заряженных электронов. Скорость электрона столь велика, что в атоме доминируют его волновые свойства. Длина волны движущегося электрона
10-8 см соизмерима с атомными размерами, поэтому электрон нельзя представить в виде дискретного объекта, как это делается в классической физике, например при движении электронов в газоразрядной трубке. Электрон как бы размазан по атому в виде волны, и можно говорить лишь о вероятности его пребывания в какой-то точке внутри атома или о распределении плотности отрицательного заряда вокруг ядра, которое может быть достаточно сложным.
Области с максимальной плотностью заряда называют электронными орбиталями или энергетическими уровнями, поскольку каждая орбиталь характеризуется определенной энергией. Энергетическое состояние всего атома определяется в основном энергией электронных орбиталей.
Каждый электрон и атом, а следовательно, энергетический уровень описывают набором четырех квантовых чисел: главного, побочного, магнитного и спинового.
Главное квантовое число п характеризует удаленность электрона от ядра и принимает значения 1, 2, 3, .... Чем больше n, тем дальше от ядра находится электронная орбиталь.
Побочное квантовое число l определяет форму орбитали и принимает значения 0, 1, 2, 3, ..., которые обозначают буквамиs, р, d, f, .... Движущийся электрон обладает моментом количества движения. При l = 0 момент количества движения равен нулю и электрический заряд размазан по сфере, при l = 1 орбиталь имеет форму гантели.
Магнитное квантовое число т характеризует расположение орбитали в пространстве и принимает значения от –l до l. При l= 0 магнитное квантовое число равно нулю, при l = 1 оно принимает значения —1, 0, +1, и орбитали, имеющие форму гантели, располагаются вдоль осей прямоугольной системы координат.
Спиновое квантовое число ms, равное -1/2 и +1/2, отражает собственный момент импульса электрона.
По принципу Паули в атоме не может быть двух электронов с одинаковым набором квантовых чисел (хотя бы одно число должно отличаться). В противном случае силы отталкивания «вытолкнули» бы один из них на другую орбиталь. Поэтому многоэлектронный атом имеет сложную структуру: электроны с одинаковыми главными квантовыми числами образуют электронные слои-оболочки (уровни), обозначаемые буквами К, L, М, ... для /1 = 1, 2, 3, ... соответственно, а электроны с одинаковыми побочными квантовыми числами —подоболочки (подуровни) в пределах одной оболочки. Электроны с разными значениями l и т, но с одинаковым п могут оказаться равными по энергии (вырожденными), однако при воздействии какого-либо внешнего поля (электрического, магнитного и др.) вырождение снимается.
Происхождение атомных спектров
При изменении хотя бы одного квантового числа (главное n, побочное – l; магнитное – m; спиновое - ms) атом получает или отдает энергию. Это может произойти при взаимодействии атома с электромагнитным полем, при непосредственном обмене энергией с другими атомами или молекулами, например при столкновениях или при химических реакциях. В отсутствии внешних воздействий атом находится в основном состоянии, т. е. обладает наименьшей энергией. При получении энергии извне скорость электронов увеличивается— атом возбуждается.
Рис.3. Энергетические переходы в атоме
А 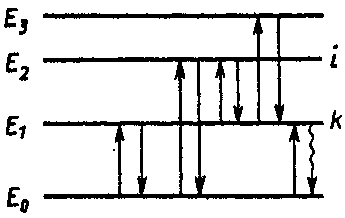 том не может получить или отдать любое количество энергии; энергетический обмен осуществляется только конечными порциями, в частности квантами электромагнитного излучения (фотонами). Иными словами, атом может находиться только в определенных энергетических состояниях, отличающихся друг от друга на конечную величину. На рис. 3 энергетические состояния изображены горизонтальными линиями, из которых нижняя отвечает основному уровню, а остальные — возбужденным; переходы из одного состояния в другое обозначены стрелками. том не может получить или отдать любое количество энергии; энергетический обмен осуществляется только конечными порциями, в частности квантами электромагнитного излучения (фотонами). Иными словами, атом может находиться только в определенных энергетических состояниях, отличающихся друг от друга на конечную величину. На рис. 3 энергетические состояния изображены горизонтальными линиями, из которых нижняя отвечает основному уровню, а остальные — возбужденным; переходы из одного состояния в другое обозначены стрелками.
Один атом за один акт поглощает или испускает только один фотон с определенной энергией (частотой). Вещество состоит из множества одинаковых атомов, способных переходить на разные энергетические уровни, испуская или поглощая фотоны разных частот. Совокупность всех фотонов одной и той же частоты составляет спектральную линию, при поглощении ее называют абсорбционной, при испускании—эмиссионной. Совокупность всех абсорбционных или всех эмиссионных линий называют абсорбционным (поглощение) или эмиссионным (испускание) спектром вещества.
Спектр поглощения получают, помещая исследуемое вещество в поле электромагнитного излучения (например, на пути светового потока), а для получения спектра испускания предварительно переводят атомы вещества в возбужденное состояние, что достигается подведением какого-либо вида энергии (тепловой, химической, электроразряда, электромагнитного излучения и т. п.); после возбуждения атомы через 10–9–10–7 с возвращаются в основное состояние, испуская фотоны либо теплоту. В последнем случае переход будет безызлучательным; на рис. 3 он изображен волнистой стрелкой.
Частота испускаемого или поглощаемого излучения определяется разностью энергии между электронными орбиталями ∆Е:
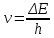 , где h – постоянная Планка , где h – постоянная Планка
Абсолютная энергия квантовых состояний неизвестна, поэтому ее отсчитывают от некоторого уровня, условно принятого за нулевой, а именно от энергии ионизации, т. е. полного отрыва электрона от атома.
Энергия атомных орбиталей сильно различается. Так, для возбуждения электрона с ближайшей к ядру орбитали (главное квантовое число n=1) требуется более 6∙104 кДж моль–1 (испускаемые фотоны имеют частоту рентгеновского излучения), а для возбуждения внешних электронов достаточно 150— 600 кДж моль-1 (излучение ультрафиолетовой и видимой областей). С увеличением главного квантового числа энергия возбуждения ∆Е и частота излучения уменьшаются (рис. 2.).
Наиболее вероятны переходы с первого возбужденного уровня на основной Е0; соответствующие им спектральные линии называют резонансными. Электрон может перейти и в более высокое энергетическое состояние (Е2, Е3 и т. д.). Возвращение его на уровень Е0 может проходить через ряд промежуточных ступеней.
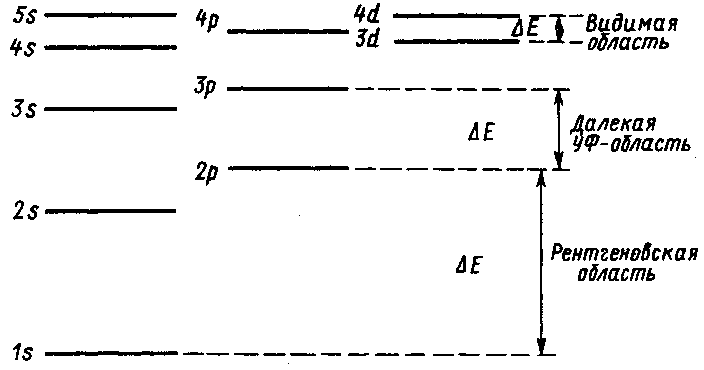 Рис. 4. Относительное расположение энергетических уровней различных квантовых состояний и изменение энергии при электронных переходах Рис. 4. Относительное расположение энергетических уровней различных квантовых состояний и изменение энергии при электронных переходах
Внешние легко возбудимые электроны называют оптическими, переходы с их участием дают оптический спектр. Энергия возбуждения внешних электронов разных элементов неодинакова. Например, для получения резонансной линии щелочных металлов (переход Е1→Е0) требуется сравнительно невысокая энергия (
2эВ, длины волн лежат в видимой области), для неметаллов эта энергия существенно больше (
5 эВ, длины волн лежат в УФ-области). Чем больше внешних электронов, тем больше возможностей имеет атом для энергетических переходов, поэтому спектры металлов типа железа состоят из тысяч линий, а спектры щелочных элементов бедны ими.
Атомно-спектроскопические методы анализа.
Все многочисленные энергетические переходы электронов по орбиталям атома могут быть использованы в аналитических целях. Методы анализа, основанные на изменениях энергетического состояния атомов веществ, входят в группу атомно- спектроскопических методов, различающихся по способу получения и регистрации сигнала.
Оптические методы используют энергетические переходы внешних (валентных) электронов, общим для них является необходимость предварительной атомизации (разложение на атомы) вещества.
Атомно-эмиссионная спектрометрия основана на испускании излучения атомами, возбужденными кинетической энергией плазмы, дугового или искрового разряда и т. п.
Атомно-флуоресцентная спектроскопия использует испускание излучения атомами, возбужденными электромагнитным излучением от внешнего источника.
Атомно-абсорбционная спектроскопия основана на поглощении атомами излучения от внешнего источника.
Рентгеновские методы основаны на энергетических переходах внутренних электронов атомов. В зависимости от способа получения и регистрации сигнала различают рентгеноэмиссионную, рентгеноабсорбционную и рентгенофлуоресцентную спектроскопию. Разновидности этих методов — оже-спектроскопию, рентгеновский электронно-зондовый анализ, электронную спектроскопию — используют в основном для исследования строения веществ. Рентгеновские методы не требуют атомизации вещества и позволяют исследовать твердые пробы без предварительной подготовки.
Ядерные методы основаны на возбуждении ядер атомов.
На рис. 5. приведены разные методы, основанные на атомной эмиссии или абсорбции. Эти методы широко применяют, и они отличаются высокой избирательностью, исключительной чувствительностью, скоростью и удобством; они относятся к наиболее селективным аналитическим методам. Этими методами можно определять около 70 элементов. Чувствительность обычно лежит в интервале 10-4—10–10%. Атомный спектральный анализ часто можно выполнить за несколько минут.
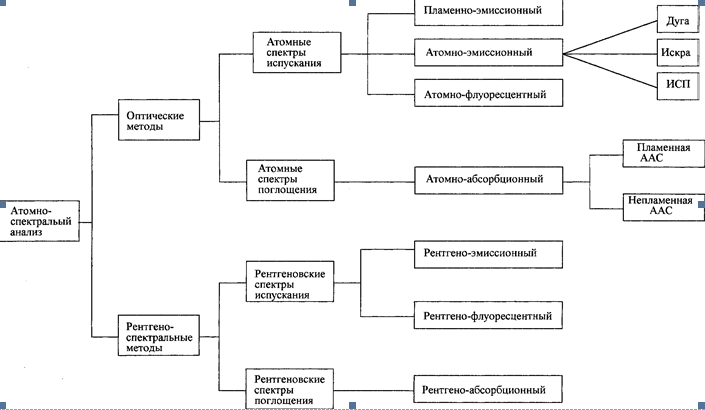
Рис. 5. Классификация методов атомной спектроскопии
2.2. Строение молекул и происхождение молекулярных спектров
Молекулы состоят из двух или более атомов, соединенных между собой в определенном порядке химическими связями, образующимися при взаимодействии внешних электронов. При этом атомы сближаются, но так, что их завершенные оболочки не соприкасаются. Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение самих атомов, вернее их ядер, и вращение молекулы как целого. Поэтому в любом стационарном состоянии энергия молекулы складывается изэлектронной, колебательной и вращательной энергий:
Е = Еэл +Екол +Евр
Наибольший вклад в полную энергию вносит энергия электронов, наименьший—энергия вращения молекулы:
Еэл >> Екол >> Евр
Вращение молекул проявляется у веществ лишь в газообразном состоянии, в конденсированных состояниях (жидком и твердом) вращение затруднено.
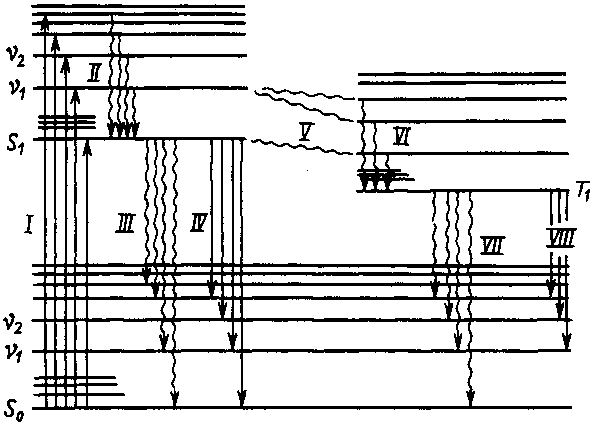
Рис. 6. Энергетические переходы в молекуле
Так же как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетическими уровнями (орбиталями). Каждому электронному состоянию отвечают колебательные уровни, а каждому колебательному уровню — вращательные (рис. 6). Любой уровень, помимо главного, побочного, магнитного и спинового, характеризуется колебательным и вращательным квантовыми числами.
Происхождение молекулярных спектров. При получении энергии извне или потере ее молекула переходит с одного энергетического уровня на другой (рис. 6). У молекул, так же как и у атомов, наиболее возбудимыми являются внешние (оптические) электроны. Энергия возбуждения внешних электронов молекул примерно такая же, как в атомах (150—600 кДж∙моль–1), что соответствует излучению в видимой и УФ-частях спектра. Переходы между колебательными уровнями в пределах одного электронного состояния отвечают меньшим энергиям (0,4–150 кДж∙моль–1, излучение в ИК-области), переходы между вращательными уровнями характеризуются еще меньшей энергией (0,01–0,4 кДж∙моль-1, излучение в далекой инфракрасной и микроволновой областях).
Переходы между энергетическими уровнями с изменением главного квантового числа являются электронными, между колебательными уровнями — колебательными, между вращательными уровнями—вращательными (соответственно спектры называют электронными, колебательными и вращательными). Чистых электронных и колебательных спектров нет. Электронный переход обязательно сопровождается изменением колебательного и вращательного состояний, а колебательный переход приводит к изменению вращательного состояния.
В спектроскопии чаще используют возбуждение молекулы под действием электромагнитного поля. При этом молекула поглощает фотоны с энергией, равной разности энергий ее орбиталей. Совокупность всех поглощенных частот составляет спектр поглощения молекулы (молекулярный абсорбционный спектр). Возбуждение молекул другими видами энергий, например в плазме, не применяют, гак как большинство веществ в этих условиях разлагается. Число энергетических состояний молекул велико и энергии отдельных Переходов бывают настолько близки, что различить их невозможно. Поэтому в молекулярных спектрах спектральные линии с близкими частотами сливаются в одну полосу поглощения.
Возвращение молекулы из возбужденного состояния в основное протекает сложнее, чем у атома. Сначала за короткое время (
10–13 с) молекула переходит на основной уровень возбужденного состоянияS1 (см. процесс II, рис. 6). Избыточная энергия при этом выделяется в виде теплоты. Далее процесс может пойти по одному из трех путей: 1) безызлучательный переход с выделением теплоты при столкновении молекул с другими частицами (процесс III); 2) переход на один из колебательных уровней невозбужденного состоянияS0 с испусканием фотона (процесс IV, флуоресценция); 3) переход на триплетный возбужденный уровень Т1 (процесс V), с которого возможен переход в состояниеS0 с выделением теплоты (процесс VII) или фотона (процесс VIII, фосфоресценция). Процессы флуоресценции и фосфоресценции объединяют под общим названиемлюминесценция.
В молекулах, как и в атомах, не все энергетические изменения равновероятны. Так, запрещены переходы более одного электрона за один акт, переходы с изменением побочного квантового числа больше чем на единицу, переходы с изменением спина. Однако вероятность запрещенных энергетических изменений в молекулах несколько выше, чем в атомах, например изменение спина.
Вероятность поглощения фотонов определяет интенсивность спектральных линий, составляющих полосу поглощения. Максимум полосы отвечает линии с наибольшей интенсивностью.
Молекулярно-спектроскопические методы анализа. По происхождению аналитического сигнала выделяют несколько молекулярно-спектроскопических методов.
Абсорбционная молекулярная спектроскопия основана на энергетических переходах валентных электронов, сигналы от которых проявляются в видимой и УФ-областях. Аналитические методы, построенные на поглощении молекулами видимого и УФ-излучений, называют спектрофотометрическими и фотометрическими. (Иногда методы, в которых используют поглощение видимого света, называют колориметрическими, от лат. color—цвет.)
Абсорбционная молекулярная спектрометрия (инфракрасная спектрометрия) основана на колебательных переходах, сигналы от которых проявляются в ИК-области. ИК-спектрометрия — одно из самых эффективных средств исследования строения молекул и идентификации соединений.
Люминесцентная спектрометрия базируется на испускании излучения после возбуждения молекул светом. Если энергетический переход происходит без изменения спина электрона, метод называют флуоресцентной спектрометрией, если с изменением — фосфоресцентной спектрометрией.
Магнитная резонансная спектроскопия основана на получении сигналов от молекул, помещенных в магнитное поле.
Фотоакустическая спектроскопия создана на измерении теплоты, выделяемой при безызлучательных переходах.
Рентгеновская спектроскопия основана на возбуждении внутренних электронов молекул.
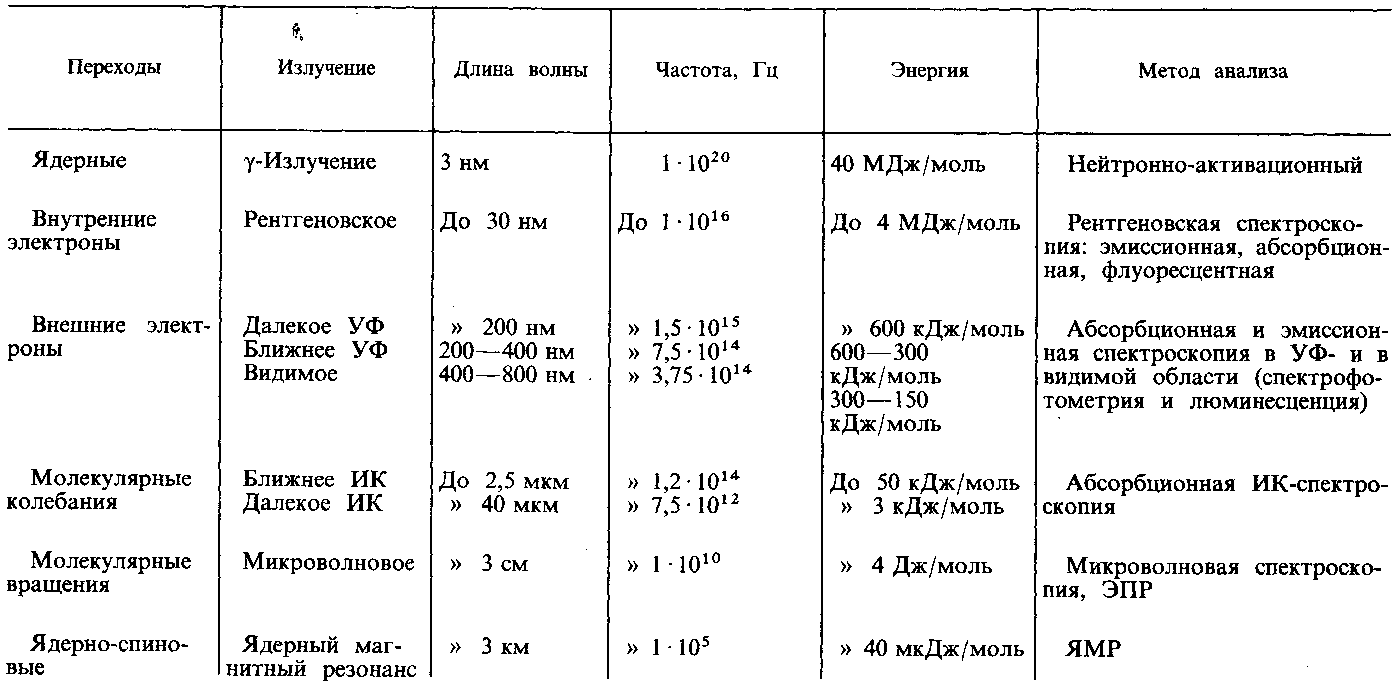
В табл. 2.1 приведены виды спектроскопии, используемые в аналитической химии.
Электромагнитный спектр и методы анализа Таблица 1
3. Атомная спектроскопия
Оптические атомно-спектроскопические методы, основанные на энергетических переходах в атомах, можно разделить на три группы: атомно-эмиссионные, атомно-абсорбционные и атомно-флуоресцентные. Выбор того или иного метода определяется типом образца, областью применения, требуемыми чувствительностью и точностью.
3.1. Атомно-эмиссионная спектроскопия
Метод атомно-эмиссионной спектроскопии (АЭС) основан на испускании (эмиссии) квантов электромагнитного излучения возбужденными атомами. Общую схему атомной эмиссии можно представить следующим образом:
A + E → A* → A + hv
где А—атом элемента; А* — возбужденный атом;hv—испускаемый квант света; Е—энергия, поглощаемая атомом.
Возбуждение атома происходит при столкновениях с частицами плазмы, дуги или искры, обладающими высокой кинетической энергией. При поглощении атомом энергии 100–600 кДж∙моль–1 внешний электрон переходит на один из более высоких энергетических уровней и через
10–8 с возвращается на основной или какой-либо другой уровень. При этом энергия выделяется либо в виде кванта светаhv определенной частоты (длины волны), либо теряется в виде теплоты при столкновениях с другими частицами.
В отличие от молекул атом не имеет колебательных и вращательных подуровней, в нем возможны только электронные переходы. Поскольку разность энергий электронных уровней достаточно велика, атомный спектр состоит из отдельных спектральных линий. Несмотря на ряд ограничений, связанных с правилами отбора, с той или иной степенью вероятности в пробе осуществляются все возможные переходы. Поэтому эмиссионный спектр состоит из множества спектральных линий разной интенсивности.
И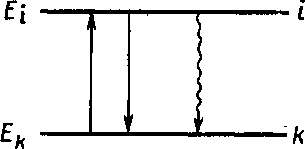 нтенсивность линии зависим от количества атомов, в которых осуществляется тот или иной переход. Чем более вероятен переход, тем больше атомов участвует в нем, тем интенсивнее спектральная линия. Рассмотрим переход i—k (рис. 7). Число фотонов (z), испускаемых частицами, находящимися в состоянииi (Ni), равно нтенсивность линии зависим от количества атомов, в которых осуществляется тот или иной переход. Чем более вероятен переход, тем больше атомов участвует в нем, тем интенсивнее спектральная линия. Рассмотрим переход i—k (рис. 7). Число фотонов (z), испускаемых частицами, находящимися в состоянииi (Ni), равно
zik = Aik∙Ni
Рис. 7. Один из энергетических переходов в атоме: волнистая стрелка — безызлучательный переход
гдеAik—коэффициент Эйнштейна, равный
109 —107 с-1, который показывает, сколько фотонов в секунду испускают Ni частиц.
Наиболее вероятны переходы с возбужденного уровня, ближайшего к основному. Спектральные линии, соответствующие такому переходу, называютрезонансными. Эти линии обладают наибольшей интенсивностью, их чаще всего используют в аналитической химии.
В спектрах атомов имеются линии с близкой энергией, их длины волн отличаются на несколько сотых или даже тысячных нанометра. Две такие линии составляют дуплет, три—триплет, четыре—квартет и т. д. Испускание дуплетов, триплетов и т. д. связано с мультиплетностью М, равной
M = 2S + 1
где S—суммарный спин атома.
Поскольку спин может принимать значения +1/2 и
1/2, очевидно, что мультиплетность на единицу больше числа неспаренных электронов в атоме. Например, в атоме натрия имеется один неспаренный электрон на уровне 35, следовательно, для него М=2 и в спектре натрия имеются резонансные линии 588, 996 и 589, 593 нм, составляющие дуплет. Для атомов с двумя внешними электронами М принимает значения, равные 1 и 3, т. е. осуществляются синглетные и триплетные переходы. Чем сложнее атом, тем больше линий в его спектре. Так, в спектрах тяжелых атомов (железо, никель) насчитываются тысячи линий. Спектры иона и атома элемента отличаются, поскольку их электронное строение неодинаково. В таблицах спектральных линий приводят длины волн элементов с указанием степени ионизации атома: нейтральные атомы обозначают римской цифрой I, однократно ионизованные атомы—II и т. д. Энергию, которую нужно сообщить атому для ионизации, называют потенциалом ионизации. Таким образом, для получения спектра атомов нельзя сообщать им энергию больше потенциала ионизации.

Рис. 5. Линейчатый спектр водорода и полосатый спектр азота
В атомной спектроскопии необходимо перевести вещество в атомарное состояние — атомизироватъ. В атомно-эмиссионных методах способ атомизации является одновременно и способом возбуждения атомов. Однако некоторые соединения атомизируются с трудом. Частично или полностью они остаются в виде молекул, которые дают спектры, состоящие из полос испускания. Такие спектры называютполосатыми (рис. 5) в отличие от линейчатых спектров атомов и ионов. Образование молекул при атомно-эмиссионном анализе чаще рассматривают как помеху, в некоторых случаях полосы поглощения используют для определения.
Лекции 3,4
Экскурс в историю спектрального анализа
Открытие спектрального анализа было подготовлено классическими исследованиями Ньютона, Волластона, Фраунгофера и других ученых. Были известны факты, указывающие на характеристичность излучения ряда веществ. Так, Тольбат еще в 1826 г. производил эксперименты с окрашенными пламенами, а Алтер в 1854 г. предложил признаки для определения некоторых металлов по их искровым спектрам. Однако годом рождения эмиссионного спектрального анализа считается 1859 г., когда немецкие физик Кирхгоф и химик Бунзен опубликовали совместную работу по обнаружению щелочных металлов с помощью спектроскопа и установили, что атомы поглощают те же самые длины волн, что и испускают, и что каждому химическому элементу принадлежит свой, характерный для него, и только для него, линейчатый спектр, который является такой же постоянной характеристикой элемента, как, скажем, его атомный вес. Это обстоятельство и положено в основу спектрального анализа.
До 1923 г. спектральный анализ имел, главным образом, качественный характер и сыграл важную роль в открытии новых элементов. Методами спектрального анализа было открыто 25 элементов периодической системы Д.И. Менделеева, в том числе: цезий и рубидий (Кирхгоф и Бунзен, 1861 г.), таллий (Крукс, 1861 г.), индий (Райх и Рихтер, 1863 г.), галлий (Лекок де Буабордан, 1875 г.), гелий (Локьер, 1868 г.). Рамзаем и Рэлеем были открыты инертные газы аргон, неон, ксенон и криптон; затем были открыты 14 редкоземельных элементов и, наконец, в 1923 г. гафний.
В чисто производственной обстановке спектральный анализ начал использоваться в 1923 г. в Англии для сортировки предназначенного к переплавке металлического лома, при этом применялся спектроскоп с дифракционной решеткой.
В России качественный спектральный анализ впервые широко применил в 1909 г. академик В.И. Вернадский при геохимических исследованиях.
Начиная с 1930-х гг., атомная спектроскопия развивается как способ количественного определения элементов и становится основным методом исследования состава вещества в самых различных областях науки и техники: металлургии, геологии, астрономии, биологии, медицине и др.
Основными преимуществами спектроскопии перед другими методами анализа являются:
высокая чувствительность (10–5…10–7 %) – практически чувствительность спектрального анализа всегда выше чувствительности весового химического анализа;
достаточно хорошая точность (3…5 %) – при малых концентрациях точность спектрального анализа превосходит точность химического анализа и может несколько уступать ему при больших концентрациях;
экспрессность – в абсолютном большинстве случаев при спектральном анализе затраты времени от взятия пробы и до получения конечного результата несравнимо меньше, чем при других методах анализа;
многокомпонентность – методами спектрального анализа возможно одновременное определение 20 и более элементов, в то время как при химическом анализе возможно только раздельное определение каждого элемента, для чего требуется проведение отдельных специфических реакций;
контроль изделий без их разрушений – спектроскопия остается единственным доступным методом анализа крупногабаритных изделий и предметов, не допускающих повреждения их поверхностей;
требование малого количества анализируемого образца – во многих случаях для проведения спектрального анализа достаточно сотых долей грамма исследуемого вещества;
универсальность – практически одни и те же методы спектрального анализа пригодны для определения различных элементов и в самых разнообразных объектах – от природного сырья до живой клетки;
документальность – при фотографическом варианте метода (получение фотопластинки) или при фотоэлектрической регистрации (лента самописца или распечатка) результаты анализа могут храниться длительное время и быть документом, по которому можно многократно произвести проверку правильности и точности анализа.
Наконец, имеется область исследований, не доступная до настоящего времени никаким другим методам анализа, кроме спектрального. Речь идет об изучении состава небесных тел и межзвездного вещества. Спектральный метод анализа имеет в этой области полную монополию.
Спектральные приборы
Общие характеристики. Спектральные приборы предназначены для анализа сложного излучения, непосредственно излучаемого различными телами или преобразованного в результате взаимодействия излучения с веществом. Эти исследования проводятся в широком диапазоне длин волн от далекой ультрафиолетовой области до миллиметровых радиоволн.
Спектральные приборы позволяют:
a) разложить исследуемое излучение в спектр, т.е. расположить по длинам волн излучение, которое попадает на вход прибора;
b) зафиксировать положение отдельных участков спектра или отдельных спектральных линий;
c) измерить интенсивность какого-либо участка спектра или спектральной линии.
По положению линий в спектре, т.е. по длинам волн, можно судить об уровнях энергии и внутреннем строении атомов и молекул, а по интенсивности линий – о вероятностях переходов между отдельными уровнями. Интенсивность спектральных линий определяется также числом излучающих атомов и молекул, что дает возможность определить содержание отдельных элементов и молекулярных соединений в исследуемом веществе. По форме контура спектральных линий можно сделать заключение о характере взаимодействия между частицами, о влиянии электрических и магнитных полей, а также о температуре, при которой происходит излучение. Таким образом, спектральные приборы исследуют излучение как сигнал, посылаемый в определенных условиях веществом и дающий информацию о его строении.
Различают атомный и молекулярный спектральный анализ. В обоих случаях анализ может проводиться по спектрам излучения и тогда он называется эмиссионным. Анализ по спектрам поглощения именуется абсорбционным.
Спектры излучения атомов обычно получаются при высокой температуре источника света, при которой происходит испарение вещества, расщепление его молекул на отдельные атомы и возбуждение атомов.
При исследовании спектров важно, чтобы в процессе анализа молекулы не изменили своей структуры. Спектры молекул можно изучать и в излучении, и в поглощении. Спектры сложных молекул легче изучать в поглощении, так как при этом они не распадаются.
При абсорбционном анализе свет от источника со сплошным спектром пропускают через исследуемое вещество. При этом часть световой энергии будет избирательно поглощаться атомами или молекулами вещества. В результате на фоне сплошного спектра появятся темные линии и полосы поглощения. По положению, структуре и коэффициенту поглощения этих линий можно узнать состав и строение исследуемого вещества.
Принципиальная схема спектрального прибора и назначение отдельных узлов. Спектральный прибор состоит из трех основных частей: осветительной, диспергирующей и приемно-регистрирующей.
Осветительная часть включает источник излучения и фокусирующую оптику, при помощи которой освещается узкая входная щель прибора.
Спектральная часть состоит из входной щели, диспергирующей и фокусирующей систем (рис.2).
Входная щель (3 на рис.2) является вторичным источником немонохроматического света или “предметом” по отношению ко всей последующей оптической части прибора. Изображение щели, разложенное диспергирующей системой по длинам волн и сфокусированное на выходе прибора и представляет собой наблюдаемый спектр источника излучения.
В принципе спектральный прибор можно построить и без входной щели, используя в качестве предмета непосредственно источник излучения. Но все реальные источники имеют значительные размеры и после разложения в спектр их монохроматические изображения частично наложатся друг на друга и их невозможно будет различать. Чтобы избежать этого, на пути лучей ставится узкая щель и ее монохроматические изображения получаются в виде резких линий. Именно форме изображения щели в свете той или иной длины волны обязано появление термина «спектральная линия».
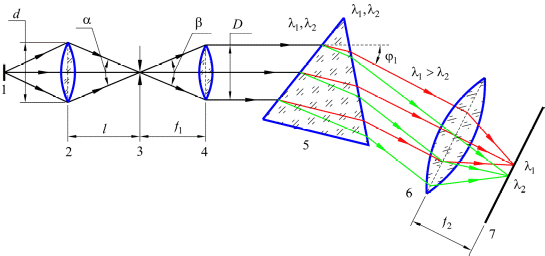
Рис. 2. Оптическая схема призменного спектрального прибора:
1 - источник света – исследуемое вещество;
2 - конденсорная линза;
3 - узкая входная щель;
4 - коллимирующий объектив;
5 - призма – диспергирующий элемент;
6 - фокусирующий объектив;
7 - фокальная плоскость – плоскость формирования спектра излучения.
Однако уменьшать ширину щели разумно лишь до определенного предела, обусловленного дифракцией, ниже которого дальнейшее ее сужение уже приводит не к уменьшению ширины спектральных линий, а, наоборот, к увеличению. Этот предел называется нормальной шириной щели и равен
SH = f1λ/D, (2)
где D – диаметр пучка света, падающего на призму, а затем на фокусирующий объектив.
При любой ширине щели S ≥ SH дифракционными явлениями на ней можно пренебречь и рассматривать ход лучей в приборе по законам геометрической оптики.
|
|
|
 Скачать 0.62 Mb.
Скачать 0.62 Mb.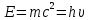 или
или 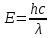
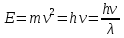 ,
,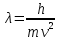
 том не может получить или отдать любое количество энергии; энергетический обмен осуществляется только конечными порциями, в частности квантами электромагнитного излучения (фотонами). Иными словами, атом может находиться только в определенных энергетических состояниях, отличающихся друг от друга на конечную величину. На рис. 3 энергетические состояния изображены горизонтальными линиями, из которых нижняя отвечает основному уровню, а остальные — возбужденным; переходы из одного состояния в другое обозначены стрелками.
том не может получить или отдать любое количество энергии; энергетический обмен осуществляется только конечными порциями, в частности квантами электромагнитного излучения (фотонами). Иными словами, атом может находиться только в определенных энергетических состояниях, отличающихся друг от друга на конечную величину. На рис. 3 энергетические состояния изображены горизонтальными линиями, из которых нижняя отвечает основному уровню, а остальные — возбужденным; переходы из одного состояния в другое обозначены стрелками. 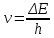 , где h – постоянная Планка
, где h – постоянная Планка


 нтенсивность линии зависим от количества атомов, в которых осуществляется тот или иной переход. Чем более вероятен переход, тем больше атомов участвует в нем, тем интенсивнее спектральная линия. Рассмотрим переход i—k (рис. 7). Число фотонов (z), испускаемых частицами, находящимися в состоянииi (Ni), равно
нтенсивность линии зависим от количества атомов, в которых осуществляется тот или иной переход. Чем более вероятен переход, тем больше атомов участвует в нем, тем интенсивнее спектральная линия. Рассмотрим переход i—k (рис. 7). Число фотонов (z), испускаемых частицами, находящимися в состоянииi (Ni), равно
 корость сi— скорость распространения излучения в определенной среде, в вакууме она максимальна (с = 2,99792∙1010 см∙с-1
корость сi— скорость распространения излучения в определенной среде, в вакууме она максимальна (с = 2,99792∙1010 см∙с-1 


