Потенциометрия. потенц. Инструментальными называют любые методы определения и обнаружения, в которых используют измерительные приборы (кроме аналитических весов)
 Скачать 74.31 Kb. Скачать 74.31 Kb.
|
|
1.Введение Инструментальными называют любые методы определения и обнаружения, в которых используют измерительные приборы (кроме аналитических весов). Инструментальные методы анализа (как химические, так и физические) возникали и развивались иначе, чем классические. На первой стадии ученые (как правило, вовсе не химики-аналитики, а физики или физико-химики) открывали и исследовали ранее не известное физическое явление (электролиз, дуговой разряд, люминесценцию и т.п.). На второй стадии обнаруживали, что некоторая физическая величина, характеризующая новое явление (например, количество электричества, сила тока или интенсивность излучения), функционально связана с концентрацией, т.е. может быть аналитическим сигналом при определении содержания какого-либо вещества. Если соответствующая характеристика оказывалась воспроизводимой, чувствительной, селективной и относительно легко измеряемой, на третьей стадии разрабатывали необходимую измерительную аппаратуру и одновременно создавали теорию нового метода анализа. И только затем разрабатывали и оптимизировали частные методики обнаружения и количественного определения различных веществ в реальных объектах. Исторически потенциометрический метод анализа стал вторым электрохимическим методом, он был создан вскоре после электрогравиметрии — на рубеже XIX и XX в. Теоретической основой потенциометрического метода стало уравнение Нернста, выведенное термодинамическим путем, в рамках представлений об осмотическом механизме возникновения электродного потенциала. Соответствующая статья была опубликована в 1889 г., когда Вальтер Нернст был еще 25-летним ассистентом Лейпцигского университета. Аналитическое применение потенциометрии началось вскоре после первых публикаций В. Нернста. Интересно, что новый метод возник в форме потенциометрического титрования, а не в более простом варианте прямой потенциометрии. Главным преимуществом этого метода является возможность раздельного определения ряда близких посвойствам компонентов одного и того же раствора, однако эта возможность была реализована гораздо позднее — в 1940-е гг. Потенциометрический метод стал точнее, когда И. Г. Поггендорфом была придумана остроумная компенсационная схема измерения разности потенциалов в отсутствие тока. В 1897 г. было предложено проводить кислотно-основное потенциометрическое титрование с индикаторным водородным электродом (В. Бётгер); в 1900 г. появилось окислительно-восстановительное титрование с платиновым электродом. Такое титрование можно было автоматизировать, прекращая его при достижении заданного значения потенциала. В 1923 г. Э. Мюллером была опубликована первая монография, обобщающая опыт потенциометрического титрования по разным реакциям. Прямая потенциометрия довольно долго была ограничена задачей определения значения рН. Широкому применению нового метода мешала немногочисленность подходящих индикаторных электродов. В первых работах по потенциометрии использовали только серебряный и ртутный электроды, другие появлялись постепенно: в 1893 г. — водородный, в 1900 г. — каломельный, в 1920 г. — хингидронный, в 1923 г. — сурьмяный и т. д. Водородная функция стеклянного электрода была выявлена биологом М. Кремером еще в 1906 г., а первый стеклянный электрод был создан Ф. Габером через три года. Основы теории этого электрода развиты выдающимся советским ученым — будущим академиком Б. П. Никольским в 1936-1937 гг. [1] 2.Теоретические основы потенциометрического метода анализа Потенциометрический метод – это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом. Данный метод рекомендуется для установления доброкачественности и количественного анализа некоторых фармакопейных препаратов. Использую потенциометрическое титрование, можно более объективно устанавливать точку эквивалентности, поэтому метод находит широкое практическое применение. Одним из направленияпотенциометрического метода является хронопотенциометрия. Сущность этого метода заключается в том, что потенциал одного их электродов записывают как функцию времени. Помимо аналитических целей метод может быть использован для изучения кинетики химических процессов. Потенциометрический метод также может быть использован при исследовании процессов разрушения лекарственных веществ при хранении.[2] 2.1.Принцип метода Аналитическим сигналом в потенциометрии является электродный потенциал. Зависимость потенциала электрода от состава была установлена в 1889г. Вальтером Нернстом. Для систем, возникновение потенциала в которых связано с окислительно-восстановительными процессами, уравнение Нернста для равновесного значения электродного потенциала (Е, В) записывают в следующем виде[3]: (1) где 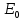 - стандартный потенциал редокс-системы; - стандартный потенциал редокс-системы; R - универсальная газовая постоянная, равная 8,312 Дж/(моль К); T - абсолютная температура, К; F - постоянная Фарадея, равная 96485 Кл/моль; n - число электронов, принимающих участие в электродной реакции; 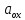 , , 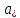 - активности соответственно окисленной и восстановленной форм редокс-системы; - активности соответственно окисленной и восстановленной форм редокс-системы;[ox], [red] - их молярные концентрации; 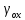 , , 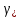 - коэффициенты активности. - коэффициенты активности.E= 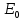 при при 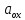 = = 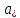 = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении. = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении. Подставляя T=298,15 и числовые значения констант в уравнение, получаем для 25 °C (2) Если в растворе присутствует лишь окисленная форма определяемого вещества(восстановленную форму представляет металлический электрод), а ионная сила и температура раствора постоянны, формулу (2) можно упростить: E=  ’+klgC (3), ’+klgC (3),где  ’-формальный(реальный)электродный потенциал, несколько отличавшийся от стандартного потенциала той же системы; k-коэфициент, зависящий от температуры раствора (при температуре 250С имеет k=0,059/z); С-концентрация окисленной формы, моль/л. ’-формальный(реальный)электродный потенциал, несколько отличавшийся от стандартного потенциала той же системы; k-коэфициент, зависящий от температуры раствора (при температуре 250С имеет k=0,059/z); С-концентрация окисленной формы, моль/л.Формула (3) описывает реальную зависимость потенциала металлического электрода от концентрации ионов того же металла в растворе. Она выполняется только для обратимых систем (например, для системы Ag/Ag+) и лишь в достаточно концентрированных растворах, не содержащих мешающих веществ. Если электродный потенциал не связан с окислительно-восстановительными процессами, зависимость Е=f(C) описывается иными формулами (для мембранных электродов-уравнение Никольского). Однако линейная зависимость электродного потенциала от логарифма концентрации потенциалопределяющих ионов наблюдателя и в этих случаях. При определении концентрации таких ионов зависимость (3) служит градуированной функцией. [3] 2.2. Электроды для потенциометрического анализа Природа возникновения потенциала различна. Можно выделить следующие три основные классы потенциалов, которые не исчерпывают, конечно, всего многообразия. Это: - электродные потенциалы; - редокс-потенциалы; - мембранные потенциалы.[4] Потенциометрический анализ включает два основных варианта-прямую потенциометрию и потенциометрические титрование. В обоих случаях исследуемый раствор погружают два электрода, отличающихся по своему назначению, устройству и электродному потенциалу. Электрод, у которого равновесный потенциал (Еинд) зависит от концентрации определяемого вещества (иона), называют индикаторным. Этот потенциал должен хорошо воспроизводиться при повторных измерениях, быстро устанавливаться и, что наиболее важно, не должен зависеть от концентрации других компонентов раствора. Второй электрод называют электродом сравнения. Он должен иметь постоянный потенциал Еср, не зависящий от состава раствора. Значения Еср для обычно применяемых электродов сравнения (хлорсеребряного, каломельного и др.) точно известны и приведены в справочниках. Потенциал электрода можно измерять только относительно какого-то другогоэлектрода. Именно поэтому в ходе анализа в раствор одновременно опускают два разных электрода и, в качестве первичного аналитического сигнала, измеряют разность потенциалов между ними (ΔЕ). Измерения ведут с помощью специальных электронных приборов – потенциометров. Следует помнить, что в потенциометрическом анализе на электроды не накладывают внешнее напряжение. Электрохимическая ячейка в таких условиях представляет собой гальванический элемент, разность потенциалов ΔЕ (или электродвижущая сила ЭДС) в котором возникает самопроизвольно. Если замкнуть электроды ячейки, через нее будет протекать ток, это вызывает поляризацию электрода (так называемое отклонение потенциала электрода от его равновесного значения) и соответственно систематическую погрешность потенциометрического анализа. Приборы для потенциометрического анализа конструируются таким образом, что ток либо вовсе не идет через ячейку, либо сила тока настолько мала, что поляризационными явлениями и электролизом раствора можно пренебречь. Измерив электродвижущую силу ячейки (ΔЕ) и зная значения Еср, можно рассчитать вторичный сигнал-Еинд. При этом исходя из того, что ЭДС ячейки равна разности потенциалов катода и анода. Если индикаторный электрод имеет более положительный потенциал, чем электрод сравнения, т.е. является анодом, получим: Еинд= ΔЕ+ Еср (4) Если же индикаторный электрод является катодом, используют формулу Еинд= Еср- ΔЕ (5) Формулы (4) и (5) несколько неточны, поскольку, не учитывая так называемый диффузионный потенциал, возникающий на поверхности раздела растворов разного состава (например, исследуемого диффузионного потенциала невелики, и в ходе потенциометрического анализа поправкой на диффузионный потенциал пренебрегают). Рассчитывать точное значение Еинд в ходе проведения анализа не обязательно, поскольку не только вторичный сигнал Еинд, но и непосредственно измеряемая величина ΔЕ линейно связана с логарифмом концентрации определяемого иона (аналита).Концентрацию аналита можно определить, пользуясь градуировочным графиком, заранее построенным в координатах ΔЕ - lgC. Однако следует помнить, что подобные графики линейны лишь в неизменных условиях измерения и лишь в определенном интервале концентраций аналита. По механизму возникновения электродного потенциала выделяют: - металические электроды - мембранные электроды [3]. В группе металлических электродов в свою очередь выделяют электроды первого рода, электроды второго рода и редокс-электроды. К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов. Электродами первого рода являются: 1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы. а) Металлический электрод – металл, погруженный в раствор своей соли M|Mn+, например, цинковый и медный электроды: Металлический электрод обратим по отношению к катиону. Его электродный потенциал б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями: Соответствующие им уравнения Нернста имеют вид:   Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе. [2] Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана вследующем виде: Е =  - -  ln[ ln[ ] [5] ] [5]Редокс-электроды состоят из электрохимически-инертного проводника (платины, графита и т. д.), погруженного в раствор, в котором находятся окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю цепь. Примерами таких электродов могут служить редокс-электроды с ионами в различных степенях окисления: (Pt)Sn4+, Sn2+, (Pt)Fe3+, Fe2+.   [6] Мембранные (ионселективные) электроды. В индикаторных электродах мембранного типа, применяемых в анализе, мембрана отделяет исследуемый раствор от вспомогательного раствора внутри электрода. На обеих поверхностях такой мембраны идут процессы ионного обмена между материалом мембраны и растворами, устанавливаются ионообменные равновесия и соответствующие им потенциалы. Если составы «внутреннего» и «внешнего» растворов различны, возникает разность этих потенциалов, тем большая, чем сильнее отличается по составу исследуемый раствор от внутреннего (состав внутреннего раствора известен и строго постоянен). Материал мембраны и способ ее предварительной обработки подбирают так, чтобы на электродный потенциал влияли ионы какого-то определенного вида (например, Н+), а все остальные ионы влияли бы как можно меньше. Поэтому мембранные электроды получили еще одно название – ионоселективные электроды (ИСЭ). Когда ИСЭ опускают в анализируемый раствор, создается электродный потенциал, зависящий от концентрации только определяемых ионов. Первым электродом мембранного типа стал созданный в 1908 г. стеклянный электрод с водородной функцией (это выражение означает, что равновесный потенциал электрода в основном зависит от концентрации катионов водорода). Начиная с 30-х годов XX века, стеклянный электрод стали использовать в качестве чувствительного элемента в приборах для измерения рН потенциометрическим методом. Такие приборы называют рН-метрами.  Рис.1. Схема стеклянного электрода 1 -серебряная проволока 2 - 0,1 М раствор соляной кислоты 3 - стеклянная мембрана  Рис.2. Зависимость потенциала стеклянного электрода от рН раствора (при 25゚С) Рассмотрим схематическое устройство стеклянного электрода (рис.1). Роль мембраны в данном случае выполняет тонкая стенка стеклянного шарика, внутри которого находится 0,1 М раствор HCl. Специальное стекло, из которого изготовлена мембрана, можно рассматривать как силикатную сетку, содержащую ионы натрия или других щелочных металлов. Перед началом работы электрод замачивают на несколько часов в растворе соляной кислоты. При этом происходит обмен части ионов натрия на ионы водорода. В дальнейшем, при погружении электрода в анализируемый раствор, равновесие ионного обмена смещается. Так как концентрация Н+-ионов во внутреннем растворе строго постоянна, измеряемый электродный потенциал зависит только от рН внешнего раствора (рис.2). В сильнощелочной и сильнокислой средах градуировочная функция искривляется вследствие побочных процессов. Перед измерением рН со стеклянным электродом рН-метр настраивают по эталонным буферным растворам с точно известными значениями рН. Например, по растворам кислых солей многоосновных органических кислот (винной, фталевой и др.). Меняя состав стекла и структуру мембраны, можно получить стеклянные электроды, селективные относительно ионов Na+ или других щелочных металлов. Для селективного определения других металлов (например, ионов Cu2+, Ag+, Cd2+, Hg2+) применяют кристаллические мембраны, например, халькогенидные, то есть содержащие сульфиды металлов. Многие анионы определяют с помощью жидкостных мембран. В этом случае ионообменный материал (вязкая органическая жидкость) распределен внутри эластичной полимерной пленки, отделяющей внутренний раствор от внешнего. Кроме мембранных электродов, к числу ИСЭ относят и некоторые другие электроды – газочувствительные, ферментные, полевые транзисторы и т.п.[7] 2.3.Виды потенциометрического анализа. Потенциометрические методы анализа подразделяются на два вида: - прямая потенциометрия, или ионометрия; - потенциометрическое титрование. 2.3.1.Прямая потенциометрия Метод прямой потенциометрии основан на измерении потенциала индикаторного электрода, погруженного в исследуемый раствор, и расчете концентрации определяемых ионов согласно уравнению Нернста. Метод достаточно прост. Достоинством и недостатком метода одновременно является то, что измеряемый потенциал зависит от активности. Это единственный метод прямого определения активности ионов в растворах. Но с другой стороны аналитиков чаще интересует концентрация, а пересчет активности ионов в концентрацию с применением эмпирических коэффициентов активности вызывает некоторую дополнительную погрешность. Существует вариант метода, в котором в калибровочные и анализируемые растворы вводится индифферентный электролит. Это позволяет проводить калибровку и последующий анализ в единицах концентрации. Прямая потенциометрия обладает важными достоинствами. В процессе измерений состав анализируемого раствора не меняется. При этом, как правило, не требуется предварительного отделения определяемого вещества. Метод можно легко автоматизировать, что позволяет использовать его для непрерывного контроля технологических процессов. Исторически первыми методами прямой потенциометрии были способы определения водородного показателя (рН- метрия). Для определения величины pH существуют два основных метода: колориметрический и потенциометрический. Потенциометрический метод намного точнее, чем колориметрический, но требует оборудования лабораторий специальными приборами - pH-метрами. pH-метр -- прибор для измерения водородного показателя (показателя pH), характеризующего концентрацию ионов водорода в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах. Действие pH-метра основано наизмерении величины ЭДС электродной системы, которая пропорциональна активности ионов водорода в растворе -- pH (водородному показателю). Измерительная схема, по сути, представляет собой вольтметр, проградуированный непосредственно в единицах pH для конкретной электродной системы (обычно измерительный электрод - стеклянный, вспомогательный - хлорсеребряный). Входное сопротивление прибора должно быть очень высоким - входной ток не более 10-10А (у хороших приборов менее 10-12А), сопротивление изоляции между входами не менее 1011Ом, что обусловлено высоким внутренним сопротивлением зонда - стеклянного электрода. Это основное требование к входной схеме прибора. Наибольшее практическое применение определения величины pH нашел стеклянный индикаторный электрод, который можно использовать в широком диапазоне pH и в присутствии окислителей. Крупный вклад в теорию и практику рН-метрии внесли ученые: Б.П. Никольский, М.М. Шульц, Е.Н. Виноградова и др. С середины 60-х годов за рубежом, а с 70-х годов в нашей стране стала бурно развиваться новая область физико-химических методов анализа - ионометрия (рH-метрии). Этот метод основан на разработке, изучении и практическом использовании различного рода ионоселективных электродов (ИСЭ). Иногда рН-метрию рассматривают как частный случай ионометрии. Градуировка шкал приборов потенциометров по значениям рH затруднена из-за отсутствия соответствующих стандартов. Поэтому при использовании ионоселективных электродов активности (концентрации) ионов определяют, как правило, с помощью градуировочного графика или методом добавок. Применение таких электродов в неводных растворах ограничено из-за неустойчивости их корпуса и мембраны к действию органических растворителей. Метод градуировочного графика является самым простым ионометрическим методом анализа. Процедура анализа состоит из 2-х этапов и включает в себя градуировку ионоселективного электрода (ИСЭ) относительно электрода сравнения и проведения измерений впробах. Градуировка состоит в измерении потенциала ИСЭ в стандартных растворах с известным содержанием определяемого иона. По результатам измерений строится график. В ионометрии принято выражать концентрацию ионов через величину рН, которая равна pН = -lg a. где а - активность компонента электрохимической реакции. Поэтому из уравнения Нернста следует, что закономерность изменения потенциала имеет следующий вид: E = B - S•pН, где E - разность потенциалов между ИСЭ и электродом сравнения; S - наклон электродной функции; В - константа. Эта закономерность называется электродной функцией. В координатах Е от рН градуировка электродов имеет вид прямой, наклон которой приближается к величине 59,2 мВ (для температуры 25 0C) для однозарядных ионов. Для двухзарядных ионов наклон равен 29,6 мВ. Если полученная из градуировки величина наклона существенно отличается от ожидаемой, то это говорит о неблагополучном ходе измерений. Анализ состоит в измерении потенциала ИСЭ в пробе и вычисления содержания определяемого компонента по градуировочному графику. Поскольку градуировочный график представляет собой прямую, то произвести расчеты по найденному потенциалу несложно. На практике калибровка линейна только в определенном диапазоне концентраций. Вне этого диапазона калибровка не линейна. В некоторых случаях можно использовать нелинейную часть калибровки, но это надо делать с оглядкой, так как не всегда можно контролировать процессы, происходящие с ионоселективными электродами в этих диапазонах. Важной особенностью метода градуировочного графика является необходимость постоянства условий проведения калибровки и измерений. При проведении измерений следует, прежде всего, уделять внимание уравниванию температуры и ионной силы, как в стандартных растворах, так и в анализируемых пробах. Несоблюдение этого условия ведет к увеличению погрешности измерений Метод добавок в ионометрии играет значительную роль. Ионометрический метод добавок дает два больших преимущества.Во-первых, если колебание ионной силы в анализируемых пробах непредсказуемо, то применение распространенного метода градуировочного графика дает большие ошибки определения. Применение метода добавок радикально меняет ситуацию и помогает свести к минимуму ошибку определения. Во-вторых, есть категория электродов, использование которых проблематично из-за дрейфа потенциала. При умеренном дрейфе потенциала метод добавок существенно снижает ошибку определения. Существуют следующие модификации метода добавок: метод стандартной добавки; метод двойной стандартной добавки; метод Грана. Процедура состоит в том, что в анализируемую пробу делается добавка раствора, содержащего тот же анализируемый ион. После каждой добавки записываются показания электродов. В зависимости от того, как далее будут обрабатываться результаты измерений, метод будет называться методом стандартной добавки или методом Грана. Метод двойной стандартной добавки заключается в том, что к анализируемому раствору добавляются 2 порции стандартного раствора. Величина этих порций одинакова. По результатам измерений вычисляется параметр R = ДE2 / Д E1. где Д E1 - разность между потенциалом электродов в анализируемом растворе, и в растворе после первой добавки; ДE2 - разность между потенциалом электродов в анализируемом растворе, и в растворе после второй добавки. Пользуясь вычисленным параметром, по специальной таблице находится искомое значение концентрации. Метод двойной стандартной добавки лучше применять только для очень надежных в эксплуатации электродов (фторидселективный). [8] 2.3.2.Потенциометрическое титрование Потенциометрическое титрование основано на определении точки эквивалентности по изменению потенциала индикаторного электрода при проведении химической реакции между титрантом и определяемым веществом. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода, если хотя бы один из участников реакции титрования является участникомэлектродного процесса. Виды кривых титрования приведены на рисунке 3: |
