ик. Закон Бугера ламберта бера спектроскопические методы анализа
 Скачать 353.5 Kb. Скачать 353.5 Kb.
|
|
5.2. Ограничения и условия применимости закона Бугера - Ламберта - Бера Линейная зависимость между оптической плотностью и толщиной слоя при данной концентрации является общим правилом, из которого нет исключений. Наоборот, с отклонениями от линейной зависимости между оптической плотностью и концентрацией при постоянной толщине слоя приходится сталкиваться довольно часто. Некоторые из этих отклонений носят фундаментальный характер, другие связаны со способом измерения оптической плотности или с состоянием определяемого вещества в растворе.
А Индекс
Cr2O72- + H2O Молярные коэффициенты бихромата, гидрохромата и хромата довольно сильно различаются. Зависимость оптической плотности от общей концентрации хрома не будет линейной. Ограничения 1 и 2 являются истинными, остальные называют кажущимися; ограничения (3 - 5) зависят от условий проведения эксперимента, их связывают с инструментальными причинами. Последнее из ограничений вызвано химическими причинами. 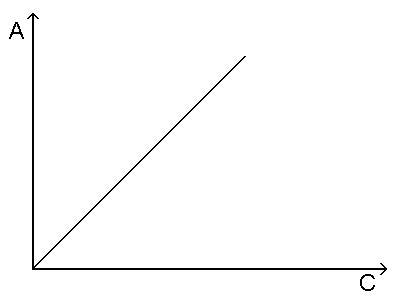 Рис. 5.1. Зависимость оптической плотности вещества от концентрации при соблюдении основного закона светопоглощения. При выполнении закона Бера график зависимости оптической плотности от концентрации представляет собой прямую, проходящую через начало координат (рис. 5.1.), а функция А 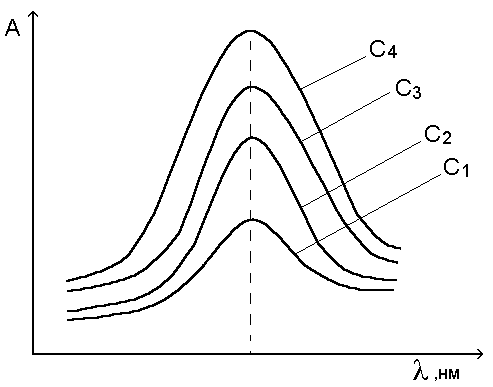 Рис. 5.2. Кривая светопоглощения одного и того же вещества при соблюдении закона Бугера - Ламберта - Бера. С1 < С2 < С3 < С4. 5.3. Закон аддитивности Оптическая плотность - экстенсивное свойство вещества. Поглощение света каким - либо веществом не зависит от присутствия в растворе других веществ, и оптическая плотность смеси веществ равна сумме оптических плотностей каждого из них. Это справедливо при условии подчинения каждого вещества закону Бугера - Ламберта - Бера и в отсутствие химического взаимодействия между ними. Итак, для смеси m веществ при одной и той же длине волны имеем: A = A1 + A2 + ... + Am (5.5.) или: A Принцип аддитивности (суммирования) оптических плотностей широко используют в аналитической химии. МОЛЕКУЛЯРНАЯ АБСОРБЦИОННАЯ СПЕКТРОСКОПИЯ В УФ- И ВИДИМОЙ ОБЛАСТЯХ СПЕКТРА. Фотоколориметрический анализ (молекулярная абсорбционная спектроскопия) относится к оптическим методам анализа. Метод основан на способности вещества поглощать электромагнитное излучение оптического диапазона. Оптический спектр включает ультрафиолетовую, видимую и ИК- области. Наибольшее распространение получили фотометрические методы анализа, основанные на поглощении в видимой области спектра, т.е. в интервале длин волн 400 – 780 нм. Излучения видимой области спектра поглощают только окрашенные соединения. Фотометрический метод анализа широко применяют для решения проблем технологического контроля; в санитарно-гигиеническом анализе для определения аммиака, нитратов, катионов различных металлов в воде; для определения витаминов в продуктах питания и т.д. Метод имеет низкий предел обнаружения (10-5 – 10-6 М), относительная ошибка большинства определений 1 – 2 %. В основе фотометрического метода анализа лежит избирательное поглощение света частицами (молекулами или ионами) вещества в растворе, при некоторых длинах волн светопоглощение происходит интенсивно, а при некоторых свет не поглощается. Поглощение квантов hν электромагнитного излучения оптического диапазона молекулой или ионом обусловлено переходом электронов на орбитали с более высокой энергией. Цветность как способность к поглощению определенных квантов электромагнитного излучения оптического диапазона определяется электронным строением молекулы. Обычно это связано с наличием в молекуле хромофорных групп. Конкретные хромофорные группы обуславливают возможность осуществления определенных электронных переходов. За формирование аналитического сигнала ответственными являются в основном d →d*- и π→π*- переходы. d → d*- Переходы характерны для аква- ионов и некоторых комплексных соединений d-элементов с неполностью заполненными d-орбиталями. π→π*- Переходы свойственны молекулам органических соединений и обеспечивают их окраску, наряду с малоинтенсивными n > π*- переходами. Если молекула органического соединения способна образовывать комплексы с ионами металлов, то изменение энергии π→π*- перехода вызывает появление или изменение окраски комплекса по сравнению с исходным состоянием. Каждая молекула обладает определенным набором возбужденных квантовых состояний, отличающихся значением энергии, поэтому интенсивно поглощаются те кванты света, энергия которых равна энергии возбуждения молекулы. Характер поглощения зависит от природы вещества, на этом основан качественный анализ. Для количественного анализа используют зависимость светопоглощения от концентрации определяемого вещества. Основной закон светопоглощения – закон Бугера-Ламберта-Бера: lg I/ I0= A λ=ελlc (1.1) где Io – интенсивность первоначального излучения, падающего на объект; I – интенсивность излучения, прошедшего через объект; Aλ – оптическая плотность раствора С – концентрация, моль/л; l – толщина поглощающего слоя, см; ελ - молярный коэффициент светопоглощения при данной длине волны. Молярный коэффициент светопоглощения характеризует чувствительность реакции и является постоянной величиной для данного окрашенного соединения. Для повышения чувствительности определения выбирают реакцию с максимальным значением ε. (см. справочник по аналитической химии). Значение ε для различных окрашенных соединений различны: для аква- комплексов меди и др. ε порядка 10, для аммиакатов ε = 102-103, для органических соединений – 104 - 105. Молярный коэффициент поглощения раствора можно рассчитать, если приготовить серию растворов с известными концентрациями веществ и измерить оптическую плотность раствора. Коэффициент линейной регрессии зависимости А = f(С) представляет собой молярный коэффициент поглощения. Закон Бугера – Ламберта - Бера строго справедлив только для разбавленных растворов и в определенных условиях: • постоянство состава и неизменность поглощающих частиц в растворе; • исследуемые молекулы должны быть диспергированы до молекулярного, т.е. гомогенного уровня, они не должны рассеивать свет и взаимодействовать друг с другом; • монохроматичность и параллельность проходящего через раствор лучистого потока небольшой интенсивности; • постоянство температуры. Отклонения от закона Бугера - Ламберта - Бера. Часто наблюдаются явные и реальные отклонения от закона Бугера - Ламберта - Бера. Поэтому в сомнительных случаях необходимо экспериментальное подтверждение закона. Рассеяние и отражение от поверхности образца подобно поглощению также уменьшают интенсивность света, поэтому свет в образце должен ослабевать только из-за поглощения, но не отражения или рассеяния. Дальнейшие очевидные отклонения вызваны участием поглощающего вещества в реакциях, конкурирующих с основной, особенно с увеличением концентрации раствора (процессы ассоциации, полимеризации, комплексообразования и т.д.); а также при уменьшении концентрации раствора (процессы диссоциации, гидролиза, сольватации). Пример: MnO4 – ионы в водных растворах реагируют с водой по схеме: 4MnO4− + 2H2O →4MnO2↓ + 3O2 ↑ +4OH− С ростом концентрации KMnO4 каталитические процессы разложения ускоряются, что сопровождается уменьшением концентрации MnO4-, вследствие чего наблюдается отклонение от основного закона светопоглощения. Поэтому при фотометрических измерениях применяют только свежеприготовленные растворы KMnO4 невысоких концентраций. Важно отметить, что часто наблюдаемое отклонение от закона Бугера - Ламберта - Бера связано с так называемым эффектом сита. Он обусловлен неоднородным распределением поглощающего вещества. В результате негомогенного распределения измеряемых молекул в образце образуются «дырки», через которые кванты света будут проходить без взаимодействия с поглощающим веществом (как сквозь сито). Следовательно, закон не будет выполняться. Количественное определение вещества по светопоглощению основано на применении закона Бугера - Ламберта - Бера. Концентрацию можно определить пользуясь: методом градуировочного графика А = f(C), методом сравнения или методом добавок. Основные приемы фотометрического определения. 1. Метод градуировочного графика. Закон Бугера - Ламберта - Бера аналитически выражается уравнением прямой зависимости Аλ от концентрации. Однако в силу химических и инструментальных причин эта линейная зависимость часто не выполняется. В таких случаях необходимо значительно увеличить число точек градуировочного графика зависимости Aλ стандартных растворов от их концентрации. Однако, даже в отсутствие нарушений линейности, нужно иметь не менее 3-4 точек, чтобы быть уверенным в надежности анализов. Недостатки метода: трудности приготовления эталонных растворов и влияние «третьих» компонентов (сами не определяются, но влияют на результаты измерения). Этот метод обладает высокой точностью, потому получил широкое применение. 2. Метод определения молярного коэффициента поглощения. Применим к растворам, обязательно подчиняющимся основному закону фотометрии. Готовят несколько стандартных растворов (сст) и измеряют их Аст. Рассчитывают ελ по формуле ελ=Аст/сст. Находят среднее арифметическое этих величин. Очень трудно определить истинное значение ε, поэтому εср лучше определить, используя табличные данные. Затем измеряют оптическую плотность исследуемого раствора и рассчитывают концентрацию вещества по формуле: c= (A λ/ ε λ ) l (1.2) 3. Метод добавок. Сначала определяют оптическую плотность анализируемого раствора Ах с концентрацией сх. После этого в исследуемый раствор добавляют известное количество определяемого компонента сст и снова фотометрируют, измеряя Ах+ст. Оптические плотности растворов равны: Ax = ελ·l·cx и Ax+ст = ελ·l·(cx + cст) (1.3) Поделим эти выражения и получим: cx = сст · Ax/( Ax+ст - Ax) (1.4) Спектры поглощения одного и того же вещества в координатах А - λ имеют одинаковый вид независимо от толщины слоя раствора или концентрации вещества в растворе и характеризуются максимумом при одной и той же длине волны, при которой и проводят все определения. Анализ однокомпонентных систем. Поглощение исследуемого раствора обычно измеряют относительно раствора сравнения, поглощение которого условно принимается равным нулю. Если раствор сравнения представляет собой чистый растворитель или так называемый «раствор контрольного опыта» (т.е. раствор, подвергнутый той же обработке и содержащий все компоненты измеряемого раствора за исключением исследуемого вещества), то такой метод измерения называют абсолютным. С целью повышения точности молекулярного абсорбционного анализа и расширения диапазона определяемых концентраций используют дифференциальные методы. Различают метод определения высоких концентраций веществ, метод определения малых концентраций веществ и метод предельной точности. В аналитической практике наибольшее распространение получил метод определения высоких концентраций веществ. В этом методе в качестве раствора сравнения используют стандартный раствор с концентрацией сo. Измеряемая этим методом относительная оптическая плотность исследуемого раствора Аотн с концентрацией вещества сх равна: Аотн=Ах - Ао=ε(сх- сo), (1.5) где Ах и Ао – оптические плотности исследуемого раствора и раствора сравнения, измеренные абсолютным методом. Выбор раствора сравнения является наиболее ответственной процедурой при выполнении дифференциальных измерений. Для достижения максимальной точности определения концентрации вещества следует использовать раствор сравнения, для которого значение условной оптической плотности εlcо максимально. Точность дифференциальных определений приближается к точности классических методов анализа, характеризующихся погрешностями 0.2-0.5%. |
