Взаимодействие веществ с электромагнитным излучением в видимой и УФ областях спектра. Атомные и молекулярные спектры. Закон Бугера –Ламберта –Бера
СПЕКТРОСКОПИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Спектроскопические методы анализа основаны на взаимодействии электромагнитного излучения с веществом. Это взаимодействие сопровождается явлениями, из которых наиболее важны испускание, поглощение и рассеяние излучения. Возникающие при этом сигналы несут качественную и количественную информацию о веществе.
Частота сигнала отражает специфические свойства вещества, его природу, а интенсивность сигнала связана с количеством анализируемого соединения. Для наблюдения и исследования таких сигналов используются различные физические закономерности. Благодаря этому методы спектроскопии позволяют получать детальную информацию о составе, строении и количественном содержании исследуемых веществ.
Характеристики электромагнитного излучения
Электромагнитное излучение имеет двойственную природу. В одних проявлениях ведет себя как физическое поле с непрерывными свойствами (преломление, интерференция, дифракция, отражение, рассеяние), которые описываются на основе волновой природы излучения. В других случаях электромагнитное излучение проявляет себя как поток дискретных частиц (квантов), и такие явления, как испускание и поглощение атомами и молекулами, описываются на основе корпускулярной природы излучения.
Для описания волновых свойств электромагнитное излучение удобно представить в виде электрического силового поля, колеблющегося перпендикулярно направлению распространения волны (рис.1.1.). К волновым характеристикам излучения относятся частота колебаний, длина волны и волновое число, к квантовым - энергия квантов.
Частота n показывает число колебаний электрического поля в 1с, измеряется в герцах (1 Гц = 1с -1). Частота определяется источником излучения.
Длина волны 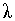 показывает наименьшее расстояние между точками, колеблющимися в одинаковых фазах. Это линейная единица, в системе СИ измеряется в метрах (м) и его долях. показывает наименьшее расстояние между точками, колеблющимися в одинаковых фазах. Это линейная единица, в системе СИ измеряется в метрах (м) и его долях.
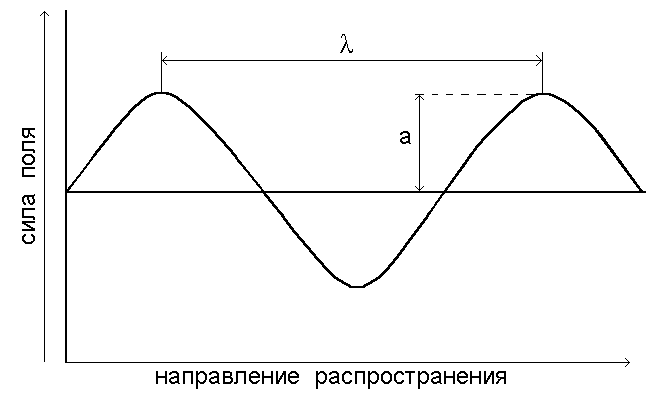
Рис. 1.1.Электромагнитная волна. 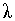 - длина волны, а - амплитуда. - длина волны, а - амплитуда.
Произведение частоты и длины волны представляет собой скорость излучения (см / с):
C = 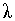 · · 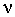
При переходе из вакуума в другую среду скорость распространения уменьшается. То же происходит с длиной волны, поскольку частота излучения неизменна.
Волновое число 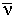 показывает число волн, приходящихся на 1 см. Если длина волны выражена в см, то показывает число волн, приходящихся на 1 см. Если длина волны выражена в см, то
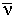 = 1 / = 1 / 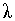 (см -1) (см -1)
Энергия электромагнитного излучения Е зависит от частоты излучения и определяется соотношением:
E = h 
где h - постоянная Планка, равная 6,62 · 10 -34 Дж· с.
Электромагнитный спектр
Совокупность всех частот (длин волн) электромагнитного излучения называют электромагнитным спектром. В зависимости от длины волны в электромагнитном спектре выделяют следующие участки (рис.2.1.):
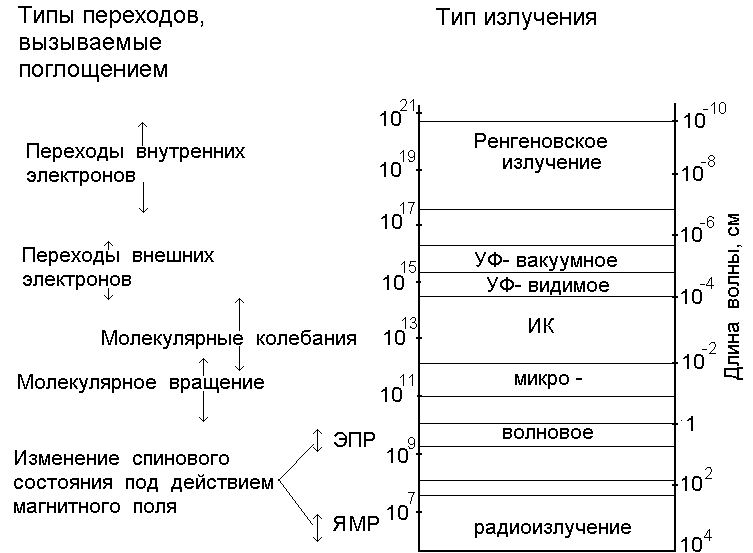
Рис. 2.1. Области электромагнитного спектра
Протяженность отдельных областей спектра ограничивается либо способом получения излучения, либо возможностями его регистрации. Особо четкие границы можно установить для видимого света. Протяженность ультрафиолетовой (УФ) области в сторону более коротких волн резко ограничена: 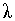 = 200 нм. Ниже этого значения начинается поглощение УФ - излучения воздухом, поэтому исследования в области = 200 нм. Ниже этого значения начинается поглощение УФ - излучения воздухом, поэтому исследования в области 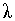 < 200 нм возможны только в вакууме (так называемый вакуумный ультрафиолет). Границы между другими областями спектра менее четкие, и сами эти области частично перекрываются. < 200 нм возможны только в вакууме (так называемый вакуумный ультрафиолет). Границы между другими областями спектра менее четкие, и сами эти области частично перекрываются.
В отдельных областях спектра используют различные единицы измерения длин волн и частоты. В области радио - и микроволн для измерения частот используют герцы, килогерцы, мегагерцы. Однако при частотах выше 10 12 Гц (инфракрасная область - ИК) точность измерения частот по сравнению с точностью измерения длин волн становится неудовлетворительной. Кроме того, пропорциональность между энергией и величиной, обратной длине волны, позволяет быстро оценить энергетические характеристики, поэтому вместо частоты или длины волны удобнее использовать волновое число.
Поток фотонов с одинаковой частотой называют монохроматическим, с разными частотами - полихроматическим. Обычный наблюдаемый поток излучения от раскаленных тел, в частности, солнечный свет, является полихроматическим.
Происхождение молекулярных спектров
При прохождении излучения через прозрачный слой твердого тела, жидкости или газа происходит селективное поглощение излучения с определенными частотами. Электромагнитная энергия в этом случае передается атомам или молекулам вещества и переводит поглощающие частицы из нормального состояния, или основного, в возбужденное.
Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение ядер атомов и вращение молекулы как целого. Поэтому в любом стационарном состоянии энергия молекулы складывается из электронной, колебательной и вращательной энергий:
Е = Евр + Екол + Еэл (3.1.)
Наибольший вклад в полную энергию вносит энергия электронных переходов, наименьший - энергия вращения молекул:
Евр << Екол << Еэл = 1 : 102 : 103
Так же, как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетическими уровнями (орбиталями). Каждому электронному состоянию соответствуют колебательные уровни, а каждому колебательному уровню - вращательные. Любой уровень, помимо главного, побочного, магнитного и спинового, характеризуется колебательным и вращательным квантовыми числами.
При получении энергии извне молекула переходит с одного энергетического уровня на другой. У молекул, так же как и у атомов, наиболее возбудимыми являются внешние (оптические) электроны. Энергия возбуждения внешних электронов молекул примерно такая же, как в атомах (150 - 600 кДж / моль), что соответствует излучению в видимой и УФ - частях спектра. Переходы между колебательными уровнями в пределах одного электронного состояния отвечают меньшим энергиям (0,4 - 15 кДж/моль, излучение в ИК - области), переходы между вращательными уровнями характеризуются еще меньшей энергией (0,01 - 0,4 кДж / моль, излучение в далекой инфракрасной и микроволновой областях).
Переходы между энергетическими уровнями с изменением главного квантового числа являются электронными, между колебательными уровнями - колебательными, между вращательными уровнями - вращательными переходами (соответственно, спектры называют электронными, колебательными и вращательными). Чистых электронных и колебательных спектров нет. Электронный переход обязательно сопровождается изменением колебательного и вращательного состояний, а колебательный переход приводит к изменению вращательного состояния.
В спектроскопии, как отмечалось выше, чаще используют возбуждение молекулы под действием электромагнитного поля. При этом молекула поглощает фотоны с энергией, равной разности энергий ее орбиталей. Совокупность всех поглощенных частот составляет спектр поглощения молекулы (молекулярный абсорбционный спектр). Поглощение электромагнитного излучения веществом М можно представить как двухступенчатый процесс, первая ступень которого выражается следующим образом:
М + h 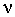 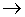 M*, M*,
где М*- атом или молекула в возбужденном состоянии. Время пребывания в возбужденном состоянии невелико (10 -9 - 10 -8с); частицы возвращаются в исходное состояние в результате какого - либо релаксационного процесса. Наиболее известным видом релаксации является превращение энергии возбуждения в тепло:
М* 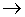 М + тепло. М + тепло.
Релаксация может произойти в результате разрушения М* с образованием новых веществ - фотохимическая реакция, а также при переходе в невозбужденное состояние с выделением фотона - флуоресценция и фосфоресценция. Эти процессы объединяют под общим названием люминесценция:
М* 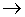 М + h М + h 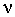 . .
В молекулах, как и в атомах, не все энергетические изменения равновероятны. Так, запрещены переходы более одного электрона за один акт, переходы с изменением побочного квантового числа больше, чем на единицу, переходы с изменением спина. Однако, вероятность запрещенных энергетических изменений в молекулах несколько выше, чем в атомах, например, изменение спина.
Важно иметь в виду, что время жизни частиц М* обычно столь мало, что концентрация их в любой момент времени при нормальных условиях ничтожна. Более того, количество выделяющегося тепла неощутимо. Вследствие этого облучение системы при ее изучении сопровождается минимальным разрушением, что является преимуществом абсорбционных методов.
Возбуждение молекул другими видами энергии, например, в плазме, не применяют, так как большинство веществ в этих условиях разлагается.
Классификация методов спектроскопии
4.1. Атомная спектроскопия
Методы анализа, основанные на изменении энергетического состояния атомов веществ, входят в группу атомно - спектроскопических методов, различающихся по способу получения и регистрации сигнала. Общим для них является необходимость предварительной атомизации пробы.
Атомно - эмиссионная спектрометрия основана на испускании излучения атомами, возбужденными кинетической энергией плазмы, дугового или искрового разряда.
Атомно - флуоресцентная спектроскопия использует испускание излучения атомами, возбужденными электромагнитным излучением от внешнего источника.
Атомно - абсорбционная спектроскопия основана на поглощении атомами излучения от внешнего источника.
4.2. Молекулярно - спектроскопические методы
При исследовании энергетического состояния молекул веществ в зависимости от типа поглощающих частиц и способа преобразования избыточной энергии также выделяют несколько методов:
Молекулярная абсорбционная спектроскопия основана на поглощении световой энергии молекулами или сложными ионами.
Нефелометрический и турбидиметрический методы анализа основаны на измерении рассеянного или поглощенного света взвешенными частицами анализируемого вещества.
Люминесцентный анализ (флуориметрический) основан на измерении излучения после возбуждения молекул светом.
Магнитная резонансная спектроскопия основана на получении сигналов от молекул, помещенных в магнитное поле.
Рентгеновская спектроскопия основана на возбуждении внутренних электронов молекул.
4.2. Молекулярная абсорбционная спектроскопия
В свою очередь молекулярный абсорбционный анализ можно классифицировать по ряду параметров.
Участок электромагнитного спектра, используемый для облучения анализируемого вещества. В этом случае название метода соответствует названию области спектра.
Ультрафиолетовая (УФ) - спектроскопия. Для облучения используется ультрафиолетовое излучение, 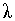 = 180 = 180 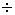 400 нм. 400 нм.
Спектроскопия видимой области. Используется видимая часть спектра с набором длин волн: 400 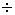 760 нм. 760 нм.
Инфракрасная (ИК) - спектроскопия. Для облучения анализируемого вещества используется инфракрасная область спектра.
Механизм взаимодействия вещества с электромагнитным излучением.
Колебательная спектроскопия. Под действием энергии поглощенного излучения в молекулах усиливаются собственные колебания атомов и атомных групп. Появление соответствующих колебательным переходам сигналов наблюдают в инфракрасной области, т. е. это ИК - спектроскопия.
Электронная спектроскопия. Достаточные количества энергии (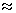 150 - 600 кДж / моль) вызывают переходы валентных электронов и электронов неподеленных пар. Соответствующие им сигналы появляются в области видимого и ультрафиолетового излучений, т. е. это УФ - спектроскопия и спектроскопия видимой области. Как уже упоминалось (см. предыдущий раздел), в чистом виде колебательных и электронных спектров нет; строго говоря, это колебательно - вращательные и электронно - колебательные спектры. 150 - 600 кДж / моль) вызывают переходы валентных электронов и электронов неподеленных пар. Соответствующие им сигналы появляются в области видимого и ультрафиолетового излучений, т. е. это УФ - спектроскопия и спектроскопия видимой области. Как уже упоминалось (см. предыдущий раздел), в чистом виде колебательных и электронных спектров нет; строго говоря, это колебательно - вращательные и электронно - колебательные спектры.
Аппаратурное оформление.
Спектрофотометрия. Для облучения анализируемого вещества используют монохроматический свет (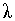 = const) в ультрафиолетовой, видимой и инфракрасной областях спектра. = const) в ультрафиолетовой, видимой и инфракрасной областях спектра.
Фотоколориметрия (колориметрия). Анализируемое вещество облучают светом с узким набором длин волн из видимой части спектра. Термин “колориметрия” (от лат. color - цвет) часто применяют в тех случаях, когда спектрофотометрическое определение проводят в видимой части спектра. Если же спектрофотометрическое исследование проводят в ультрафиолетовой, инфракрасной или другой части спектра, кроме видимой, то термин “колориметрия” неприемлем. Часто употребляется термин “фотометрические методы анализа”.
Цель анализа.
Качественный анализ. Для целей функционального и структурного анализа в основном используется ИК - спектроскопия.
Количественный анализ. Для определения количественного состава анализируемого объекта чаще используют спектроскопию УФ - и видимой областей спектра.
Количественные законы абсорбционного метода
Основные положения и законы абсорбции излучения справедливы для всех областей спектра - от рентгеновского до радиоизлучения Количественно поглощение излучения системой описывается законами Бугера - Ламберта - Бера и аддитивности.
5.1. Закон Бугера - Ламберта - Бера
При прохождении излучения через раствор светопоглощающего вещества поток излучения ослабляется тем сильнее, чем больше энергии поглощают частицы данного вещества. Понижение интенсивности зависит от концентрации поглощающего вещества и длины пути, проходимого потоком. Эта зависимость выражается законом Бугера - Ламберта - Бера.
Чтобы учесть потери света, прошедшего через раствор, на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель.
При одинаковой толщине слоя в кюветах из одного материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков света, и уменьшение интенсивности будет зависеть от концентрации вещества.
Отношение интенсивностей падающего и выходящего потоков света называют пропусканием или коэффициентом пропускания:
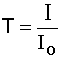 , (5.1.) , (5.1.)
где Io - интенсивность падающего потока света, I - интенсивность потока света, прошедшего через раствор.
Пропускание выражают в процентах. Для абсолютно прозрачных растворов Т = 100 %, для абсолютно непрозрачных Т= 0.
Взятый с обратным знаком логарифм Т называют оптической плотностью А:
А = - lg T = - lg 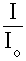 = lg = lg 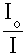 . (5.2.) . (5.2.)
Для абсолютно прозрачного раствора А = 0, для абсолютно непрозрачного - А   . .
Уменьшение интенсивности излучения при прохождении его через раствор подчиняется закону Бугера - Ламберта - Бера:
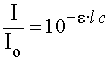 , ,
или
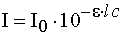 , ,
или
- lg T = A = 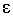 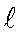 С , (5.3.) С , (5.3.)
где 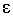 - молярный коэффициент поглощения, - молярный коэффициент поглощения, 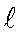 - толщина поглощающего слоя, см; С - концентрация раствора, моль / л. - толщина поглощающего слоя, см; С - концентрация раствора, моль / л.
Физический смысл молярного коэффициента поглощения становится ясен, если принять 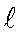 = 1 см, С = 1 моль / л, тогда А = = 1 см, С = 1 моль / л, тогда А = 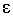 . Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора с толщиной слоя 1см. Молярный коэффициент поглощения - индивидуальная характеристика вещества, он зависит от природы вещества и длины волны и не зависит от концентрации и длины кюветы. . Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора с толщиной слоя 1см. Молярный коэффициент поглощения - индивидуальная характеристика вещества, он зависит от природы вещества и длины волны и не зависит от концентрации и длины кюветы.
Величины и обозначения
|
Определение
|
Размерность
|
Иное название и
обозначение
|
Пропускание Т
|
I / Io
|
безразмерна
|
Прозрачность Т
|
Оптическая плотность А
|
lg Io / I
|
безразмерна
|
Поглощение Д,
Экстинкция Е
|
Коэффициент
поглощения а, k
|
A / 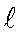 С С
|
зависит от размерности С и 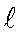
|
Коэффициент экстинкции k
|
Молярный коэффициент поглощения 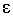
|
А / 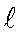 С С
|
л / cм· моль
|
Молярный коэффициент экстинкции
|
Толщина слоя (длина кюветы) l
|
-
|
см
|
в, d
|
В литературе часто встречаются различные названия и обозначения одних и тех же величин. В таблице 5.1. указаны некоторые термины, используемые наряду с приведенными выше.
Основные величины, используемые в абсорбционной спектроскопии
Значение 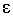 отражает способность вещества поглощать свет. Эта способность не безгранична и определяется строением молекулы; максимально возможное значение отражает способность вещества поглощать свет. Эта способность не безгранична и определяется строением молекулы; максимально возможное значение 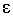 составляет 105 л· см -1·моль -1. составляет 105 л· см -1·моль -1.
|
 Скачать 353.5 Kb.
Скачать 353.5 Kb.


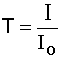 , (5.1.)
, (5.1.)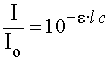 ,
,