Экзамен по химии ГУМРФ 1 курс. Экзамен^^.Химия. Закон действия масс 1865г. Бекетов 1867г. Гульдберг, Вааге создали закон действия масс
 Скачать 68.04 Kb. Скачать 68.04 Kb.
|
|
Вопросы к экзамену по химии для курсантов факультета навигации и связи 1. Химическая кинетика. – область химии, изучающая механизмы и скорость химической реакции и факторы, влияющие на них. Скорость гомогенных(однородных) реакций = -(∆С/∆t) = -(С2-С1)/(t2-t1), где C-концентрация, t - время Скорость гетерогенных(разнородных) реакций – определяется самой медленной из стадий (твердые вещества не учитываются) Закон действия масс: -1865г. – Бекетов -1867г. – Гульдберг, Вааге. – создали закон действия масс. Уравнение реакции – aA + bB = cC, где A,B,C – реагирующие вещества и продукты реакции, а,b,c – коэфициенты. Vc = K * C1^a * C2^b Например: 2CO + O2 = 2CO2 Vc = K * Cco^2 * Co2 Как изменится скорость реакции, если 1) Ссо увеличится в 3р. 2) P уменьшится в 2р. 1)))Vc’ = K * (3Cco)^2 * Co2 = 9V – скорость увеличиться в 9р. 2)))Vc’’ = K * (2Cco)^2 * 2Co2 = 8V – скорость уменьшится в 8р. 2. Зависимость Vc от T. 1879г. Vc1/Vc2 = гамма^(∆t/10), где ∆t – понижение или повышение температуры, гамма – температурный коэфициент. 3. Гомогенный и гетерогенный катализ. 4. Химическое равновесие – состояние химической системы, в которой возможны реакции, идущие с равной скоростью в разных направлениях. Условия химического равновесия: Uпр = Uобр. Константа химического равновесия: aA + bB = cC + dD Kp = ([C]^c * [D]^d) / ([A]^a * [B]^b) 5. Смещение равновесия. Принцип Ле Шателье – переход из 1 равновесного состояния в другое. Характеризуется другими скоростями прямой и обратной реакции. Равновесие смещается при изменении внешних воздействий (T, P, Cпр и Собр.). Если Uпр > Uобр., то равновесие смещается вправо, а если наоборот – влево. Если на систему, находящуюся в равновесии оказывается внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет эффект этого воздействия. 6. Влияние изменения температуры, давления и концентрации реагентов на смещение химического равновесия: - При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении — в сторону экзотермической (выделение) реакции. - При повышении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении — в сторону большего объёма. Этот принцип действует только на газы, то есть если в реакции участвуют твёрдые вещества, то они в расчёт не берутся. - Введение в равновесную систему дополнительного количества вещества, ускоряет ту реакцию, в которой это вещество расходуется, т.е. добавление исходного вещества смещает равновесие вправо и наоборот. 7. Растворы – физико-химические смеси переменного состава, состоящих из 2-х или более компонентов и продуктов их взаимодействия. Существуют твердые растворы – сплавы; газообразные; жидкие (водные – растворитель вода и не водные – растворитель бензол и др.; любой р-р = растворитель [вещества взятом в большем количестве и растворенного вещества.]) Уксус – р-р кислоты в воде (растворитель – вода) Уксусная эссенция – р-р воды в кислоте (растворитель – кислота) Классификация растворов: Относительное содержание вещества в растворе, характеризует его концентрацию, поэтому существуют концентрированные и разбавленные растворы. Растворимость – способность вещества растворяться в растворителе. - растворимые - > 10г. на 100 г.воды - малорастворимые - < 1г. на 100 г.воды - нерастворимые - < 0,01 г. на 100г.воды 8. Вода – универсальный растворитель. Вода обладает аномальными свойствами: - высокой теплоемкость. - восокими растворяющими свойствами - имеет самое большое поверхностное натяжение после ртути - плотность льда меньше плотности воды – поэтому лед и не тонет. Это объясняется тем, что вода имеет угловое строение, а не линейное. Высокая теплоемкость воды объясняется тем, что часть теплоты затрачивается на разрыв водородных связей. Прочность водородных связей приводит к тому, что у воды необычная точка плавления и кипения. Когда рвутся водородные связи, т.е. при нагреве от 0 до 40С, уменьшается V воды и повышается ее плотность, поэтому лед и не тонет. 9. Растворы электролитов и неэлектролитов Электролиты – вещества, которые проводят электрический ток в растворе или расплаве. Неэлектролиты – не обладают ионной проводимостью. В растворах электролитов больше частиц, чем показывают расчеты, выше Tкип. и ниже Tзамерз., чем у растворителя и растворов неэлектролитов. Теория электролитической диссоциации – 1887г. – Арениус – ЭД(электролитическая диссоциация) – процесс распада на ионы в растворе или расплаве. Ионы могут переносить ток => электролиты проводят ток. Al2(SO4)3 = 2Al + 3SO4 Теория объясняла увеличение числа частиц в растворе (из 1->5) и ионную проводимость. Современная теория создана академиком Каблуковым – доказал, что при растворении происходит взаимодействие вещества с водой, которое приводит к образованию гидратов и потом они диссоциируют на ионы. Современное положение ЭД: 1) электролиты при растворении в воде диссоциируют (распадаются) на ионы, которые беспорядочно движутся в разных направлениях. 2) при прохождении электрического тока движение становиться направленным. Положение движения к катоду и называется – катионами, а отрицательное к аноду – анионами. 3)диссоциация обратимый процесс. Сколько молекул диссоциируют, столько же и ассоциирует. К электролитам относят: кислоты, щелочи, соли. К неэлектролитам относят: растворы органических соединений 10. Электролиты делятся на сильные и слабые по степени диссоциации. α – степень диссоциации α = Nд / Nобщ, где Nд – кол-во продиссоциировавших молекул, Nобщ – общее количество молекул. α < 30% - слабый электролит α > 30% - сильный электролит Сильные электролиты: Соли, щелочи и некоторые кислоты (H2SO4, HCl и т.д.) Сильные электролиты распадаются полностью, поэтому закономерности для слабых электролитов применяются с поправками для сильныхю Дебаем и Хюккелем – 1923г. NaCl -> Na(+) + Cl(-) H2SO4 -> 2H(+) + SO4(2-) NaOH -> Na(+) + OH(-) Слабые электролиты: 11. Константа дисоциации(Кд) = Константе равновесия(Кр). Диссоциация слабых электролитов обратимаю CH3COOH(α=1.3%) ↔ CH3COO(-) + H(+) Кд=Кр = [CH3COO(-)]*[H(+)] / [CH3COOH] = 1,8*10^(-5) Чем меньше Кр, тем слабее диссоциация электролитов, тем устойчивее его молекулы. СД и Кр связаны законом Освольда: СД слабого электролита прямо пропорциональна разбавленному раствору и обратно пропорциональна концентрации. Фото 1 12. Ионные реакции в растворах. Направление протекания реакций определяется правилом. Ионно-обменные реакции идут необратимо, если образуются труднорастворимые, малорастворимые, легколетучие или газы и слабодиссоциирующие вещества. 1)Реакции, протекающие с образованием труднорастворимых веществ AgNO3 + NaCl -> AgCl↓ + NaNO3 Ag(+) + NO3(-) + Na(+) + Cl(-) -> AgCl↓ + Na(+) + NO3(-) Ag(+) + Cl(-) -> AgCl↓ 2)Реакции, протекающие с образованием легколетучих веществ. Na2CO3 + 2HCl -> H2CO3(H2O+CO2) + 2NaCl CO3(2-) + 2H(+) -> CO2 + H20 3)Реакции, протекающие с образованием слабодиссоциирующих соединений. CH3COOH + KOH -> CH3COOH + H2O CH3COOH + OH(-) -> CH3COO(-) + H2O 13. Ионное произведение воды. Водородный показатель Химически чистая вода – слабый электролит, поэтому распадается на: H20 ↔ H(+) + OH(-) 2H2O ↔ H3O(+) + OH(-) Процесс ЭД обратим поэтому Kд=Кр = 1,8*10^(-16) Kh2o = [H(+)]*[OH(-)] = 55,56 * 1,8 * 10^(-16) = 10^(-14) – ионное произведение воды( для 22оС) При 100 градусах Kh2o = 74 * 10^(-14) 14. Способы определения водородного показателя. Индикаторы. Сережин предложил формальную величину – водородный показатель. pH = - lg [H(+)] pH = - lg 10^(-7) = 7 – нейтральная среда. pH < 7 – кислая среда pH > 7 – щелочная среда pH + pOH = 14 pOH – гидроксильный показатель индикаторы: Фенол-фталеин , Метил-оранжевый, лакмус 15. Жесткость воды. Виды жесткости. Обусловлена содержанием солей Ca и Mg, Fe, Zn и т.д. Но в поверхностных слоях в основном содержаться Ca и Mg, поэтому остальные не учитываются. В основном это соли CaCl2, MgSO4,Ca(HCO3)2. Еденица измерения жесткости – градус жесткости(dо, dHо) – содержание ионов кальция и магния. Единица измерения в СИ ммоль/л. Единица измерения в России – мг-экв/л. Различают постоянную и временную жесткость. Временная определяется Ca(HCO3) и Mg(HCO3). К постоянной относят хлориды, сульфаты кальция и магния. Общая жесткость – сумма временной и постоянной. 16. Химические способы устранения жесткости воды. Химические способы: известково-содовый и фосфатный CaCl2 + Na2CO3 -> CaCo3↓ + 2NaCl MgSO4 + 2Na3PO4 -> Mg3(PO4)2 + 3Na2SO4 Ca(HCO3) + Ca(OH)2 -> 2CaCO3 + 2H2O 17. Физические способы устранения жесткости воды. Ионообменный способ. Физический метод: метод ионного обмена. После истощения ионитов производят регенерацию. Умягчение воды методом ионного обмена происходит следующим образом. Жесткая вода проходит через фильтры умягчения воды, внутри которых засыпаны ионообменные смолы. Смола – это синтетические гранулы, в которые введены ионогенные группы путем химического взаимодействия. 18. Дисперсные системы. Общее понятие о дисперсных системах. Примеры. Истинные растворы – молекулярные смеси 10-9м = 1 нм Существуют дисперсные системы, в которых 1 вещество рапределено в среде другого в виде очень мелких частиц. Системы состоят из дисперсной фазы и дисперсионной среды. Дисперсионная среда – непрерывная фаза, в которой распределены частички дисперчной фазы в виде очень мелких кристаллов, пузырьков, аморфных частиц(нестабильных). Основным условием существования ДС(дисперсных систем) – их гетерогенность. Соль или сахар, растворенные в бензоле или керосине – это дисперсные системы. В основном природные воды – тоже дисперсные системы. Примеры: Взбитые сливки, облака, пасты,пенобетоны. 19. Классификация дисперсных систем. по размеру частиц дисперсной фазы (10-3 – 10-9) - грубодисперсные( взвеси) – 10-3 – 10-5 - тонкодисперсные (микрогетерогенные) – 10-5 – 10-7м - калойднодисперсные (улитрамикрогетерогенные) – 10-7 – 10-9м 2) - по агрегатному состоянию фаз системы. Предложена Оствальдом, используется до сих пор Классификация по размеру фаз предложена Оствальдом Дисперсные системы бывают связно дисперсные и свободно дисперсные, в зависимости от того есть ли взаимодействие между частицами в дисперсной фазе. Свободно - тякучие, называются.
20. Окислительно-восстановительные процессы. ОВР – реакции, идущие с изменением степени окисления, в отличии от вышеуказанных, наиболее распространены в природе, является основой электрохимии (процессов коррозии и способов защиты от нее).Определяет химический состав вод, морей и океанов. ОВР – основа процессов дыхания, фотосинтеза, гниения. У металлов всегда положительная степень окисления. Соответствуют если высшие то номеру группу в котором находится металл. За исключением золота, осмия, рутения. Степень окисления не металлов может быть как положительной и отрицательной. В соединении металлов всегда минус, а с неметалоов все что угодно. Высшая положительная не металла соответствует номеру группы, высшая отрицательная (8-номер группы). Для определения степени окисления используют несколько положений. 21. Составление уравнений ОВР Сначала определяют продукты реакции (экспериментально или зная хим. Св-ва) Определяют окислитель и восстановитель, а также значение степеней окисления, которые меняются в процессе реакции. Далее различными методами расставляют коэфициенты в ОВР(метод электронного баланса, метод электронно-ионного баланса – метод полуреакций и др.) Пример: KMnO4 + KI+H2SO4 - > K2SO4 + MnSO4 + I2 + H2O Расставляем степени окисления Выписываем элементы, меняющие степени окисления(2) Mn(+7) + 5e = Mn(+2) - восстановление 2I(-1) – 2e + I2(0) – окисление Сначала уравниваем металлы, кисл. остатки, водород Проверка : осуществляется кислородным баллансом – считаем кислород 8 + 32 = 40 атомов кислорода в левой части 24 + 8 + 8 = 40 атомов кислорода в правой части Л.ч = п.ч. 22. Типы ОВР реакция диспропорционирования (самоокисление, самовосстановление) – это реакции в которых степень меняется у одного и того же атома, в одной и той же молекуле. реакция внутримолекулярного окисления и восстановления – это реакция, идущая в одной молекуле с изменением степени окисления разных атомов. реакция межмолекулярного окисления и восстановления – реакции, в которых меняется степень окисления разных атомов в разных молекулах 23. Гальванические элементы. Понятие об электродных потенциалах. Гальванические элементы – устройства, в которых химическая энергия превращается в электрическую. ГЭ – состоит из двух металлов, погруженных в раствор своих солей и соединенных металлическим проводником. Контакт между солями осуществляется с помощью перегородки. 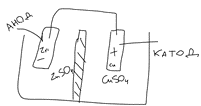 Возникновение электрического тока объясняется сложным взаимодействием металлов с молекулами воды, ориентированных у их поверхности. Ионы у более активного металла отрываются и в гидрированном состоянии (содержат воду) переходят в раствор, при этом металл заряжается отрицательно, а раствор положительно. 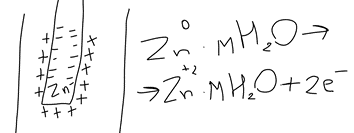 образуется двойной электрический слой и возникает разность потенциалов ΔЕ между металлом и солью. 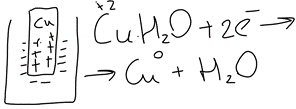 на поверхности менее активного металла Cu также возникает двойной электрический слой, только металл заряжается положительно, а раствор отрицательно. при соединении металлов проводником образуется электрический ток, растворяется цинковая пластина, выделяется медь на медной пластине. Для количественной характеристики ОВР пользуются величинами электродных потенциалов (E), то есть разницой потенциалов между металлом и соллью. Zn0 – 2e -> Zn+2 - процесс окисления, в электрохимии анодный. Cu+2 + 2e -> Cu0 - процесс восстановления, в электрохимии катодный. 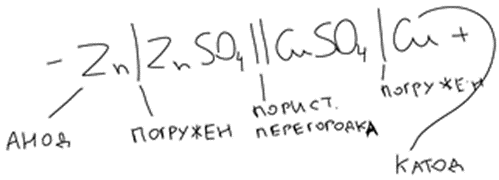 24. Стандартный водородный электрод и ряд стандартных электродных потенциалов металлов. Стандартный водородный электрод представляет собой платиновую пластинку, покрытую слоем платиновой черни, погруженной в раствор серной кислоты, с концентрацией = 1 моль/л, через которую пропускают H2 под давлением 1 атмосфера. Водород абсорбируется на платиновой пластинке и платина его поглощает. Схема водородного электрода : Pt,H2|2H+||Cu+2|Cu+ Стандартный электронный потенциал (Eo) – потенциал, возникающий при погружении в раствор концентрации 1 моль/л, измеренный по отношению к стандартному водородному электроду. Распологая металлы в порядке возрастания их электронных потенциалов, получают электрохимический ряд напряжения металлов. 25. Ряд стандартных электродных потенциалов металлов и химическое поведение металлов в растворах. Ряд напряжений позволяет сделать общие выводы относительно химической активности металлов в растворе: 1) Наиболее активные металлы расположены в начале ряда, наименее активные – в конце. 2) Каждые металл восстанавливает все следующие за ним из водных растворов их солей Al + CrCl3 -> Cr + AlCl3 Cr + AlCl3 -/> Сам этот металл может быть восстановлен любым стоящим до него Na + AlCl3 -> 3NaCl + Al 3) Только металлы стоящие до водорода вытесняют его из водных растворов кислот, но кроме HNO3 (азотной кислоты) Sn + HCl -> SnCl2 + H2 4) Активные металлы начала ряда напряжения вытесняют водород из воды. Mg вытясняет водород только из горячей воды. Металлы после Mg с водой не реагируют. Ca + H2O -> Ca(OH)2 + H2 Пример: 1) Какой из металлов Ag Или Fe не расстворется в соляной кислоте 2) Какая рекция замещения возможна: Al + CuCl2; Cu + AlCl3 3) Какова роль медного электрода в цепи ГЭ Pb|Pb+2||Cu+2|Cu катод Ag|Ag+||Cu+2|Cu анод 26. уравнение нернста. Электродвижущая сила. Электродный потенциал зависит не только от активности металла, но от концентрации соли, в которую он погружен. 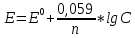 Где, Е – Электродный потенциал , Е0 – стандартный электродный потенциал, n – количество e- в электронном процессе, С – концентрация соли. ЭДС – электродвижущая сила – максимальное напряжение, существующее между катодом и анодом в ГЭ. – всегда положительно эдс = Ек – Еа Пример: Определить Эдс ГЭ из Cd|CdCl2||CuCl2|Cu, где CdCl2 = 0,001(моль/л), CuCl2 = 0,01(моль/л) Анод – Cdo – 2e = Cd+2 Катод – Cu+2 + 2e = Cuo  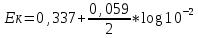 = 0,337 – 0,06 = 0,2813 = 0,337 – 0,06 = 0,2813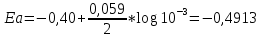 ЭДС = Ек – Еа = 0,77В 27. Концентрационный гальванический элемент. Зависимость Электрод потенциала от его ионов в растворе позволяет создать ГЭ, электроды которого сделаны из 1 металла, погруженные в растворы с разной концентрацией. Такие устройства называются концентрационными ГЭ -Ag|AgNO3||AgNO3|Ag+ C1 < C2 C1 – концентрация, в которую погружен анод, С2 – катод Пример: Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС ГЭ, состоящего из Ag, растворов С1 = 0,01(моль/л), С2 = 0,1(моль/л) Анод – Ago – 1e = Ag+ Катод – Ag+ + 1e = Ago Ек= 0,80+ 0,059/1*log〖〖10〗^(-1)= 0,74В〗 Еа= 0,80+ 0,059/1*log〖〖10〗^(-2)= 0,68В〗 ЭДС = Ек – Еа = 0,74 – 0,68 = 0,06В 28. Коррозия металлов. Виды коррозии. Коррозия – самопроизвольно протекающий процесс разрушения металлов под действием окружающей среды. Ущерб от коррозии составляет ≈10% мирового металлургического производство. На судах морского флота коррозии подвергаются: корпус судна, особенно в подводной части; надстройки; СЭУ. В зависимости от свойств окр.среды различают 2 вида коррозии: - Химическая – возникающая под действием жидкостей, являющихся неэлектролитами (нефть, бензол, фенол) и сухих газов. - электрохимическая коррозия – возникает под действием жидких электролитов (солей, кислот, щелочей, грунтовых вод, морской воды, пресной воды) и влажного воздуха. Химическая коррозия Она возникает без возникновения электрического тока, под действием агрессивных компонентов окружающей среды. В зависимости от вида среды различают: химическую коррозию в растворах неэлектролитов и газовую коррозию. Жидкостной коррозии подвержены детали и узлы оборудования химического производства. Газовой коррозии: nMe0 + mO20 -> MenOm Металл разрушается и отдает электроны, кислород – восстанавливается, образуется плотная окисная пленка. Она идет в Двигателях внутреннего сгорания, на оболочках ракет и космических кораблей, соплах самолетов. Электрохимическая коррозия Она протекает в растворах электролитов с возникновением электрического тока. При контакте 2-х металлов разной активности возникает гальванический коррозионный элемент без внешней цепи. Поведение металлов зависит от их электродного потенциала такэе как в ГЭ анодом становится более активный металл(она окисляется), причем чем ниже Е0, тем ниже его коррозионная стойкость. Катод – менее активный металл – не восстанавливается, электроны с него удаляются во внешнюю среду. Процесс отвода электронов называется деполяризацией, а вещества – деполяризаторами. Различают 2 процесса деполяризации: 1) процесс с водородной деполяризацией на катоде К+ 2Н+ + 2e = H20 рН < 7 (кислая среда) 2) катодный процесс с кислородной деполяризацией K+ O2+ + 2H2O + 4e = 4OH- pH >=7 (щелочная и нейтральная среда) Морская вода, атмосфера. Различают макрогальванокоррозию и микрогальванокоррозию. Макрогальванокоррозия – возникает при контакте металлов разной активности. Пример: Коррозия луженого (покрытого оловом) железа в кислой среде. Fe(E0) = -0,0448B – Анод Fe0 – 2e -> Fe+2 Sn(E0) = -0,14B – Катод 2H+ + 2e = H20 29. особенности коррозии металлов в морской воде. Коррозия луженого железа в морской воде Fe|Sn pH = 7,7 – 8,4 Рис1 Fe(E0) = -0,0448B – Анод Fe0 – 2e -> Fe+2 Sn(E0) = -0,14B – Катод O2 + 2H2O + 4e = 4OH- Fe+2 + 2OH- -> Fe(OH)2↓Белая коррозия -> Fe(OH)3↓ Бурая коррозия. Микрогальванокоррозия (коррозия корпуса судна в морской воде) – поверхность корпуса неоднородна, содержит примеси, царапины после термической обработки, поэтому в стали содержится углерод, цементит(Fe3C) и цветные металлы. Эти примеси имеют более высокий электродный потенциал Рис2 Анод Fe0 – 2e -> Fe+2 Катод (Fe3C) O2 + 2H2O + 4e = 4OH- Fe+2 + 2OH- -> Fe(OH)2 – Белая коррозия 4Fe(OH)2 + O2 + 2H2O -> 4Fe(OH)3 – Бурая коррозия Коррозия при неравномерной аэрации (Газ) происходит при разном смачивании металла корпуса судна. Наиболее опасна коррозия в районе ватерлинии, потому что она переменная. Окисление металла происходит на менее аэрируемых, а восстановление кислорода на более аэрируемых. 30. способы защиты металлов от коррозии. Легирование (получение сплавов) – по правилу таммона – добавление 1/8 атомной доли легирующей добавки к 7/8 долям металла резко повышает устойчивость сплава к коррозии. Это приводит к упрочнению решетки металла. Нанесение неметаллических покрытий (краски, лаки, полимеры) – препятствует доступу кислорода к поверхности металла. Нанесение металлических покрытий – покрытием слоем другого металла : Если защищаемый металл менее активен, чем тот, который его покрывает, то покрытие называется анодным. Например: Fe|Zn – железо, покрытое цинком – анодное покрытие Катодным покрытием называется покрытие менее активным металлом : серебром, оловом и т.д. Например: Fe|Sn – олово – катод. Покрытие слоем других металлов защищает железо при условии сплошности – отсутствие трещин и царапин. При нарушении сплошности , коррозия протекает даже быстрее, чем без покрытия. Это электрохимическая защита. Протекторная защита – используется в случаях, когда защищаемый металл (корпус судна) находится в среде электролита (морской воде). К корпусу судна прикрепляется болтами металла с более низким электродным потенциалом, чем защищаемый, создается ГЭ с анодом из металла протектора (Mg, Al), протектор разрушается, а корпус судна, который является катодом, какое-то время защищен. Для корпуса судна используют Алюминиево- магниевые протекторы, а для внутренних емкостей танкерного флота – цинковые протекторы. Масса протектора рассчитывается по формуле 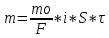 Где m – масса протектора mэ – эквивалентная масса протектора F – 26,8 А*ч – постоянная фарадея i – плотность тока (А/м2) S – площадь поверхности (м2) τ – время в часах Пассивация металлов (1836 – Фарадей) – фарадей предположил, что железо или другой металл при контакте с концентрированными кислотами пассивируются – образуют плотную, чаще окисную иногда фосфатную, сульфатные пленки, толщиной в несколько нанометров. Ингибиторы коррозии металлов – замедляют процесс коррозии в различных агрессивных средах. Они взаимодействуют с промежуточными продуктами реакции или с активными центрами, на которых протекают реакции. Наиболее простой ингибитор атмосферной коррозии NaNO3. Им консервируют изделия из стали и чугуна. |
