Закон движения материальной точки. Траектория. Вектор перемещения. Путь
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
Средняя арифметическая скорость молекулСредняя квадратичная скорость | 23. Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Теорема о равнораспределении энергии по степеням свободы. Формула расчета внетренней энергии идеального газа. Внутренняя энергия идеального газа представляет собой лишь кинетическую энергию движения молекул, поскольку потенциальная энергия взаимодействия молекул в идеальном газе отсутствует. Энергия движения молекулы определяется, в свою очередь, энергией ее поступательного движения, энергией ее вращения и энергией колебания атомов в молекуле: Минимальное число независимых переменных, однозначно определяющих положение тела в пространстве (или минимальное число независимых перемещений тела в пространстве) наз. числом степеней свободы ( i ) тела. Для одноатомной молекулы i = 3 Закон Больцмана о равномерном распределении энергии молекул по степеням свободы: если система молекул находится в тепловом равновесии при температуре Т, то средняя кинетическая энергия молекул равномерно распределена по степеням свободы, причем на каждую степень свободы приходится энергия Кинетическая энергия молекул, содержащихся в моле идеального газа Если же рассмотреть ν молей идеального газа, то кинетическая энергия его молекул Внутренняя энергия заданного числа молей идеального газа – однозначная функция его температуры. Она зависит только от состояния идеального газа и не зависит от того, каким образом газ пришел в данное состояние. Изменение внутренней энергии данной массы идеального газа в произвольном процессе | 24. Количество теплоты и работа. Первое начало термодинамики. Расчет величин, входящих в первое начало термодинамики. Применение первого начала термодинамики к изобарическому и изотермическому процессам. Работой, совершаемой над системой, наз. энергия, передаваемая термодинамической системе при силовом взаимодействии с ней. Энергия, передаваемая термодинамической системе внешними телами путем теплообмена, наз. теплотой (количеством теплоты), получаемой системой от внешней среды. Первое начало термодинамики: Или При сообщении системе бесконечно малого количества теплоты первое начало термодинамики записывается так: Элементарное количество теплоты, сообщаемое термодинамической системе для изменения ее температуры на dT: Изменение внутренней энергии идеального газа: Элементарная работа, совершаемая газом над внешними телами: Изохорный процесс: Изобарный процесс: 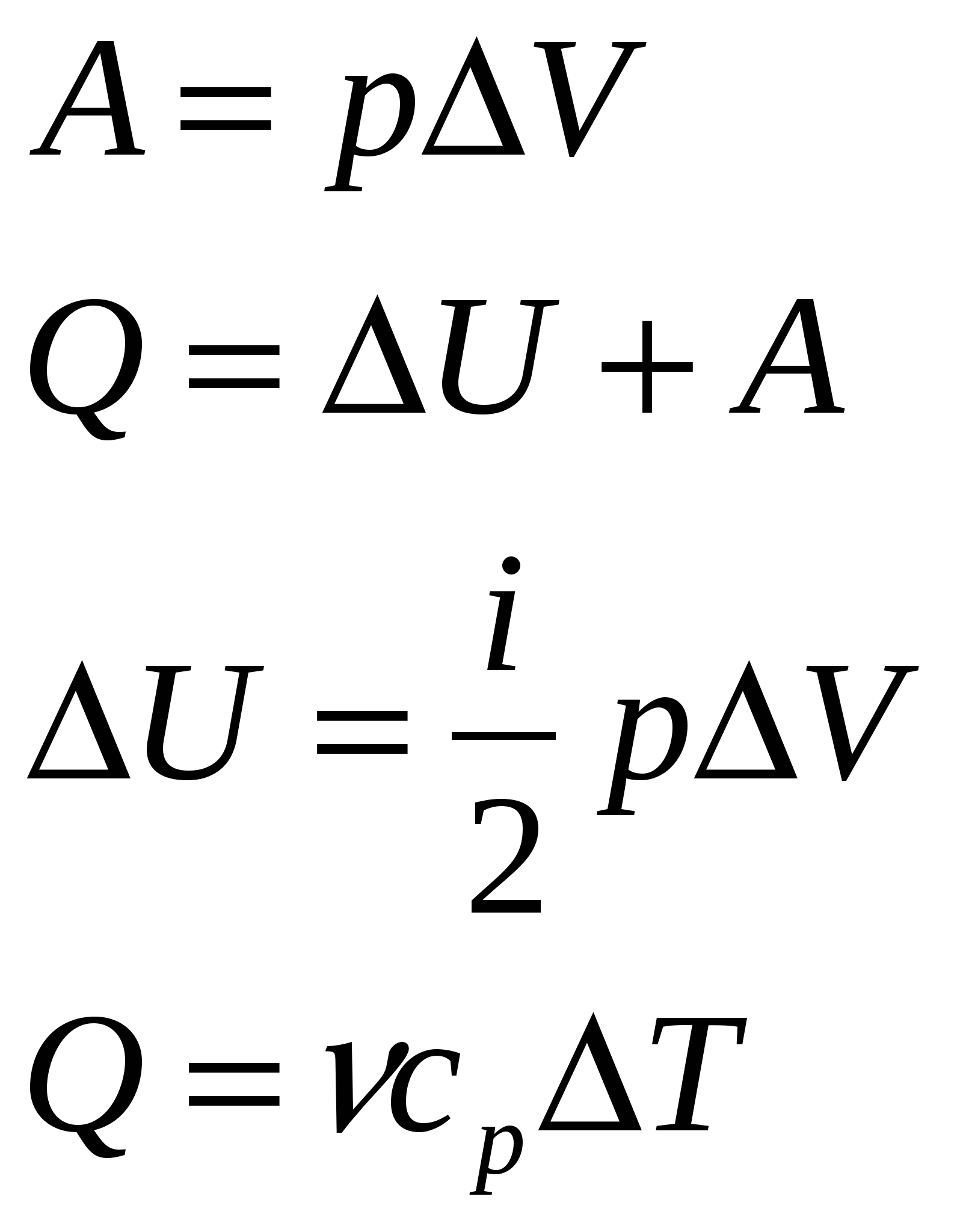 Изотермический процесс: 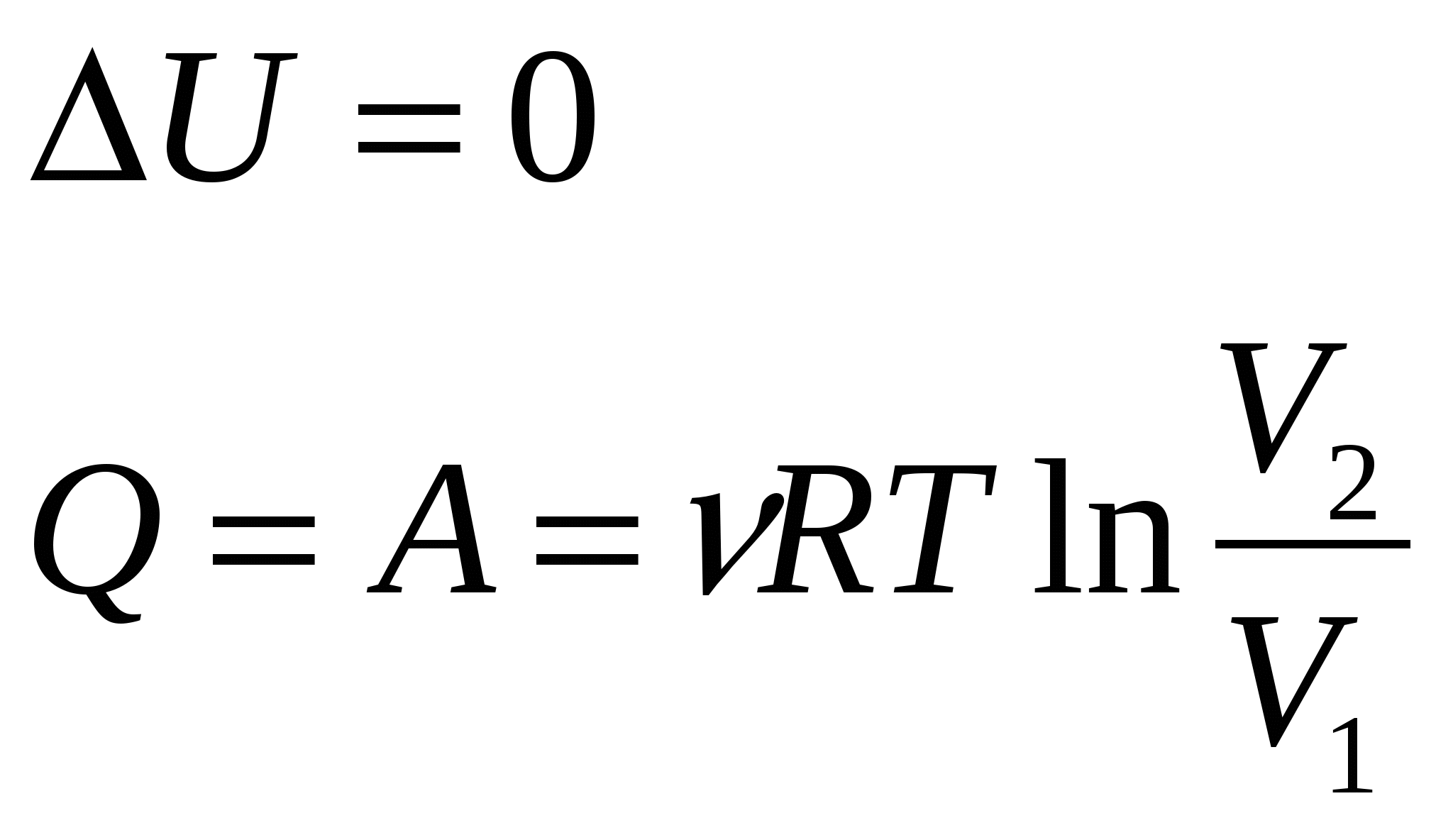 |
| 25. Первое начало термодинамики (различные формулировки). Применение первого начала термодинамики к изохорическому и адиабатическому процессу. Первое начало термодинамики: Или При сообщении системе бесконечно малого количества теплоты первое начало термодинамики записывается так: Элементарное количество теплоты, сообщаемое термодинамической системе для изменения ее температуры на dT: Изменение внутренней энергии идеального газа: Элементарная работа, совершаемая газом над внешними телами: Изохорный процесс: Адиабатный процесс: | 26. Политропические процессы в идеальном газе. Уравнение политропы. Изопроцессы как частные случаи политропического процесса. Ограниченность классической теории теплоемкости. Теплоемкость тела (системы) численно равна количеству теплоты, которое необходимо сообщить телу (системе), чтобы изменить его температуру на 1 К в данном процессе: Удельная теплоемкость вещества численно равна количеству теплоты, которое необходимо сообщить единице массы тела (системы), чтобы изменить его температуру на 1 К в данном процессе: |
